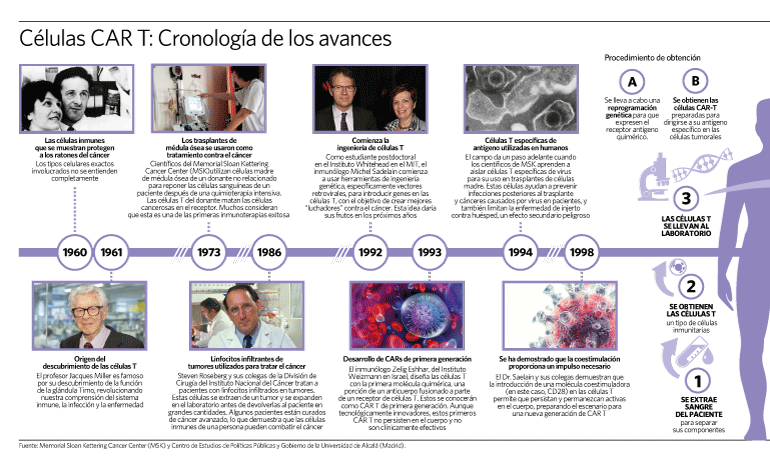
Descripcion de la técnica de la terapia con células Programadas CAR-T
El problema de esta técnica revolucionaria, son las complicaciones en las que la inserción de células vivas del paciente pero modificadas para combatir a los tumores fundamentalmente y por ahora de origen sanguíneo.
Junto al síndrome de liberación de citocinas y la neurotoxicidad, la terapia CAR-T se asocia con otras posibles toxicidades, como las citopenias posterapia, reportadas en un 60-80% de pacientes tratados y cuya fisiopatogenia está poco descrita; sí se sabe que presentan un patrón bifásico: una primera fase inicial (probablemente causada por la linfodepleción) y otra tardía (de etiología incierta).
En el Hospital General Universitario Gregorio Marañón, ha expuesto los datos de un estudio realizado en su centro que buscaba describir la frecuencia y dinámica de las citopenias post terapia CAR-T comercial, con el objetivo secundario de analizar la presencia de factores clínico-analíticos que predispongan al desarrollo de estas toxicides.
El trabajo se centró en el estudio restrospectivo de pacientes consecutivos sometidos a terapia CAR-T comercial en este centro madrileño entre junio de 2019 y marzo de 2021. Martín Rojas expone que “las citopenias persistentes no asociadas a recidiva o progresión fueron una complicación frecuente post CAR-T, presentes en un 65% de los pacientes en el día +28; más allá de este día, hasta un 47% de pacientes presentó citopenias severas, con una mayor incidencia en el día +180”.
La dosis de quimioterapia de linfodepleción y la infiltración medular al diagnóstico fueron “factores predictores independientes para el desarrollo de citopenias profundas en el día +28”. No obstante, la especialista aclara que harán falta más pacientes y un seguimiento más prolongado para confirmar esta posible relación.
Los estudios de vida real en diferentes centros sobre el tratamiento con linfocitos CAR-T están avalando los datos aportados por los estudios pivotales. La experiencia del Hospital Universitario de Salamanca con el tratamiento de los dos CAR-T industriales disponibles para pacientes con linfoma B difuso de célula grande (LBDCG) en recaída o refractario confirman el perfil de seguridad manejable y una elevada tasa de respuestas.
La observación de los resultados obtenidos en los enfermos que han recibido las CAR-T en el centro salmantino desde mayo de 2019 hasta agosto de 2021 arroja otras conclusiones presentadas por la hematóloga Ana África Martín López. En total, tras valorar a 115 pacientes con diferentes tipos de linfoma, se realizó la aféresis de linfocitos a 71 (62%) y de ellos, 52 pacientes recibieron la infusión de células CAR-T.
Entre los pacientes con LBDCG, Martín López expone que “los íntesamente pretratados tuvieron peores resultados (al menos tres líneas de tratamiento), lo que indica la importancia de derivar a los pacientes de forma presencial en cuanto cumplan indicación de tratamiento”. Por el contrario,”observamos mayores tasas de respuesta completa y de respuesta global en pacientes no refractarios, y en aquellos que se encontraban en respuesta previa al inicio de la linfodepleción.
La baja carga tumoral medida por el volumen tumoral metabólico se asoció a “mejores tasas de respuesta completa y mayor supervivencia libre de progresión. Se necesitan series más largas y un mayor seguimiento para desarollar modelos pronósticos basados en el volumen tumoral metabólico que puedan ser utilizados en la práctica clínica”. De cara a futuro, la especialista propone establecer estrategias para reducir la carga tumoral antes de la terapia CAR.
La terapia con células ARI-0001 constituye la primera CAR-T académica íntegramente realizada en Europa -en el Hospital Clínic de Barcelona– que recibió en febrero la aprobación de la Agencia Española del Medicamento y Productos Sanitarios (Aemps) para su uso excepcional hospitalario. Uno de los investigadores que han participado en este desarrollo, el hematólogo del Clínic Valentín Ortiz Maldonado, repasa en tres comunicaciones orales la experiencia con esta terapia -linfocitos T autólogos transducidos con un vector vírico para actuar frente a CD19- que se administra a pacientes fuera de la indicación de los CAR-T antiCD19 comerciales; en concreto, en pacientes con leucemia aguda linfoblástica B en recaída o refractaria con enfermedad extramedular aislada.
Para analizar este perfil de enfermedad no se ha reclutado un número tan grande de pacientes como el que se incluyen en los ensayos clínicos pivotales realizados con otras CAR-T. Los datos comunicados de este estudio proceden de 15 pacientes con una mediana de edad de 29 años, incluidos tres niños, con una mediana de cinco líneas de tratamiento previo. “Los resultados de seguridad y eficacia se encuentran en línea con otros productos (de Estados Unidos, Europa y China) académicos o industriales actualmente disponibles”, comenta Ortiz Maldonado. “Estos pacientes no deberían estar excluidos de las CAR-T comerciales, pues en nuestra experiencia los resultados son buenos”.
Factores de asociación a la supervivencia
Sesiones científicas orales en el congreso de la SEHH y SETH.
En otro estudio analizaron qué factores podían asociarse a la supervivencia libre de progresión en los pacientes tratados. Para ello, de nuevo revisaron los resultados de los pacientes con leucemia aguda linfoblástica B en recaída o refractaria (LLA-B R/R) tratados en dos centros desde julio de 2017 hasta diciembre de 2020, incluyendo a pacientes del ensayo CART19-BE-01 -el que permitió la aprobación de la Aemps- e incluidos en el programa de uso compasivo consecutivo.
El tratamiento “pudo alcanzar respuesta completa a largo plazo en todos los subgrupos de pacientes con LLA-B R/R. Sin embargo, los remitidos con menos del 5% de blastos de médula ósea y aquellos con pérdida de aplasia de células B después de la terapia celular tuvieron una supervivencia libre de progresión más corta”, expone. La relevancia clínica del momento exacto y del grado de recuperación de los linfocitos B (además de su recuperación en sí) requiere de mayor estudio, por lo que “los tratamientos de consolidación en estos pacientes deben considerarse cuidadosamente”.
En una tercera comunicación sobre leucemia linfocítica crónica y transformación a Richter, las células ARI-0001 en seis pacientes registraron un adecuado perfil de seguridad y eficacia en monoterapia.
Probióticos: un posible adyuvante en la terapia CAR-T
Modular la microbiota intestinal hacia un fenotipo inmunitario más proinflamatorio o antinflamatorio podría influir a su vez en la terapia con células CAR-T.
Vellosidades del intestino delgado. Sonia Moreno
El posible papel etiológico de los microorganismos se estudia desde hace años en el linfoma no Hodgkin. Una de las explicaciones que se postulan consiste en la estimulación antigénica crónica, por la que la persistencia permanente de un microorganismo en nuestro cuerpo estimularía de manera continua al linfocito B, provocando su proliferación. De hecho, este mecanismo se ha observado con virus como el de la hepatitis B, bacterias como Helicobacter pylori y parásitos como Plasmodium.
De aquí parte una líneas de trabajo en el Instituto de Investigación Hospital 12 de Octubre y la Unidad de Investigación Clínica de Tumores Hematológicos del H120-CNIO (Centro Nacional de Investigaciones Oncológicas) donde se estudia la relación de diversas enfermedades con la microbiota intestinal, la mayor superficie de contacto de microorganismos con nuestro cuerpo.
La flora intestinal juega un papel clave en la eficacia de la respuesta y la toxicidad de los tratamientos antitumorales, especialmente en el caso de la inmunoterapia. Se ha estudiado especialmente el caso de los anticuerpos anti-PDL1 en melanoma, donde se ha constatado un diferente microbioma en pacientes no respondedores y respondedores al tratamiento.
Más concretamente, en el ámbito de la patología hematológica, se sabe que la microbiota intestinal está involucrada en la regulación de la hematopoyesis y en el correcto desarrollo del sistema inmune. En el trasplante de progenitores hematopoyéticos (TPH) se ha observado que una situación de disbiosis (pérdida de diversidad de la microbiota) está más relacionada con la aparición de la enfermedad de injerto contra receptor o con la recaída.
Linfoma no Hodgkin tratado con CAR-T
Con estas premisas, el grupo del H120-CNIO ha estudiado si la microbiota intestinal podría modular y condicionar la respuesta al tratamiento CAR-T anti-CD19 en pacientes con linfoma no Hodgkin. El primer autor de esta comunicación, Roberto García Vicente, expone el diseño de un estudio piloto, con 16 pacientes tratados con CAR-T “de nuestro hospital, a los que clasificamos según su respuesta primaria como respondedores o refractarios. Antes de la infusión de la terapia se recogió una muestra de heces, de la que extrajimos el ADN microbiano”.
Los pacientes refractarios al tratamiento presentaban una microbiota intestinal con menor cantidad, riqueza, equidad y diversidad “intraindividual” que los respondedores. Su microbiota tenía una menor abundancia del filo Proteobacteria que la de los respondedores. También presentaban una microbiota con mayor abundancia de Enterococcaee y Vagococcaceae que los respondedores; “de estas bacterias se ha descrito que poseen la capacidad de suprimir o inhibir el sistema inmunitario, reducir la secreción de citocinas proinflamatorias o de inducir la secreción de otras con carácter proinflamatorio como la IL-10”, matiza García-Vicente.
En cambio, la mayor abundancia de Enterobacteriaceae presente en los respondedores se puede interpretar como una disbiosis que favorece el aumento de la secreción de las citocinas proinflamatorias y la diferenciación de los linfocitos TH1 y TH17.
Modelo de influencia
Los hallazgos de este trabajo ha llevado a estos investigadores a proponer un modelo, en fase de validación, “por el cual la microbiota intestinal modularía el sistema inmune hacia un fenotipo más proinflamatorio o antinflamatorio, lo que podría influir a su vez en la actuación de las células CAR-T”. Otro dato interesante que se desprende del trabajo es que los pacientes respondedores están enriquecidos en la familia de Butyricicoccus que producen butirato, a su vez parte de uno los principales ácidos de cadena corta. Un estudio reciente en Nature Communications, destacado por García Vicente, ha demostrado que “el pretratamiento in vitro de linfocitos citotóxicos con metabolitos bacterianos (ácidos grasos de cadena corta) incrementa la actividad celular antitumoral en el contexto de la inmunoterapia celular adoptiva”.
En definitiva, las conclusiones del estudio preliminar comunicado en el congreso de la SEHH es que los pacientes con linfoma no Hodgkin tratados con CAR-T antiCD19 que generan respuesta o refractariedad presentan un microbioma significativamente distinto.
“Como futuras ideas de trabajo, queremos profundizar en si la interacción entre la microbiota intestinal y el sistema inmune podría modular la eficacia de la célula CAR-T. También proponemos que el uso de ácidos grasos de cadena corta, como butirato, o de probióticos productores de estos, podría utilizarse como adyuvante en la terapia con linfocitos CAR-T anti-CD19”.
No cabe duda de la eficacia de esta terapia, pero asusta que son células activas que pueden proliferar de forma desordenada y conducir a resultados indeseados.
Por lo pronto es una manifestación del ingenio de los investigadores, en enseñar a los linfocitos a ser agresivos con las células desordenadas
Autores del trabajo
Reyes Martín Rojas, médico residente del Hospital General Universitario Gregorio Marañón
Hospital Universitario de Salamanca con el tratamiento de los dos CAR-T industriales disponibles para pacientes con linfoma B difuso de célula grande (LBDCG)


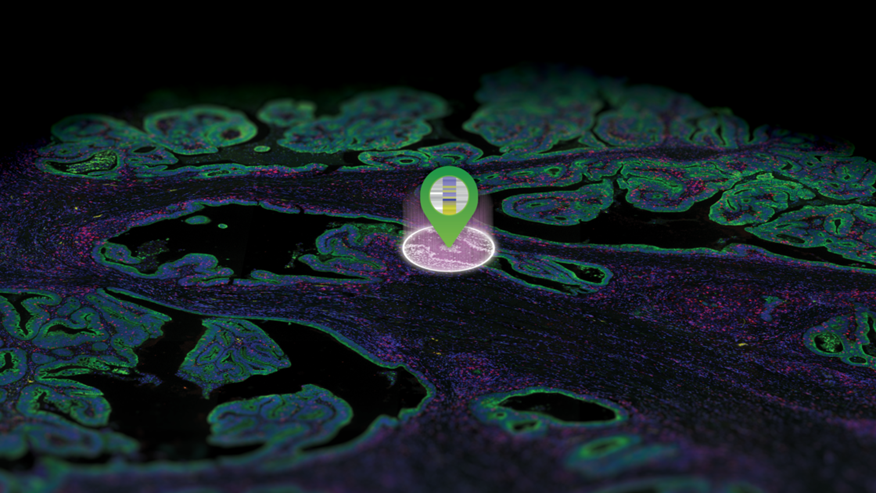


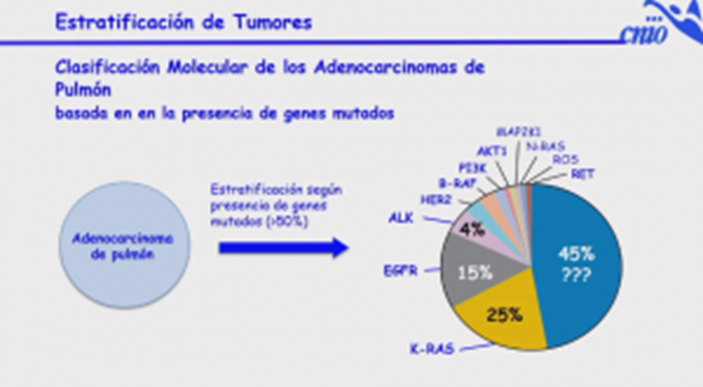
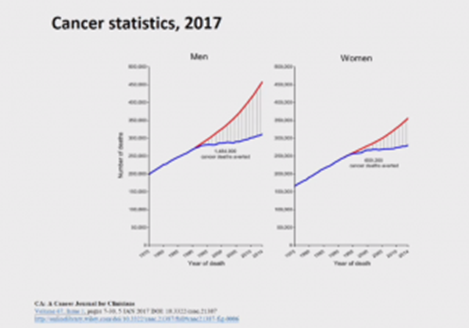

 Anticuerpos biespecíficos
Anticuerpos biespecíficos DescripciónReconoce un antígenoReconoce dos antígenosObjetivo (antígeno)Marcadores de activaciónMarcadores inhibidores de las células inmunesLigandos inhibidores en células tumoralesAntígenos asociados a tumores (TAA)Receptor activador en células inmunes y TAADos puestos de control inmunesFunciónAgotamiento de células de leucemia y linfoma (ex Rituximab)Iniciar citotoxicidad mediada por células dependiente de anticuerpos (ADCC)Bloqueo de puntos de control inmunológicoRedirección citotóxica: acerque las células inmunitarias y las células diana para facilitar la opsonización o la muerte celular.Co-bloqueo de puntos de control inmunológico: bloquea simultáneamente dos objetivos de puntos de control inmunitariosNota: Puede encontrar más información sobre los ADC en el
DescripciónReconoce un antígenoReconoce dos antígenosObjetivo (antígeno)Marcadores de activaciónMarcadores inhibidores de las células inmunesLigandos inhibidores en células tumoralesAntígenos asociados a tumores (TAA)Receptor activador en células inmunes y TAADos puestos de control inmunesFunciónAgotamiento de células de leucemia y linfoma (ex Rituximab)Iniciar citotoxicidad mediada por células dependiente de anticuerpos (ADCC)Bloqueo de puntos de control inmunológicoRedirección citotóxica: acerque las células inmunitarias y las células diana para facilitar la opsonización o la muerte celular.Co-bloqueo de puntos de control inmunológico: bloquea simultáneamente dos objetivos de puntos de control inmunitariosNota: Puede encontrar más información sobre los ADC en el 
 Datos de ELISA funcional que muestran un bloqueo exitoso de la interacción receptor-ligando con el anticuerpo bloqueador del receptor. La línea naranja muestra que el ligando recombinante se une al receptor de manera dependiente de la dosis, en ausencia del anticuerpo. (Izquierda) A 0.09-0.72 µg / mL,
Datos de ELISA funcional que muestran un bloqueo exitoso de la interacción receptor-ligando con el anticuerpo bloqueador del receptor. La línea naranja muestra que el ligando recombinante se une al receptor de manera dependiente de la dosis, en ausencia del anticuerpo. (Izquierda) A 0.09-0.72 µg / mL,  PD-L1 es un objetivo clínico para el bloqueo de puntos de control inmunológico. Anticuerpo anti-PD-L1 altamente validado con reactividad cruzada en tejidos humanos, de ratón y de rata. ICC / IF de la línea celular U-251 de glioblastoma maligno. Las células se fijaron en paraformaldehído al 4% durante 10 minutos y se permeabilizaron en Triton X-100 al 0,05% en PBS durante 5 minutos. Las células se incubaron con
PD-L1 es un objetivo clínico para el bloqueo de puntos de control inmunológico. Anticuerpo anti-PD-L1 altamente validado con reactividad cruzada en tejidos humanos, de ratón y de rata. ICC / IF de la línea celular U-251 de glioblastoma maligno. Las células se fijaron en paraformaldehído al 4% durante 10 minutos y se permeabilizaron en Triton X-100 al 0,05% en PBS durante 5 minutos. Las células se incubaron con  Bloqueo / neutralización de HHLA-2 en un ensayo de citometría de flujo funcional. Brevemente, la línea celular de riñón embrionario humano HEK293 se transfectó con B7-H7 / HHLA-2
Bloqueo / neutralización de HHLA-2 en un ensayo de citometría de flujo funcional. Brevemente, la línea celular de riñón embrionario humano HEK293 se transfectó con B7-H7 / HHLA-2 
 La expresión de HLA-G contribuye a la función inmunomoduladora de los queratinocitos humanos. Expresión de superficie de HLA-G determinada por citometría de flujo de queratinocitos humanos teñidos con
La expresión de HLA-G contribuye a la función inmunomoduladora de los queratinocitos humanos. Expresión de superficie de HLA-G determinada por citometría de flujo de queratinocitos humanos teñidos con  Receptor inhibidor de LAG-3 expresado en la superficie de células T estimuladas. Las células mononucleares de sangre periférica humana (PBMC) no se trataron (panel inferior) o se trataron con 5 μg / ml de PHA (panel superior). Las PBMC se tiñeron con
Receptor inhibidor de LAG-3 expresado en la superficie de células T estimuladas. Las células mononucleares de sangre periférica humana (PBMC) no se trataron (panel inferior) o se trataron con 5 μg / ml de PHA (panel superior). Las PBMC se tiñeron con  ScFv
ScFv EstructuraCadena pesada completa (Hc) y cadena ligera (Lc) de dos anticuerpos monoclonalesFragmentos de unión a antígeno de longitud completa (F (ab)) de dos anticuerpos monoclonales, ligados químicamenteFragmentos variables de cadena única (scFv) de la cadena pesada y ligera de dos anticuerpos monoclonalesFunciónSe une a dos antígenos y la región constante (Fc) puede activar receptores Fc (FcR) en DC, macrófagos y células NKBifuncional: une dos antígenos sin dominio Fc funcionalBifuncional: une dos antígenos sin dominio Fc funcionalVentajasPuede activar FcR para una funcionalidad adicional:ADCCFagocitosisTalla pequeñaBaja inmunogenicidadAgregar funcionalidad en las regiones del vinculadorTalla pequeñaBaja inmunogenicidadPuede diseñarse fácilmente para ser tri-específicoAgregar funcionalidad en las regiones del vinculadorEl azul y el verde representan dos especificidades antigénicas diferentes. Sólo se muestra un ejemplo de estructuras de fragmentos F (ab) 2 y ScFv.
EstructuraCadena pesada completa (Hc) y cadena ligera (Lc) de dos anticuerpos monoclonalesFragmentos de unión a antígeno de longitud completa (F (ab)) de dos anticuerpos monoclonales, ligados químicamenteFragmentos variables de cadena única (scFv) de la cadena pesada y ligera de dos anticuerpos monoclonalesFunciónSe une a dos antígenos y la región constante (Fc) puede activar receptores Fc (FcR) en DC, macrófagos y células NKBifuncional: une dos antígenos sin dominio Fc funcionalBifuncional: une dos antígenos sin dominio Fc funcionalVentajasPuede activar FcR para una funcionalidad adicional:ADCCFagocitosisTalla pequeñaBaja inmunogenicidadAgregar funcionalidad en las regiones del vinculadorTalla pequeñaBaja inmunogenicidadPuede diseñarse fácilmente para ser tri-específicoAgregar funcionalidad en las regiones del vinculadorEl azul y el verde representan dos especificidades antigénicas diferentes. Sólo se muestra un ejemplo de estructuras de fragmentos F (ab) 2 y ScFv. Los anticuerpos biespecíficos para redirigir las células citotóxicas son de gran interés para la inmunoterapia del cáncer. El objetivo principal de este tipo de inmunoterapia es acercar la célula citotóxica, ya sea célula T o célula NK, a la célula tumoral para facilitar su destrucción. Idealmente, el anticuerpo biespecífico está diseñado para activar la célula citotóxica a través de
Los anticuerpos biespecíficos para redirigir las células citotóxicas son de gran interés para la inmunoterapia del cáncer. El objetivo principal de este tipo de inmunoterapia es acercar la célula citotóxica, ya sea célula T o célula NK, a la célula tumoral para facilitar su destrucción. Idealmente, el anticuerpo biespecífico está diseñado para activar la célula citotóxica a través de  La expresión de VEGFR1 / Flt-1 se limita a las células cancerosas y no se expresa en las células del estroma tumoral. Análisis IHC-Parafina (IHC-P) de una sección de tejido de carcinoma de mama humano embebido en parafina (FFPE) fijada con formalina usando una dilución 1: 500 de
La expresión de VEGFR1 / Flt-1 se limita a las células cancerosas y no se expresa en las células del estroma tumoral. Análisis IHC-Parafina (IHC-P) de una sección de tejido de carcinoma de mama humano embebido en parafina (FFPE) fijada con formalina usando una dilución 1: 500 de  Los anticuerpos Bio-Techne están validados para una variedad de aplicaciones, incluido ICC / IF. Análisis inmunofluorescente confocal de la línea celular de cáncer de ovario SK-OV-3 usando
Los anticuerpos Bio-Techne están validados para una variedad de aplicaciones, incluido ICC / IF. Análisis inmunofluorescente confocal de la línea celular de cáncer de ovario SK-OV-3 usando  CD16 se expresa en la superficie de las células NK humanas. Se tiñeron células mononucleares de sangre periférica humana (PBMC) con
CD16 se expresa en la superficie de las células NK humanas. Se tiñeron células mononucleares de sangre periférica humana (PBMC) con