EN LOS GLIOMAS DONDE ESTA AUMENTADA LA CANTIDAD DE PROTEÍNA TAU, DISMINUYE LA NEOANGIOGENESIS
Que relación puede tener un glioma con la enfermedad de Alzheimer, y como la proteína TAU, reparadora de los tubulos conductores de los cilondroejes es además macrofago
En diferentes estadíos del desarrollo neuronal se observan distintas concentraciones de isoformas de la proteína Tau y se ha demostrado que alteraciones en sus proporciones relativas están relacionadas con algunas enfermedades neurodenegerativas como el Alzheimer, Parkisonismo o la Demencia fronto-temporal.
“Utilizando el modelo de glioblastoma y entendiendo el papel de Tau en esta enfermedad y cómo es capaz de regular los vasos sanguíneos podríamos comprender también cuál es el papel de esta proteína en la disfunción neurovascular de enfermedades como el alzhéimer”,
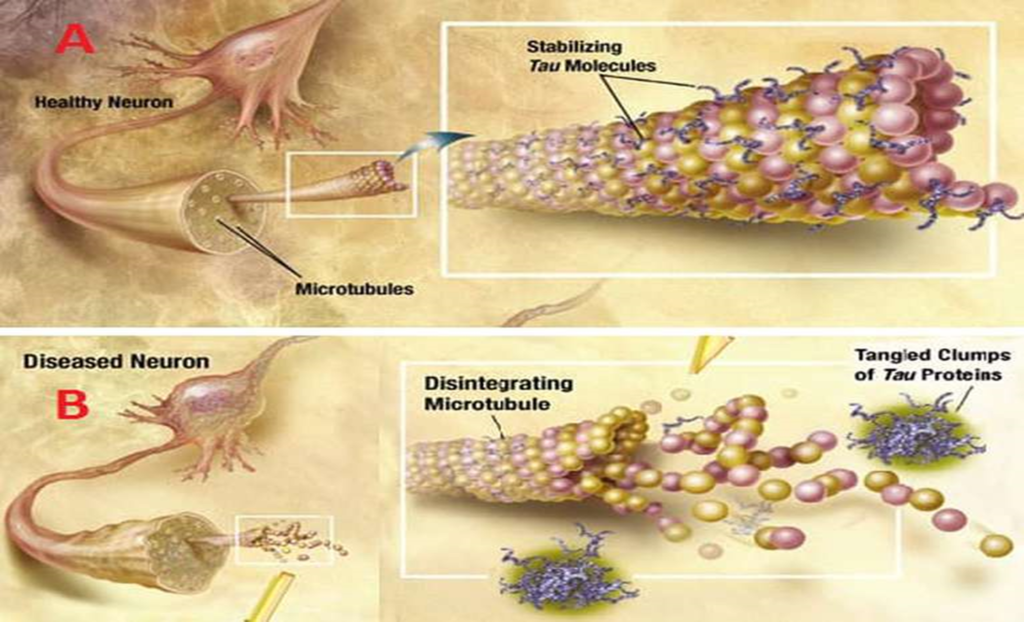
Las neuronas tienen en general una forma muy polarizada con un cuerpo (o soma), dendritas y una larga prolongación llamada axón. En el soma se sintetizan las proteínas, que después son trasladadas al axón para poder ser usadas en la transmisión del impulso nervioso. Para llegar, se desplazan sobre un andamiaje constituído por unas estructuras tubulares que forman una especie de vía, denominadas microtúbulos, por la que se mueve el transporte neuronal. La función de la proteína Tau está relacionada justamente con su unión a los microtúbulos, debido a que el pegado contribuye a la estabilidad y permite el movimiento de cargas sobre ellos, ya sea desde el soma hacia el axón o viceversa.
“Las neuronas producen varias formas de Tau, especialmente dos llamadas 3R y 4R. Durante el desarrollo hay niveles muy altos de 3R y muy bajos de 4R, pero que alcanzan una proporción de 50 y 50 por ciento en el cerebro adulto”, explica Tomás Falzone, investigador adjunto del CONICET en el Instituto de Biología Celular y Neurociencia (IBCN, CONICET) y coordinador del trabajo.
Sin embargo, hay un desbalance en esas proporciones en ciertas enfermedades neurodegenerativas. “Por ejemplo, las demencias frontotemporales llevan a que haya más 4R y en Alzheimer se observa una mayor proporción de 3R o de 4R”, agrega.
Pero, ¿por qué se produce este desbalance en las isoformas? “Tau es una proteína con niveles de expresión muy regulados, y se sabe que las causas más frecuentes de los desbalances de las formas 3R y 4R son mutaciones genéticas que influyen sobre estos mecanismos de regulación y hacen que haya más de una que de otra”, cuenta Elena Avale, investigadora adjunta del Consejo en el Instituto de Investigaciones en Ingeniería Genética y Biología Molecular “Dr. Héctor N. Torres” (INGEBI) y también coordinadora del trabajo.
“Durante la investigación encontramos mecanismos afectados por el desbalance entre las formas de Tau, que pueden explicar por qué frente a ciertas mutaciones genéticas se desencadena el proceso neurodegenerativo. Este conocimiento, producto de la investigación básica, podría contribuir a desarrollar una terapéutica a futuro”, agrega.
El gen que codifica para Tau está en el cromosoma 17 y se descubrió que puede dar origen a diferentes formas de la proteína, entre ellas la 3R y 4R. La R significa los puntos de unión a los microtúbulos: 3R tiene 3, y por lo tanto se une y separa de los microtúbulos más fácilmente, mientras que 4R tiene 4 y la adhesión es más estable. Las formas 3R y 4R se producen por un proceso llamado splicing alternativo, por lo cual una parte del ARN mensajero que codifica para uno de los dominios de unión a microtúbulos, se elimina de manera diferencial según el momento del desarrollo o el estado neuronal.
Los investigadores encontraron que 3R favorece el transporte desde el cuerpo hacia el axón, mientras que 4R lo hace desde la sinapsis hacia el cuerpo.
“Durante el desarrollo prevalece 3R, y es lógico si se analiza que una neurona que está creciendo y busca insertarse en el medio tiene que llevar más cosas que las que trae para poder formar las conexiones neuronales. Sin embargo, en el cerebro adulto, con esas conexiones ya formadas y funcionando es necesario generar más estabilidad de los microtúbulos y empezar a traer moléculas desde el axón al soma. Esto se relaciona con la función de 4R que encontramos, que favorece el transporte desde las sinapsis hacia el cuerpo”, explica Avale.
Durante los estudios trabajaron con neuronas humanas diferenciadas a partir de células madre, a las cuales pudieron modularles los niveles de 3R y 4R mediante herramientas de ingeniería genética, y encontraron que cuando en la célula madura se modificaba esa relación 50-50 entre 3R y 4R aparecen defectos en el transporte de vesículas sobre los microtúbulos. Estos defectos podrían estar directamente relacionados con el inicio de procesos neurodegenerativas en algunos tipos de demencias o parkinsonismo.
“Algunas mutaciones en el ADN de la célula llevan a que se modifiquen las proporciones de las formas de Tau, con lo cual si con este sistema se puede regular la síntesis de la proteína para que se mantenga la proporción 50-50 se puede pensar en una plétora de patologías que se podrían corregir”, dice Falzone -quien además colabora como investigador en el Instituto de Bióloga y Medicina Experimental (IBYME, CONICET) y es docente en la Cátedra de Histología de la Facultad de Medicina (UBA)- y agrega: “Este trabajo aporta claves para entender las funciones de 3R y 4R durante el desarrollo, su balance y su rol en las patologías y, a futuro, poder usar esa información para desarrollar tratamientos”.
Pero Tambien la TAU es un macrófago y en alguna ocasión se comporta de manera plural
Se la considera un macrófago y como tal tiene la misión de englobar partículas y destruirlas. Estas particulas algunos autores amantes de la teoría infecciosa de la enfermedad de Alzheimer, creen que son gérmenes y como en otras enfermedades neurodegenerativas, al depositarse sobre estos gérmenes, también lo hacen sobre estructuras cerebrales y bloquean sus funciones.
De forma que el germen o los gérmenes y la proteína TAU depositadas sobre ellos, lesionarían funciones cerebrales fundamentales e inducirían a la demencia, de la misma forma que la B amiloidotica se precipita extracelularmente y mutila también áreas del cerebro
Un equipo de investigadores han descubierto que TAU, una proteína involucrada en la enfermedad neurodegenerativa, tiene un efecto protector capaz de frenar el desarrollo del cáncer cerebral, o glioma.
La capacidad de los tumores para general vasos sanguíneos es fundamental y también lo es en los GLIOMAS para crecer y hacerlos mas agresivos.
En este trabajo los investigadores han demostrado que la proteína TAU está presente en los gliomas menos agresivos. Cuando la cantidad de esta proteína disminuye, los tumores tienden a desarrollar más vasos sanguíneos y volverse más agresivos.
Jesús Ávila, investigador del Centro de Biología Molecular Severo Ochoa (CBMSO-CSIC) y coautor del estudio afirma que “Esta proteína se expresa en las células de glía, mientras que en el ALZHÉIMER solo la vemos expresada en las neuronas,”,. “En los gliomas la proteína tau tiene un factor protector, a más proteína, menos proliferación tumoral”,.
El equipo ha usado muestras de cáncer cerebral de 180 pacientes de los hospitales 12 de Octubre, Gregorio Marañón y Ramón y Cajal, en Madrid, y la Fe, en Valencia. También ha corroborado el hallazgo con muestras de otros 700 pacientes de una cohorte recopilada por la Universidad de California. En un experimento con células de pacientes con glioma y con ratones que sufren esos tumores, los investigadores han descubierto que un fármaco derivado del taxol ya estudiado para otros usos oncológicos es capaz de imitar el papel protector de la tau, frenar el avance de los gliomas y hacer los tumores más vulnerables a la quimioterapia.
Pero que tienen que ver la supuesta condición de macrófago y su deposito intracelular, con la inhibición en los gliomas de la neoangiogenesis.
El trabajo ha sido dirigido por Ricardo Gargini, y Pilar Sánchez-Gómez, investigadores del Instituto de Salud Carlos III de Madrid.ISCIII
“Los tumores cerebrales agresivos son muy desalentadores”, este estudio abre una nueva vía por la que buscar un nuevo tratamiento, aunque aún harán falta años de investigación.
A largo plazo El taxol es un compuesto poco tóxico y podría tener un impacto sumado a los tratamientos convencionales”, pero antes habría que demostrar que el fármaco funciona en varios ensayos clínicos con pacientes,
Más a corto plazo, el estudio aporta un conocimiento básico importante. Los investigadores han dilucidado que la proteína Tau ejerce su efecto beneficioso porque refuerza los microtúbulos, que son parte del esqueleto de las células. Una de las primeras cosas que hace el cáncer para proliferar es debilitar ese esqueleto, lo que a su vez facilita que una célula pueda empezar a generar hijas por un proceso de mitosis: La expresión de Tau impide que esa maquinaria de proliferación se ponga en marcha.
“Creemos que tau es una llave entre ALZHÉIMER Y CÁNCER”, resume Gargini, biólogo molecular de origen argentino. Uno de los objetivos ahora es entender si esa llave funciona también a la inversa y puede ofrecer alguna esperanza en esta enfermedad neurodegenerativa que sufren unos 50 millones de enfermos en todo el mundo y de la que se espera que su incidencia se triplique para 2050, pues está asociada al envejecimiento de la población.
Aunque el alzhéimer se descubrió hace más de un siglo, se ignoran sus causas y hoy por hoy no existe ningún tratamiento efectivo. Grandes compañías farmacéuticas han invertido sumas millonarias en intentar desarrollar nuevos fármacos. Todas han fracasado, sobre todo porque su principal táctica, acabar con las proteínas amiloides que se acumulan sin freno en el cerebro de los pacientes, no ha resultado efectiva.
Tras este fracaso ha llegado el momento de la proteína Tau, que tiene una variante normal que no causa ningún problema. Pero en el cerebro de pacientes con alzhéimer la tau está mal plegada, con lo que no puede ser eliminada y pasa a acumularse en ovillos hasta que acaba matando a las neuronas. «Uno de los indicadores precoces del alzhéimer es que los vasos sanguíneos que protegen al cerebro se vuelven permeables. Ahora vemos que tau tiene una función que limita el desarrollo de vasos sanguíneos aberrantes en cáncer. Esto abre nuevas preguntas sobre su papel en el alzhéimer. Nuestra opinión es que la proteína tau funciona tal vez como un guardián del cerebro en su forma normal»,.
Bibliografia
Ricardo Gargini, y Pilar Sánchez-Gómez, investigadores del Instituto de Salud Carlos III de Madrid.ISCIII
The Journal of Neuroscience , liderado por investigadores de Argentina, en colaboración con científicos de la República Checa y del Reino Unido, muestra que sutiles alteraciones en los niveles relativos de Tau afectan de manera significativa el transporte de proteínas relacionadas con la enfermedad de Alzheimer.