¿Pueden servir las vacunas de ARNm también para curar el cáncer?
Tras el éxito de la vacuna de la covid-19, es lógico preguntarse si es posible esperar un triunfo semejante con el cáncer. Ya era un objetivo a perseguir antes de la pandemia.

Cuando el SARS-CoV-2 irrumpió en nuestras vidas en 2020, las vacunas basadas en ARN mensajero (ARNm) ya protagonizaban diversos ensayos y publicaciones, varios de ellos orientados a emplear esa tecnología en la lucha contra el cáncer. Los resultados preliminares mostraban que había espacio para la esperanza, pero aún había muchas cosas por mejorar y dudas asociadas al uso de una tecnología completamente nueva.
Entonces llegó la pandemia y todo pasó aparentemente a un segundo plano. El cáncer seguía siendo una de las grandes amenazas, pero la saturación del sistema sanitario y lo excepcional de la situación provocaron retrasos en los diagnósticos y en los tratamientos.
Sin embargo, la estrategia contra la covid-19 le debe mucho a la investigación contra el cáncer, y es que sin los años previos dedicados a la investigación de las vacunas de ARNm no habría sido posible desarrollar una versión contra la infección por SARS-CoV-2 en tan poco tiempo (se tarda entre 10 y 15 años en desarrollar una vacuna, pero Pfizer y Moderna consiguieron probar la eficacia y seguridad de su propuesta para la covid-19 en menos de un año). Al mismo tiempo, la aceleración en el desarrollo y su aplicación masiva son una fuente fundamental de información para retomar, con muchos más datos y en un punto más avanzado, el propósito original.
¿Por qué esta tecnología puede marcar una diferencia? En el caso de las enfermedades contagiosas una de sus principales ventajas es que no se basan en inocular un virus (inactivado o parte de él), lo que conlleva un cultivo previo del mismo en laboratorio y un proceso de purificación. Las vacunas de ARNm se aprovechan de nuestra maquinaria celular para que sean nuestras propias células las que produzca proteínas idénticas a las que portan los virus en la superficie, de forma que el sistema inmune se entrene y aprenda a reconocerlas para que esté preparado en caso de que se produzca una infección.
Para ello es necesario secuenciar el ARN viral y localizar la parte en la que se explica cómo producir esa proteína en cuestión, copiarla e inocularla en el cuerpo para que las células hagan el trabajo sin que suponga un riesgo para el individuo. El ARN se degrada muy rápidamente y en ningún caso afecta a nuestro ADN, que permanece protegido en el núcleo de las células. Y puesto que tampoco se inocula un virus, son una opción más segura.
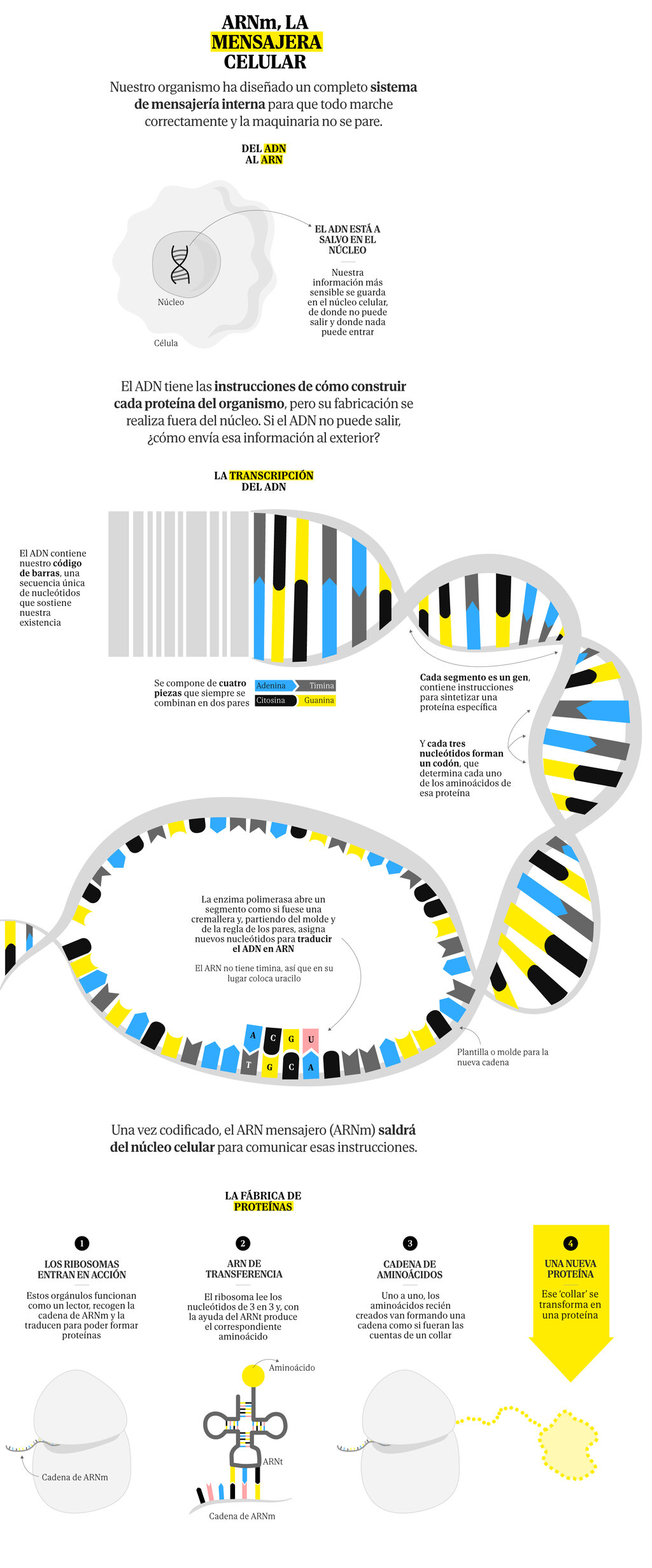
Pero si hablamos del cáncer el enfoque ha de ser distinto. En primer lugar, y al contrario de lo que ocurre con los virus, se trata de vacunas terapéuticas, no preventivas. Si bien las vacunas de la hepatitis B y el virus del papiloma humano previenen una infección que podría derivar en un tumor, no son un ejemplo del abordaje necesario en otros casos.
Por otra parte, el enemigo a batir es más escurridizo y estas vacunas necesitan un objetivo claro y definido para ser eficaces. «Estas vacunas se diseñan para que nuestro sistema inmune reconozca algunas proteínas como una amenaza y las ataque», explica el doctor Rodrigo Sánchez-Bayona, secretario científico de la Sociedad Española de Oncología Médica (SEOM) y oncólogo del Hospital Universitario 12 de Octubre en Madrid, «pero en el caso de las células tumorales, que son células de nuestro propio cuerpo que mutan, esas células al final comparten proteínas muy similares a las de las células sanas vecinas».
La similitud entre las células enfermas y las sanas no solo resta eficacia, también supone un riesgo. «Podría pasar que nuestro sistema inmune atacase a las células sanas y producir problemas autoinmunes», afirma el doctor Sánchez-Bayona, «Para ello se necesitan encontrar proteínas ‘diana’ que tengan las células tumorales y no se expresen o que lo hagan en muy baja proporción en las células sanas».
La clave para superar esta dificultad también es la que hace que estas vacunas sean tan prometedoras. Y es que la identificación de esas ‘dianas’ pasa por un estudio personalizado del paciente, de forma que las vacunas de ARNm se perfilan como un estandarte de la medicina personalizada.
Hoy en día es posible secuenciar las células sanas y las tumorales para poder compararlas entre sí e identificar con precisión las diferencias. Hablamos de cientos, incluso miles de mutaciones, que gracias a la informática podremos reducir a un número más manejable de posibilidades.
Se trata de identificar los llamados neoantígenos, aquellos específicos para el tumor de un paciente (puede tener marcadores únicos), comunes en un determinado tipo de cáncer o compartidos entre varios tipos. Para ello, bastaría con analizar los tejidos del paciente, además de contar con una base de datos que permita comparar perfiles. Las vacunas de ARNm pueden incorporar hasta 34 neoantígenos, de forma que podrían apuntar a varias ‘dianas’ a la vez.
En la era de la medicina personalizada las vacunas de ARNm son una herramienta a tener en cuenta, y además con un perfil de efectos secundarios mejor tolerado que el de la quimioterapia convencional. “Aunque la inmunoterapia puede producir reacciones como fiebre, dolor muscular o dolor en las articulaciones tras su administración”, explica el doctor Sánchez-Bayona, «suelen ser efectos leves y transitorios en su gran mayoría». Lo vimos con las vacunas del covid-19, es un cuadro que ya conocemos.
Pero las ventajas no quedan ahí, el oncólogo recuerda que las vacunas pueden llegar a generar memoria inmunológica, así que de igual modo que podemos presentar batalla a un virus como el SARS-CoV-2 tras habernos vacunados, nuestro sistema inmune también podría ser capaz de reconocer la amenaza de cáncer en un futuro si existen recaídas con células que presenten la misma proteína, atacándolas antes de que ésta sea clínicamente evidente.

En la actualidad se está probando con éxito la posibilidad de combinar la vacuna de ARNm con otras inmunoterapias. Moderna publicó hace algunas semanas los resultados preliminares de un ensayo clínico en pacientes con melanoma en estadio III/IV que recibieron tanto la vacuna como inmunoterapia con pembrolizumab. Al comparar los resultados de esta combinación con los de pacientes que solo habían recibido el pembrolizumab, se constató una reducción del 44% en el primer grupo en el riesgo de recidiva o muerte por enfermedad. Son datos muy esperanzadores pero todavía hay que leerlos con cautela. «Aunque los resultados son prometedores», advierte el oncólogo, «es muy pronto todavía para poder hablar de curación del melanoma».
Lo que es evidente es que las vacunas permiten un mayor grado de personalización en el tratamiento que las inmunoterapias basadas en anticuerpos, tienen una «alta especificidad», en palabras de Sánchez-Bayona. Pero al mismo tiempo estas terapias resultan un complemento muy interesante, ya que «estimulan al sistema inmune para que reconozca las células tumorales como una amenaza», potenciando así la eficacia de la vacuna.
Aún queda mucho trabajo por hacer y problemas aún pendientes de resolver para poder incluir las vacunas de ARNm entre los tratamientos habituales contra el cáncer, como «la seguridad a largo plazo, conocer el número de dosis necesarias o el momento óptimo de administración», recuerda Sánchez-Bayona.
Tampoco se conseguirá algo de forma inmediata, los tiempos no serán tan rápidos como con la covid. Quedan años de trabajo, investigación y ensayos hasta que estos indicios se traduzcan en un éxito tangible, en una cura real. Y eso si no hay reveses o calles sin salida. Es una carrera de fondo, pero ‘gracias’ al impulso provocado por la pandemia hoy podemos vislumbrar ese futuro un poco más cerca.
 El perfil farmacocinético de ▼ Refixia® favorece la individualización del tratamiento de la hemofilia B proporcionando protección frente al sangrado con un reducido número de infusiones intravenosas¹
El perfil farmacocinético de ▼ Refixia® favorece la individualización del tratamiento de la hemofilia B proporcionando protección frente al sangrado con un reducido número de infusiones intravenosas¹
 Kyowa Kirin pone en marcha un proyecto para mejorar el abordaje de los pacientes con Micosis Fungoide y Síndrome de Sézary
Kyowa Kirin pone en marcha un proyecto para mejorar el abordaje de los pacientes con Micosis Fungoide y Síndrome de Sézary
 La contribución desde la farmacia en la lucha contra el cambio climático
La contribución desde la farmacia en la lucha contra el cambio climático
 La epilepsia farmacorresistente: cuando los tratamientos convencionales no son suficientes
La epilepsia farmacorresistente: cuando los tratamientos convencionales no son suficientes
Oncología – Terapias avanzadas
El Sant Pau lleva a ensayo de fase I una CAR-T propia contra linfomas B
La nueva ‘CART-19’ se probará en 10 pacientes con la colaboración del Hospital Virgen del Rocío de Sevilla, también especializado en estas terapias.

El Instituto de Investigación del Hospital de Sant Pau (IIB-Sant Pau) de Barcelona ha anunciado hoy que inicia el ensayo clínico de fase I de una CAR-T de desarrollo propio (académica, que no tiene implicación de la industria farmacéutica) para pacientes con algunos tipos de linfoma (linfoma B difuso de célula grande, linfoma folicular, linfoma de células del manto) no respondedores a terapias aprobadas para ellos. El linfoma es el cáncer de la sangre más frecuente en España (informe anual de la Sociedad Española de Oncología Médica-SEOM) y la innovadora propuesta terapéutica de Sant Pau sería para más del 80% de todos los linfomas.
En el estudio clínico inicial, sobre una muestra de diez pacientes, colabora el Servicio de Hematología del Hospital Virgen del Rocío de Sevilla, en el marco de la Red de Terapias Avanzadas (una de las Redes de Investigación Cooperativa Orientadas a Resultados en Salud-Ricors impulsadas por el Instituto de Salud Carlos III).
El Sant Pau, con ese anuncio, demuestra su apuesta decidida por el desarrollo y producción propios de este tipo de terapias avanzadas. Forma parte del proyecto europeo T2Evolve (alianza de líderes académicos y de la industria en inmunoterapia contra el cáncer bajo la Iniciativa de Medicamentos Innovadores-IMI de la Unión Europea) y, en colaboración con el Banco de Sangre y Tejidos de Cataluña, obtuvo en 2020 el certificado de cumplimiento de Normas de Correcta Fabricación para la producción de un medicamento de terapia avanzada, emitida por la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), que permite la producción y control de calidad de medicamentos celulares tipo CAR-T en una sala blanca (equipamiento especialmente diseñado para el desarrollo de medicamentos de terapia avanzada). Esa certificación la renovó en 2022 (entonces duplicó su capacidad de producción).
Esta nueva CART-19, que es como se llama, está enriquecida con linfocitos T de memoria. El director del Grupo de Inmunoterapia Celular y Terapia Génica (GITG) del IIB-Sant Pau y jefe de la Unidad de Hematología Clínica del Servicio de Hematología del Hospital de Sant Pau, Javier Briones, ha explicado a este diario que la diferencia de esta CAR-19 respecto a otras es que en su producción, de acuerdo con un procedimiento innovador, se seleccionan de entrada los linfocitos T de memoria.
Ha precisado asimismo que en el ensayo clínico, que ya ha empezado, no se selecciona a los pacientes por el número de linfocitos T que tengan en sangre –“suelen tener pocos, pero sería raro que tuviesen cero”- sino por no haber respondido a tratamientos previos. Y la terapia se les administra en su sola dosis, tras la cual, si es preciso (por posible aparición de la temida complicación síndrome de liberación de citocinas), se trata con un anticuerpo que bloquea las citocinas.
La CART-30 está ya en ensayo de fase II
El IIB-Sant Pau está trabajando en paralelo en el desarrollo clínico de su primera CAR-T, la CART-30 (la CART-19 es la segunda), igualmente con linfocitos T de memoria, para linfoma de Hodgkin y linfoma T.
En abril del año pasado dio a conocer los resultados positivos del ensayo de fase I en el que evaluó la seguridad, dosis óptima y eficacia preliminar de esa terapia avanzada dirigida al antígeno tumoral CD30. Demostró, en concreto, que las células T de memoria CAR30 (HSP-CAR30) poseen “un excelente perfil de seguridad; es decir, que tienen muy poca toxicidad, además de lograr una alta eficacia, ya que un 50% de los pacientes tuvieron una respuesta completa al tratamiento con desaparición del linfoma”, según el instituto de investigación barcelonés. Participaron 10 pacientes refractarios a todos los tratamientos convencionales aprobados, procedentes de diversas comunidades autónomas y de otros países europeos, y colaboraron la Fundación Josep Carreras contra la Leucemia y el Instituto de Investigación contra la Leucemia Josep Carreras, aportando dos millones de euros.
Briones ha indicado al respecto que para este ensayo de fase II siguen reclutando pacientes en toda España y Europa en fases avanzadas de sus enfermedades (sometidos previamente a entre 5 y 7 tratamientos sin éxito). “A finales de este año o principios del que viene podremos dar a conocer resultados. Estamos muy contentos”, ha declarado.
Proceso de esta terapia personalizada
Volviendo a la terapia avanzada CART-19, para producirla se extraen de la sangre del propio paciente (por aféresis) los denominados linfocitos T de memoria. Estas células se multiplican en la sala blanca durante 8-10 días y se modifican genéticamente (integrándoles el CAR -receptor quimérico de antígenos- mediante un virus) para que, dentro del organismo, cada vez que detecten una célula tumoral, la eliminen. Esas células modificadas vuelven a multiplicarse; se ponen en una bolsa en la cantidad necesaria y, previo control de calidad, se infunden directamente en el torrente sanguíneo del paciente, para que lleguen a las células cancerosas y actúen en su contra.
Resumiendo mucho: se trata de modificar genéticamente los linfocitos T del propio paciente para que éstos ataquen a las células cancerosas. Antes del tratamiento, el paciente se somete a quimioterapia, con el fin de eliminar todos sus linfocitos T, que ya fracasaron contra el cáncer, e impedir que compitan en el organismo con los nuevos (los modificados genéticamente) por los mismos nutrientes.
Briones ha puesto de relieve la enorme complejidad que supone el desarrollo científico y clínico y la producción de estas terapias, comenzando por el cumplimiento de los exigentes requisitos necesarios para lograr la autorización de la Aemps.”Es como tener una empresa farmacéutica dentro de la institución”, dice.
Complejo y muy caro
En todo el proceso hay “muchos baches y piedras”, pero entre ellos destaca la financiación: “Es carísimo. En España hay pocas ayudas para la fase clínica. El Carlos III tienen convocatorias, pero hacen falta más ayudas que en nuestro caso provienen de la Fundación “La Caixa” y la Fundación Carreras. Obtener dinero público y privado es imprescindible para estos proyectos. Hay que buscarlo y convencer con unas partes básica y clínica potentes, apoyo institucional, recursos como la sala blanca,…”. El proyecto de la CART-19 ha recibido, en concreto, una ayuda de 2 millones de euros de la Fundación “la Caixa” y colaboran también en él el ISCIII, el Instituto de Investigación contra la Leucemia Josep Carreras y el Banco de Sangre y Tejidos de Cataluña.
Acerca de por qué en el ensayo de la CART-19 participa el Hospital Virgen del Rocío de Sevilla, con experiencia también en CAR-T, y no uno más próximo al Sant Pau, Briones ha declarado que la elección responde a la necesidad de “no concentrar en una misma zona geográfica, sino dar accesibilidad también a pacientes de otras comunidades autónomas”.
Briones ha concluido avanzando que el Sant Pau trabajan en fases preclínicas en otras CAR-T que espera que, como las dos antes citadas, también lleguen a la investigación clínica.
Fuentes autorizadas de la Fundación «la Caixa», por su parte, han informado también a este diario de que están apoyando «de forma estratégica» a dos CAR-T académicos: «Por un lado, damos apoyo a la Unidad para la Investigación en Inmunoterapia del Cáncer del Hospital Clínic. En la Unidad ya se han realizado con éxito 2 ensayos clínicos de nuevas terapias CAR-T para leucemia linfoblástica aguda y mieloma múltiple, con los que se han tratado ya más de 100 pacientes y en más del 60% de los cuáles se observa remisión completa del cáncer. Importe de nuestra ayuda: 4.5 millones de euros. Por otro lado, damos apoyo a un ensayo clínico de un CAR-T (CAR-T 19 SP) para pacientes con algunos tipos de linfoma (linfoma B difuso de célula grande, linfoma folicular, linfoma de células del manto) del Sant Pau. Dos millones en este caso».
Añaden que, además, a través de la convocatoria CaixaResearch de investigación en Salud y de la convocatoria CaixaResearch de Innovación «damos apoyo a algunas etapas de investigación de otros proyectos de CAR-T. Por ejemplo, a uno que lidera la Fundación Instituto de Investigación Contra la Leucèmia Josep Carreras sobre sarcoma de Ewing y a otro del Insituto de Medicina Molecular (iMM) de Lisboa. Estos son apoyos por tres años de duración de etapas bastante anteriores a los ensayos».
Desarrollo y uso de CAR-T en Cataluña
En la carrera por lograr CAR-T académicas, además del Hospital de Sant Pau y su centro de investigación, también destaca en Cataluña el Hospital Clínic/Idibaps de Barcelona, con las ARI 0001 (consiguió la designación PRIME por parte de la Agencia Europea del Medicamento) y ARI 0002. El Hospital Materno Infantil de Sant Joan de Déu y el Hospital Vall d’Hebron acumulan experiencia en el uso de estas terapias.
Y el Gobierno catalán ha anunciado la creación del Centro de Terapias Avanzadas de Cataluña (CTAC) que, según su información, “se convertirá en la infraestructura clave para garantizar la conexión entre la generación de estas tecnologías en el marco de los sistemas públicos de salud y de investigación e innovación, y el tejido industrial, incrementando el impacto social y económico de un sector en alza y de alto valor añadido”.
 El perfil farmacocinético de ▼ Refixia® favorece la individualización del tratamiento de la hemofilia B proporcionando protección frente al sangrado con un reducido número de infusiones intravenosas¹
El perfil farmacocinético de ▼ Refixia® favorece la individualización del tratamiento de la hemofilia B proporcionando protección frente al sangrado con un reducido número de infusiones intravenosas¹
 Kyowa Kirin pone en marcha un proyecto para mejorar el abordaje de los pacientes con Micosis Fungoide y Síndrome de Sézary
Kyowa Kirin pone en marcha un proyecto para mejorar el abordaje de los pacientes con Micosis Fungoide y Síndrome de Sézary
 La contribución desde la farmacia en la lucha contra el cambio climático
La contribución desde la farmacia en la lucha contra el cambio climático
 La epilepsia farmacorresistente: cuando los tratamientos convencionales no son suficientes
La epilepsia farmacorresistente: cuando los tratamientos convencionales no son suficientes
Medicina Preventiva y Salud Pública – La vacuna de GSK, la primera en obtener el visto bueno de la EMA
Jaime Jesús Pérez (AEV): «No creo que la vacuna del VRS esté para este otoño»
El presidente de la Asociación Española de Vacunología resalta que la eficacia de la primera vacuna contra el virus respiratorio sincitial es «muy alta».

El desarrollo de vacunas contra el virus respiratorio sincitial (VRS) comenzó en los años 60, pero la asociación de las primeras candidatas dirigidas a bebés con efectos secundarios graves, e incluso letales, paralizó la investigación durante décadas.
Ha pasado más de medio siglo desde entonces y, por fin, la Agencia Europea de Medicamentos (EMA) ha dado luz verde a la primera vacuna contra el VRS en población a partir de 60 años. Los resultados del ensayo pivotal de Arexvy, de GSK, muestran una eficacia durante al menos seis meses del 83% frente a enfermedad del tracto respiratorio inferior causada por el virus. La eficacia supera el 90% en pacientes con comorbilidades, así como frente a enfermedad grave.
Lo cierto es que es un momento dorado el que atraviesa la investigación contra este patógeno, que se ceba con la población en los extremos de la vida (bebés y personas mayores) y los pacientes con comorbilidades.
El presidente de la Asociación Española de Vacunología (AEV), Jaime Jesús Pérez, se muestra optimista con respecto a la aceptación que tendrá esta vacuna entre la población, aunque ve difícil que llegue a calendarios este otoño. Pérez, que es además miembro de la Ponencia de Vacunas del Ministerio de Sanidad y subdirector de Salud Pública de la Región de Murcia, anuncia más avances frente al VRS.
PREGUNTA. ¿Cómo valora la posibilidad de tener esta primera vacuna que proteja frente al virus respiratorio sincitial en mayores?
RESPUESTA. De forma muy positiva. Hemos pasado de no tener nada a, en muy pocos meses, tener vacuna para adultos mayores, vacuna para embarazadas, un anticuerpo monoclonal para uso en niños… La perspectiva ha cambiado radicalmente.
P. ¿Qué se puede decir de lo que se conoce sobre la eficacia de la vacuna?
R. Empezamos a tener vacunas para adultos que se comportan casi como las vacunas infantiles, con una eficacia muy alta. En adultos hemos tenido relativamente pocas vacunas con estos niveles de eficacia. Es más positivo de lo habitual, y eso es algo muy bueno, porque en la medida en que consigamos buenas vacunas que protejan de una forma muy eficaz frente a enfermedades, como en este caso el virus respiratorio sincitial en el adulto, seguro que la adopción de la vacunación se hará con más convencimiento y de forma más fácil.
P. ¿Cómo se explica que la eficacia sea más alta en pacientes con comorbilidades?
R. Hay que ver todos los datos en profundidad, puede ser una cuestión de que el tamaño muestral sea más pequeño. Pero los pacientes que no tienen una inmunodepresión pero tienen enfermedades crónicas, como los cardiológicos o con un cuadro respiratorio como EPOC, no tienen por qué presentar una eficacia más baja con las vacunas, pero tampoco más alta. Habrá que ver la significación estadística de la diferencia y cómo se aplica en la vida real. Pero en cualquier caso, es una cuestión muy positiva, porque se comprueba que la vacuna funciona tanto en adultos sanos como en adultos con patologías.
P. ¿Será una vacuna de una sola dosis?
R. De momento sí. Como el VRS es un virus estacional, habrá que comprobar si hace falta administrar dosis de recuerdo o no. Tal vez alguna de las vacunas que haya requerirá una dosis anual, pero es algo que todavía está en ensayos clínicos. Además, se están desarrollando vacunas combinadas frente a gripe, covid-19 y virus respiratorio sincitial, con varias posibles combinaciones, lo que facilitaría mucho la vacunación, si es que hubiera que hacerla anual.
P. ¿Qué se puede decir de la tecnología de esta vacuna recombinante y adyuvada?
R. Es una vacuna muy parecida en su tecnología a la vacuna del herpes zoster, que ya estamos administrando, o la del papiloma. Tiene un adyuvante que es potente, pero no es nada nuevo. Ya venimos utilizando esta tecnología desde hace años.
«Habrá que plantearse la posibilidad de que pueda entrar en calendarios a partir del año que viene»
P. ¿Cuándo se espera que comience a introducirse en los calendarios vacunales españoles?
R. Este año es un poco pronto, porque hay que hacer una evaluación, también de estudios de coste-efectividad y carga de enfermedad, y hace falta tener un poco más de datos. Además ya estamos en mayo. No creo que vaya a ir para este otoño, pero habría que plantearse la posibilidad de que empezara a entrar en calendarios a partir del año que viene.
P. ¿Habría algún planteamiento de cómo se podría hacer? ¿Tendría sentido administrar la vacuna del VRS con la de la gripe?
R. No hay ningún problema en coadministrar las vacunas inactivadas, pero lo mejor es tener más estudios. Pero sí que es cierto que habrá que valorar el número de pinchazos que vamos a administrar. Habría que conocer la duración de la protección, por si no necesariamente se tiene que administrar en otoño.
Esos son cuestiones que se están planteando ahora, porque estamos justo en un momento de aprobación, pero es que además por delante viene el proceso de precio y reembolso y vendrán otras vacunas. La de Pfizer va a está muy cercana en tiempo. Esta vacuna tiene un desarrollo en adultos mayores pero también en embarazadas. Es también es una vacuna proteica, no tiene mucha diferencia a no ser el tipo de adyuvante.
P. ¿Entonces no se sabe qué vacuna podría empezar a administrarse en España?
R. Por ejemplo, con vacunas de la gripe depende de la eficacia, si son similares o no muy diferentes es una cuestión de los concursos.
P. ¿Cómo son los datos de Pfizer?
R. Ha publicado datos con parecida eficacia y la noticia de su aprobación se puede producir en cualquier momento. De hecho, la FDA evaluó la de Pfizer y la de GSK con un día de diferencia.
P. ¿Habría grupos de población especialmente prioritarios para protegerse frente al VRS?
R. No es fácil responder, ahora mismo hay que hacer esta evaluación. Es un proceso muy largo, son meses, y se hace a través de grupos de trabajo. No sabemos todavía el precio, habrá que evaluar la carga de enfermedad, si todos los mayores de 60 se van a beneficiar por igual, que muy probablemente no. Lo lógico es que se beneficiarán más los mayores de 80 o los mayores de 70.
P. GSK planea publicar datos en población a partir de 50 años. ¿Hay alguna otra cuestión que sea especialmente acuciante responder antes de que llegue a España la vacuna?
R. El tiempo de protección, y luego, evidentemente, cuando se habla de mayores de 50 o de 60, habrá grupos de riesgo que se beneficien especialmente de la vacunación frente al VRS, no solamente por edad, sino también con otras patologías.
P. ¿Cree que la vacunación tendrá una buena acogida por parte de la población? Porque siempre se dice que el VRS es el gran desconocido.
R. La población adulta no es consciente de la carga de enfermedad que supone el virus respiratorio sincitial. Sí lo es de la bronquiolitis en los niños, pero no del VRS en adultos. Habrá que hacer una labor pedagógica, primero y fundamental, con los profesionales sanitarios, y luego también en población general. Pero una vez hecha esta campaña con los profesionales sanitarios será más fácil.
«La población adulta no es consciente de la carga de enfermedad que supone el virus respiratorio sincitial