Papel del sistema nervioso simpático en el síncope vasovagal y justificación del uso de betabloqueadores e inhibidores del transportador de noradrenalina
Manlio F. Márquez , Jorge Rafael Gómez-Flores , Jesús A. González-Hermosillo, Teresita de Jesús Ruíz-Siller, Manuel Cárdenas
Introducción
. El síncope vasovagal es un tipo de intolerancia ortostática. Este término se usa para referirse al síncope que resulta de mecanismos reflejos asociados con vasodilatación inapropiada y grados variables de bradicardia. También es conocido como síncope reflejo, síncope neurocardiogénico o síncope neuralmente mediado.
Síncope vasovagal
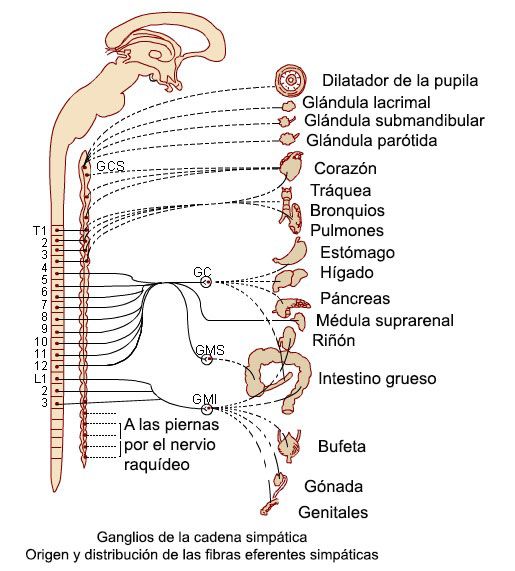
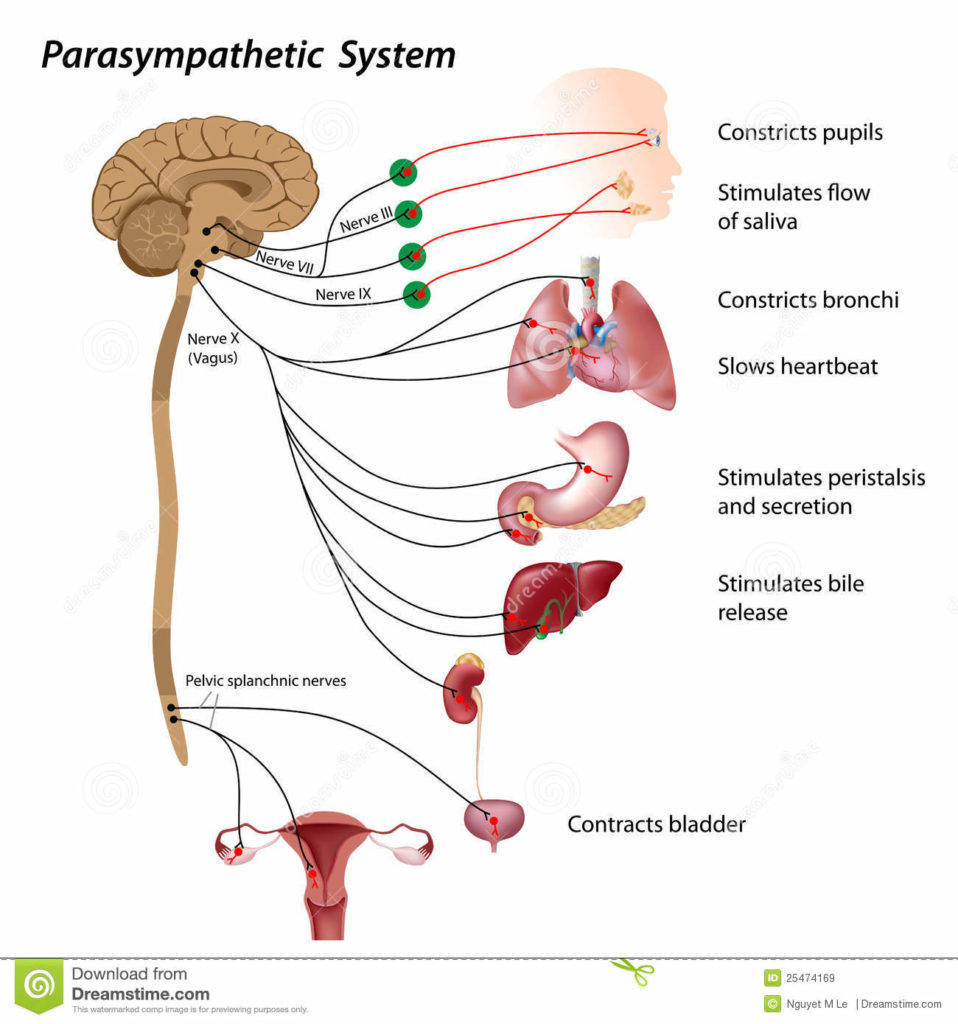
El síncope se define como una pérdida de consciencia y del tono postural repentina y temporal, como resultado de una disminución transitoria en la perfusión cerebral global, con instauración repentina, corta duración y recuperación completa [2]. El síncope es un problema clínicamente significativo, responsable del 1% de las admisiones hospitalarias y 3% de las visitas a las salas de urgencias, con una morbilidad y mortalidad superior al 7% [3],[4]. El síncope es una manifestación de diferentes procesos y por lo tanto debe ser visto como un síntoma y no una enfermedad, y debe ser clasificado de acuerdo a la causa de base. Siempre es importante, especialmente en pacientes ancianos, descartar otras causas de síncope, tales como enfermedad carotidea oclusiva, hipersensibilidad del seno carotideo o hipotensión ortostática neural (neuropatía autonómica) [5]. Casi el 40% de la población general sufre de al menos un episodio de síncope a lo largo de su vida [6]. El síncope vasovagal es el tipo más común de síncope. La incidencia pico se da en la adolescencia. La mayoría de los pacientes con síncope vasovagal son mujeres jóvenes entre 15 y 45 años de edad. El síncope vasovagal puede ser resultado de algún tipo de estrés emocional (el cual se comporta como gatillo) o cambio de postura, tal como el adoptar de forma repentina la posición de pie. El síncope vasovagal generalmente va precedido por sensación de mareo, debilidad, náusea, diaforesis o problemas visuales. Es interesante remarcar que el síncope vasovagal, síndrome de taquicardia postural ortostática, el síndrome de fatiga crónica y la fibromialgia tienen una causa de base en común: una disfunción del sistema nervioso autónomo, y por lo tanto se agrupan en un término: “Disautonomías” [7],[8]. El sistema nervioso autónomo regula funciones fisiológicas que no dependen de la consciencia (digestión, frecuencia cardiaca, presión arterial, etcétera). Consiste en dos subsistemas: el simpático y el parasimpático (o vagal). El primero es un estimulante de funciones neurovegetativas mientras que el segundo las deprime. Son tradicionalmente vistos como sistemas antagonistas y normalmente están en equilibrio: si uno está activo el otro es inhibido para compensar. Cuando se pierde este balance, pueden aparecer diversos síntomas incluyendo disnea, taquicardia, fatiga, parestesia, mareo, dolor muscular, síndrome de intestino irritable, dolor torácico, ansiedad, depresión y/o síncope. La manifestación del síncope y la presencia de manifestaciones clínicas de intolerancia ortostática (fatiga, mareo, etcétera) son de gran importancia y magnitud puesto que pueden conducir a una incapacidad [9]; por lo tanto, cualquier intento para disminuirlos o evitarlos debe ser tomado en consideración.
Antecedentes históricos
La primera mención de vagotonía como una entidad clínica corresponde a los doctores Eppinger y Hess, quienes publicaron en libro titulado “Die Vagotonie” [10] en 1910. En su libro mencionan que la bradicardia sinusal podía ser controlada, aunque de forma temporal, mediante la administración de una sustancia vagolítica tal como atropina. Más tarde, muchos investigadores continuaron los esfuerzos para definir vagotonía en una forma más precisa. Para una excelente reseña histórica sobre este tema, incluyendo un análisis exhaustivo de la tesis del Profesor Salvador Zubirán («Vagotonía», publicada en la Ciudad de México en 1923) referimos al lector al artículo escrito por los doctores Delgado y Estañol [11].
El término “síncope vasovagal” fue introducido por Sir Thomas Lewis [12] pero Da Costa había observado previamente manifestaciones clínicas similares en soldados que pelearon durante la guerra civil en los Estados Unidos de América [13] y lo llamó «corazón irritable». Desde entonces, a los síntomas sin explicación médica que surgían en los soldados en tiempos de guerra se les ha otorgado diversos términos genéricos, y aún tan reciente como en 1990 se les agrupó dentro del término “síndromes de guerra” o “desórdenes post-combate”. Para una revisión completa referimos al lector al trabajo de Jones [14]. En breve, durante la Primera Guerra Mundial, doctores británicos encontraron manifestaciones clínicas similares en los soldados y lo llamaron “acción desorganizada del corazón”; Lewis lo llamó “corazón del soldado” o “síndrome de esfuerzo” y Levine le dio un nombre más científico: “astenia neurocirculatoria” [15]. El Profesor Ignacio Chávez, en 1933, en su libro “Cinco lecciones de cardiología clínica” reportó, tras haber estudiado un paciente con síncope: “dado que se queja de dolor en muchos sitios anatómicos al mismo tiempo y con gran intensidad, es muy probable que no tenga lesiones en ninguno de ellos, y que la enfermedad provenga del sistema neurovegetativo” [16]. Durante la Segunda Guerra Mundial, se notó nuevamente que en respuesta al estrés durante el combate aparecían síntomas somáticos en los soldados, incluyendo fatiga, palpitaciones, cefalea, diarrea, dificultad para concentrarse y alteraciones del sueño. Inicialmente conocido como “neurosis de guerra”, el uso de dicho término se rechazó más tarde puesto que implicaba que los soldados estaban enfermos, lo cual ejercía presión en los militares para tomar responsabilidad de ellos como pacientes [12]. En 1941 Wood [17] lo atribuyó a una forma de psiconeurosis, y en la tercera edición (1968) de su libro lo incluyó dentro de las manifestaciones cardiovasculares de psicopatías. La interrelación de los aspectos psicológicos y el síncope vasovagal está hoy en día bien documentada [18],[19]. Los hallazgos más recientes relacionados a trastornos post-combate son aquellos de la Guerra del Golfo (1990-1991). Algunos reportes confirman que puede existir disfunción del sistema nervioso autónomo en veteranos de la Guerra del Golfo con fatiga crónica [20],[21],[22].
Fisiopatología del síncope vasovagal
Tono autonómico basal en el síncope vasovagal
Existen resultados controversiales respecto a parámetros basales del tono autonómico entre pacientes con síncope y los controles (individuos sanos). La Tabla 1 [23],[24],[25],[26],[27] muestra una lista de estudios que incluyen dominios de tiempo y frecuencia, variabilidad de frecuencia cardiaca y microneurografía. La mayoría han fallado en demostrar una diferencia en los valores medios de los índices de variabilidad de frecuencia cardiaca entre sujetos normales y pacientes con síncope vasovagal. Solamente Shim et al [27] encontraron evidencia de un incremento en el tono vagal basal en niños con síncope vasovagal. Una observación interesante fue reportada por Guzmán y colaboradores [24]: encontraron una disminución en la media de la desviación de la raíz cuadrada de los intervalos R-R (RMSD) y un ratio más alto de baja frecuencia/alta frecuencia (BF/AF ratio) en sujetos con una prueba de inclinación positiva (HUT) con una respuesta vasodepresora en comparación con aquellos con una respuesta cardioinhibitoria o mixta. Este hallazgo podría implicar un tono simpático incrementado en el grupo vasodepresor aunque otros investigadores no lo han reproducido.
Recientemente, Efremov y colaboradores [26] reportaron que el análisis de la variabilidad de frecuencia cardiaca dentro de los primeros 20 minutos pasivos en la prueba de inclinación demostraron que los pacientes con síncope inducido por nitroglicerina se caracterizan por presentar una disminución de la actividad parasimpática, lo cual no ocurre en pacientes con una respuesta negativa a la nitroglicerina. En pacientes que tuvieron una prueba de inclinación positiva, dos parámetros espectrales de la variabilidad de frecuencia cardiaca: frecuencia cardiaca y poder total tuvieron una disminución significativa de la fase pasiva a la fase con utilización de nitroglicerina, mientras que en los sujetos negativos la frecuencia cardiaca promedio y los valores de poder total no cambiaron. Estamos completamente de acuerdo con Efremov y colaboradores en que “se necesita más investigación para evaluar si un análisis apropiado de la variabilidad de frecuencia cardiaca puede mejorar la diferenciación entre diferentes tipos de síncope”.
Tabla 1. Estudios sobre tono basal autónomo en syncope vasovagal.
Respuesta neurohumoral a la posición de pie
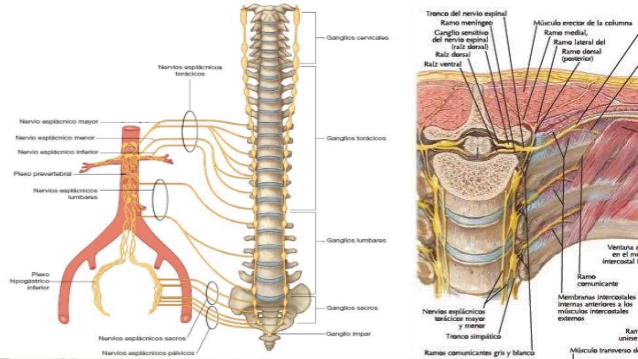
En los humanos, el mantener un suministro adecuado de sangre a los órganos vitales al estar de pie desafiando la gravedad constituye un reto fisiológico importante. El estar de pie debería ser considerado un esfuerzo para nuestras capacidades reguladoras de la circulación; se requiere que la estructura y el buen funcionamiento del corazón, los vasos sanguíneos, y el sistema nervioso autónomo estén intactos. También es relevante un volumen sanguíneo adecuado y la habilidad de los músculos esqueléticos de las piernas para comprimir las venas y facilitar el regreso de la sangre al corazón. El cambio de la posición decúbito a ortostática resulta en la acumulación de 300 a 800 ml de sangre en las extremidades inferiores y la circulación esplácnica, causando hipovolemia central, debido a una disminución en el retorno venoso al corazón con reducción concomitante del llenado ventricular izquierdo (precarga), con caída transitoria del volumen de salida del ventrículo izquierdo y la presión arterial. Para un mejor entendimiento del reflejo barorreceptor, referimos al lector a un excelente artículo en español publicado por Estañol y colaboradores [28] en 2011. En resumen, la actividad del sistema nervioso simpático es regulada en primer lugar por mecanorreceptores (barorreceptores), los cuales detectan cambios en la presión arterial, y en un grado menor por quimiorreceptores. Los barorreceptores arteriales (receptores de alta presión) están localizados en el seno carotideo y arco aórtico, y los barorreceptores cardiopulmonares (receptores de baja presión) en las grandes venas, aurículas (receptores A y B, reflejo de Bainbridge [un incremento en la presión o una distención aumentada de la aurícula derecho causa aceleración del latido cardiaco, también llamado “efecto Bainbridge”]), y ventrículos (reflejo Bezold-Jarisch). En estos mecanorreceptores, los canales iónicos son activados por estiramiento y modulan la actividad eferente simpática mandando información aferente al núcleo del tracto solitario (tractus solitarius) [29].
Los barorreceptores responden a la disminución en el retorno venoso y presión arterial que ocurre al momento de tomar la posición de pie con un incremento en la actividad simpática eferente y una disminución en el tono p arasimpático, lo cual resulta en un incremento de la frecuencia cardiaca e inotropismo, así como vasoconstricción arterial periférica. Por lo tanto, la hipovolemia central trnasitoria con una caída transitoria concomitante del volumen de salida del ventrículo izquierdo resulta en una distención más baja de los barorreceptores del seno carotídeo y el arco aórtico, con una reducción de la actividad barorrefleja aferente al tronco cerebral, con una consecuente activación simpática eferente e inhibición parasimpática que finalmente incrementa la frecuencia cardiaca y la resistencia vascular periférica, en un intento, por lo general exitoso, de restaurar el volumen de salida cardiaco y la presión arterial. Para ayudar a minimizar la reducción en la presión arterial ortostática, se ha descrito un incremento en la reabsorción de fluidos asociada con un incremento en resistencias periféricas totales [30],[31]. Tras una recuperación de la caída inicial de la presión arterial durante el ortostatismo, el volumen sanguíneo disminuye lentamente debido a la filtración microvascular.
En condiciones normales, el estrés ortostático evoca vasoconstricción compensatoria en múltiples lechos vasculares incluyendo los músculos esqueléticos. La actividad de los nervios simpáticos de los músculos se podría registrar en los humanos por microneurografía; se trata de una evaluación directa de la actividad nerviosa simpática en individuos conscientes [32] y está estrechamente ligada a la presión arterial vía el mecanismo barorreflejo de cada persona. En respuesta a una inclinación progresiva, en individuos sanos esta actividad simpática incrementa y se correlaciona con el grado de inclinación [33].
Jacob y colaboradores [34], estudiaron los cambios neurohumorales en respuesta al ortostatismo en individuos saludables y notaron un rápido y progresivo incremento en la descarga de noradrenalina, resultando en un incremento en la actividad de los nervios simpáticos y una disminución en la noradrenalina sérica [35]. La correlación estrecha entre la frecuencia cardiaca y la concentración de adrenalina plasmática descrita por Jacob [34] sugiere que esto puede provocar el incremento en la frecuencia cardiaca durante los primeros minutos del reto ortostático. El incremento en las concentraciones plasmáticas de noradrenalina estimula los receptores alfa-1 adrenérgicos e induce vasoconstricción. Estos autores también mostraron elevación sostenida de la aldosterona e incremento en la actividad del sistema renina-angiotensina-aldosterona. Estas respuestas estuvieron correlacionadas con la hipovolemia transitoria asociada con el desplazamiento del fluido intravascular a las venas de distintos compartimentos incluyendo abdomen, región pélvica y extremidades. El incremento en la actividad de renina y aldosterona ejerce múltiples efectos compensatorios para mantener la postura: incremento en la reabsorción tubular renal de sodio, vasoconstricción directa y facilitamiento de la descarga de noradrenalina actuando en neuronas noradrenérgicas presinápticas, y posiblemente en el sistema nervioso central.
Respuesta simpática al reto ortostático en la prueba de inclinación y su supresión previa al síncope vasovagal
Dada la importancia del sistema nervioso simpático en regular la respuesta a los cambios posturales, se ha considerado que diversos grados de disfunción simpática están involucrados en la intolerancia ortostática. Los primeros estudios en investigar la fisiopatología del síncope vasovagal mostraron que un reflejo paradójico y compensatorio estaba involucrado. La llamada “teoría ventricular” postula que los barorreceptores reaccionan a la disminución en la presión arterial con una activación del sistema nervioso simpático, causando una mayor respuesta inotrópica y cronotrópica, así como vasoconstricción periférica [36]. Esta teoría sugiere que las contracciones vigorosas de un ventrículo izquierdo depletado en volumen causa activación debido al estiramiento de las fibras C del corazón (mecanorreceptores formados por fibras desmienilizadas encontrados en aurículas, ventrículos y arteria pulmonar). Esta estimulación de fibras C aferentes produce una supresión “paradójica” del tono simpático periférico y un incremento en el tono vagal, causando vasodilatación y bradicardia [37]. Observaciones más recientes refutaron esta teoría. Novak y colaboradores [38] usando mediciones ecocardiográficas del ventrículo izquierdo y la fracción de expulsión no encontraron evidencia de un vaciamiento cardiaco progresivo previo al síncope; y Liu y colaboradores [39], usando medidas del esfuerzo y engrosamiento de la pared segmental del ventrículo izquierdo, no encontraron evidencia de la activación de mecanorreceptores en esta cámara.
La interrupción abrupta de la actividad nerviosa simpática de la vasculatura de los músculos esqueléticos, representando una “caída” simpática, ha sido considerado un paso importante para la vasodilatación que lleva a la hipotensión. Estudios previos mostraron que previo al síncope vasovagal, la actividad simpática eferente medida con microneurografía, disminuía progresivamente o era interrumpida de forma abrupta [40]. Esta reducción en la actividad simpática estuvo directamente relacionada con la presión arterial media, mientras que la actividad parasimpática medida por análisis espectral de la variabilidad de la frecuencia cardiaca permaneció por debajo de lo basal, sugiriendo que el control simpático de la resistencia periférica total fue el mecanismo responsable del síncope vasovagal. Morillo y colaboradores [23] demostraron que durante ≈100 segundos antes del establecimiento del presíncope, las presiones sistólica y diastólica y la actividad simpática de los nervios musculares tendía a bajar (p=0,015, 0,054 y 0,19). Cuando se estableció el presíncope, la microneurogafía promedio y la presión arterial bajaron de forma abrupta. Este estudio estableción el concepto de “retiro simpático” como el principal mecanismo que precede al síncope vasovagal. Mosqueda-Garcia y colaboradores [33] encontraron que el incremento inicial en la actividad simpática (medido por la microneurografía) en respuesta a los cambios en el volumen circulatorio en el ortostatismo, fue diferente entre los pacientes con síncope vasovagal y los controles: estuvo reducida en el primer grupo. Estos pacientes también mostraron una reducción en el incremento máximo en la microneurografía y noradrenalina plasmática que fueron inadecuados para compensar el descenso significativo en la presión arterial. Esta respuesta fue seguida por la inactividad nerviosa y la aparición del síncope. Estos autores también observaron reducciones significativas en las respuestas barorreflejas en pacientes que estuvieron en decúbito; ellos postularon por lo tanto que una disminución en la respuesta barorrefleja podría explicar la incapacidad de estos pacientes para incrementar actividad simpática eferente en respuesta a una caída en la presión arterial. Estos resultados coinciden con los presentados por Bechir y colaboradores [41], quienes también encontraron que pacientes con síncope vasovagal también presentaron una respuesta barorrefleja disminuida durante el reto ortostático y la microneurografía. De forma interesante, estos pacientes tuvieron un tono simpático incrementado en condiciones basales. Este incremento en la modulación del tono simpático vasomotor basal podría depletar su reserva y prevenir el incremento del tono simpático vasomotor eferente para apoyar a las resistencias periféricas durante el estrés ortostático. Sin embargo, observaciones hechas por Vaddadi y colaboradores [42], desacreditan la idea de que el “gatillo” final responsable para una reacción vasovagal ortostática es la inhibición del sistema nervioso simpático, mostrando que la actividad simpática eferente (medida por microneurografía) permaneció normal en nueve de diez pacientes. En estas circunstancias, una hipótesis alterna podría ser que la reducción en la fracción de expulsión es el evento fisiológico predominante que causa la hipotensión. En un estudio reciente conducido en 56 pacientes con sospecha de síncope vasovagal, bajo una prueba de inclinación, se observó una reducción del 50% en la fracción de expulsión, mientras que las resistencias vasculares sistémicas permanecieron estables hasta que se presentó el presíncope [43].
Desórdenes funcionales de las proteínas de los nervios simpáticos
Vaddadi y colaboradores [44] compararon dos grupos de pacientes con síncope vasovagal: aquellos con presión arterial normal en decúbito (sistólica>100 mmHg) con aquellos con presión arterial baja en decúbito (sistólica≤ 100 mmHg). Ambos tipos de pacientes tuvieron un amortiguamiento importante de las concentraciones de noradrenalina plasmática (“rebosamiento” o “derrame” de noradrenalina) en respuesta a la prueba de inclinación, indicando una falla en el sistema nervioso simpático para responder al reto ortostático. Para explicar estos resultados, analizaron las proteínas involucradas en la transmisión neural simpática (síntesis, reserva, salida y recaptación de noradrenalina). Pacientes con síncope vasovagal del grupo 1, que estuvieron “normotensos” en el decúbito, mostraron una reducción en la expresión de tirosin hidroxilasa. Esta enzima es responsable de la producción de noradrenalina, así que un nivel bajo de la misma podría explicar la disminución en la concentración de este neurotransmisor. En contraste, pacientes del grupo 2 (hipotensos en decúbito) mostraron concentraciones elevadas del transportador de noradrenalina. Ese último es responsable del aclaramiento de noradrenalina en la hendidura sináptica para terminar la señal nerviosa. Una expresión aumentada del transportador de noradrenalina podría depurar noradrenalina de una forma más rápida, reduciendo la vasoconstricción compensatoria y predisponiendo a hipotensión postural. Más tarde discutiremos los potenciales usos terapéuticos de este hallazgo.
Inervación miocárdica adrenérgica
Kochiadakis y colaboradores [25] mostraron que pacientes con síncope vasovagal tuvieron un alto grado de disturbio en la inervación miocárdica adrenérgica y múltiples defectos en la inervación adrenérgica. El análisis semi-cuantitativo de la inervación adrenérgica mostró un ratio C/M (corazón/mediastino) significativamente más bajo en pacientes sincopales comparado con el grupo control. Por lo contrario, la tasa de aclaramieinto de 123I-MIBG fue significativamente mayor en pacientes con síncope vasovagal. Ellos sugieren un posible predominio de la actividad adrenérgica cardiaca en aquellos con gammagrafía cardiaca anormal MIBG. El decremento en la toma de MIBG pudiera ser una consecuencia indirecta de ya sea noradrenalina circulante crónicamente incrementada o un incremento en la descarga de noradrenalina miocárdica. La tasa de aclaramiento incrementada pudiera también reflejar un aumento en la actividad nerviosa simpática cardiaca.
Genética del sistema nervioso simpático en el síncope vasovagal
Ha sido bien demostrado que pacientes con síncope vasovagal frecuentemente tienen un familiar de primer grado también afectado [45]. Aunque la participación de la genética en el síncope vasovagal ha sido discutida, alguna evidencia sugiere que hay un componente genético mayor: los receptores adrenérgicos. Los estudios muestran una asociación entre prueba de inclinación positiva en pacientes con síncope y la presencia de polimorfismos de dos receptores adrenérgicos, el Arg389Gly de beta-1 [46] y el Arg347Cys del alfa-1a (α1a) [47]. Desgraciadamente, estos hallazgos no se han reproducido.
Betabloqueadores en síncope vasovagal
Basado en la información previamente presentada, no es sorpresa que los betabloqueadores fueran empleados en el tratamiento del síncope vasovagal desde el inicio [48]. Aunque los resultados iniciales en el uso de betabloqueadores en estudios clínicos no controlados o al ser comparados con tratamiento estándar parecieran prometedores, hay varios estudios controlados, comparados con placebo, en los cuales no se ha demostrado un efecto real de estos fármacos (Tabla 2). Sin embargo, es importante describir algunas de las limitaciones de estos estudios. En primer lugar, debe ser considerado que todos los estudios publicados tienen una muestra pequeña; algunos de ellos incluyeron menos de 10 pacientes. También es importante mencionar que el seguimiento fue corto (Tabla 2) en la mayoría de ellos. El único estudio aleatorizado con un tamaño de muestra adecuado fue síndrome de taquicardia postural ortostática [49] y no pudo demostrar ningún beneficio con el uso de betabloqueadores. Sin embargo, debe ser notado que se utilice una dosis fija de metoprolol en todos los pacientes, sin individualizar la dosis, lo que probablemente justifica la ausencia de resultados positivos. Una dosis fija de metoprolol puede afectar los resultados ya que no todos los pacientes lo toleran. En nuestra práctica clínica hemos aprendido que, dependiendo del individuo, algunas veces es necesario empezar con una dosis muy baja de metoprolol (25-50 mg/día) e incrementarla progresivamente cada 2-4 semanas. En el estudio mencionado (Prevention of Syncope Trial, POST), los investigadores incrementaron la dosis de 50 mg a 100 mg dos veces al día en 3-5 días. Esto pudiera explicar la alta incidencia de abandono del estudio en el grupo que tomó metoprolol (22%). Sin embargo, un subanálisis del estudio mostró que el metoprolol fue efectivo en pacientes mayores de 42 años [50]. Apoyando este descubrimiento, Benditt y colaboradores [51] reportaron que en estos pacientes las diferencias relacionadas con la edad estuvieron relacionadas con la cantidad de catecolaminas circulantes. Ellos encontraron que aunque las concentraciones basales de adrenalina y noradrenalina fueron similares en sujetos jóvenes y en aquellos mayores de 40 años, el ratio de adrenalina y noradrenalina incrementó mucho en pacientes jóvenes. Basado en estos descubrimientos, actualmente está en curso un estudio placebo-controlado sobre el uso de metoprolol en sujetos con síncope vasovagal mayores de 40 años [52]. En una revisión, Raj y Coffin [53], propusieron que los betabloqueadores pueden ser una opción terapéutica razonable para pacientes con síncope vasovagal e hipertensión arterial sistémica.
Tabla 2. Resumen de estudios de betabloqueadores (BB) en el sincope vasovagal.*
Vyas y colaboradores [54] publicaron un metanálisis de todos los estudios sobre diferentes opciones de tratamiento en el síncope vasovagal. Se incluyeron trece estudios en el análisis de pacientes tratados con betabloqueadores. En este metanálisis hubo diferencias significativas a favor de los betabloqueadores cuando se lanzaron los 13 estudios. Una revisión sistemática de la literatura mostró que el tratamiento con betabloqueadores fue significativamente mejor en comparación con la terapia estándar. Sin embargo, no se encontraron diferencias en todos los estudios al compararlos con placebo, otros fármacos o marcapasos [55].
Propiedades farmacológicas de los betabloqueadores y su efecto en el síncope vasovagal
Algunos aspectos que no pueden ser cubiertos por el metanálisis y revisiones sistemáticas con las diferentes propiedades farmacológicas de los betabloqueadores. El factor más relevante en sujetos con síncope vasovagal es la actividad simpática intrínseca, lo cual limita el efecto de bradicardia de algunos betabloqueadores tal como el pindolol. Aunque este efecto puede ser útil para evitar más bradicardia en sujetos con tendencia a frecuencia cardiaca baja, también puede estar asociado con palpitaciones, lo cual puede limitar su uso. A este respecto, la titulación de la dosis es un factor muy importante que no se ha tomado en cuenta en estudios previos. También es importante para la especificidad a los órganos objetivo de los betabloqueadores. Las diferencias entre antagonistas no selectivos (con o sin actividad alfa antagonista) en comparación con el selectivo beta-antagonista-1 tampoco han sido abordados de forma adecuada. El uso de agentes con actividad vasodilatadora arteriolar (ej. labetalol, carvedilol, nebivolol) puede ser más util en el subgrupo de pacientes que también sufren de hipertensión reactiva, pero podría dañar a pacientes propensos a presión arterial baja. Finalmente, la afinidad de algunso betabloqueadores, tal como pindolol, para el subtipo de receptors de serotonina 1A (5-HT1A) para depresión pudiera también ser parte del efecto en el síncope vasovagal [56].
Inhibidores de la recaptación de noradrenalina en síncope vasovagal
Como se mencionó, la recaptación de noradrenalina en la hendidura sináptica, hecha posible por el transportador de noradrenalina, es el mecanismo principal de inactivación de esta catecolamina. Por lo tanto, la acción del transportador de noradrenalina es un factor clave en su regulación. Concentraciones aumentadas del transportador de noradrenalina o un incremento en su función resultarían en una inactivación mayor de noradrenalina y viceversa (una disminución en su concentración o menor actividad del transportador de noradrenalina implicaría mayor acción de los receptores adrenérgicos). En un caso con síndrome de taquicardia postural ortostática, Goldstein y colaboradores [57] encontraron una mutación que disminuyó la función del transportador de noradrenalina en 98%, demostrando por primera vez una relación entre una función disminuida de este transportador con hiperactividad simpática clínica, manifestada por taquicardia postural.
Por otro lado, una actividad incrementada del transportador de noradrenalina, aclarando más rápidamente el neurotransmisor, reduciría la vasoconstricción compensadora predisponiendo a hipotensión ortostática. Esta posibilidad teórica es apoyada por diversos estudios. Schroeder y colaboradores [58] mostraron una mejor tolerancia a la prueba de inclinación bajo tratamiento con inhibidor del transportador de noradrenalina (reboxetina) comparada con placebo en 18 sujetos sanos. La reboxetina es un fármaco que es usado como antidepresivo. Bajo placebo, ocurrió una reacción vagal en el 50% de los individuos (9 de 18), mientras que sólo un individuo sufrió desmayo (5%) bajo reboxetina. Expandieron su observación con 51 sujetos sanos sin historia de síncope [59]. En este grupo, compararon dos inhibidores del transportador de noradrenalina: sibutramina (un fármaco usado para pérdida de peso) o reboxetina. Mostraron nuevamente una mayor tolerancia al ortostatismo pasivo durante la prueba de inclinación; la duración de la prueba antes de que el paciente presentara reacción vagal incrementó de 29 ± 2 a 35 ± 1 min (p = 0,001) cuando el sujeto estaba bajo el efecto de cualquiera de estos dos inhibidores. Una excelente revisión de estos hallazgos y sus implicaciones fue expuesto por el principal autor de estos trabajos en el 2012 [60]. Sheldon y colaboradores [61] reportaron que cinco de siete pacientes muy sintomáticos con múltiple recurrencia de síncope vasovagal (32 eventos en promedio por mes) tratados con sibutramina mostraron una reducción en la frecuencia de desmayos por más del 50%.
Se retiró la sibutramina del mercado en muchos países, incluyendo México, al mostrar un estudio incremento en la tasa de eventos cardiovasculares (infarto agudo al miocardio y evento vascular cerebral) en personas con enfermedad cardiaca previa. Ramírez y colaboradores [62] reportaron que la atomoxetina, un inhibidor del transportador de noradrenalina aprobado para el tratamiento del déficit de atención, podía incrementar la presión arterial en individuos con falla autonómica. La atomoxetina fue aún mejor que la midodrina en mejorar la presión arterial al adoptar la posición ortostática en un grupo de 65 pacientes con falla autonómica severa (causado por enfermedad de Parkinson, atrofia múltiple sistémica o falla autonómica pura). Por lo tanto, la atomoxetina podría ser una opción terapéutica para síncope vasovagal dada su disponibilidad en muchos países en la posibilidad de utilizar dosis pediátricas.
Conclusiones
Al momento, los betabloqueadores son considerados un placebo porque no hay evidencia fuerte sobre su uso. Sin embargo, se necesitan con urgencia más estudios sobre el uso de betabloqueadores en síncope vasovagal basados en la información presentada en este documento y en el hecho de que aún son usados en la práctica clínica dada la excelente respuesta reportada por expertos clínicos. Un estudio multicéntrico (POST-5) se está llevando a cabo en un intento de probar esta hipótesis. Estudios recientes en la inhibición de la recaptación de noradrenalina con agentes específicos han mostrado resultados prometedores en esta entidad y ameritan más investigación.
Referencias
Hermosillo AG, Márquez MF, Jáuregui-Renaud K, Cárdenas M. Orthostatic hypotension, 2001. Cardiol Rev. 2001 Nov-Dec;9(6):339-47. | PubMed |
Medow MS, Stewart JM, Sanyal S, Mumtaz A, Sica D, Frishman WH. Pathophysiology, diagnosis, and treatment of orthostatic hypotension and vasovagal syncope. Cardiol Rev. 2008 Jan-Feb;16(1):4-20. | PubMed |
Mathias CJ, Deguchi K, Schatz I. Observations on recurrent syncope and presyncope in 641 patients. Lancet. 2001 Feb 3;357(9253):348-53. | PubMed |
Celaya Cota M de J, Márquez MF. Evaluación de síncope en el Servicio de Urgencias. In: Manual de Urgencias Cardiovasculares. Cuarta. México: Mc Graw Hill;2012.
Allende R, Cázares Campos I, Márquez MF. Neuropatía. En: Atención Integral Del Paciente Diabético. Cuarta. México: Mc Graw Hill; 2011.
Cárdenas M, Vallejo M, Martínez-Palomino G, Paredes-Balderas G, Sandoval-Rubio LA, et al. Prevalencia de síncope en una muestra de mujeres mexicanas residentes en la ciudad de México. Arch Cardiol México. 79(3):197-200. | Link |
Martínez-Martínez LA, Mora T, Vargas A, Fuentes-Iniestra M, Martínez-Lavín M. Sympathetic nervous system dysfunction in fibromyalgia, chronic fatigue syndrome, irritable bowel syndrome, and interstitial cystitis: a review of case-control studies. J Clin Rheumatol. 2014 Apr;20(3):146-50. | CrossRef | PubMed |
Lerma C, Martinez-Martinez LA, Ruiz N, Vargas A, Infante O, Martinez-Lavin M. Fibromyalgia beyond reductionism. Heart rhythm fractal analysis to assess autonomic nervous system resilience. Scand J Rheumatol. 2016;45(2):151-7. | CrossRef | PubMed |
Lobban TC. Syncope: a patient and family perspective. Cardiol Clin. 2013 Feb;31(1):1-8. | CrossRef | PubMed |
Eppinger H, Hess L. Die Vagotonie. Berlin: Eine Klinische Studie; 1910.
Delgado G, Estañol-Vidal B. Vagotonía. La tesis recepcional de Salvador Zubirán. Rev Invest Clin. 2012;64(4):387-398. | Link |
Lewis T. A Lecture on vasovagal syncope and the carotid sinus mechanism. Br Med J. 1932 May 14;1(3723):873-6. | PubMed |
Wooley CF. Jacob Mendez DaCosta: medical teacher, clinician, and clinical investigator. Am J Cardiol. 1982 Nov;50(5):1145-8. | PubMed |
Jones E. Historical approaches to post-combat disorders. Philos Trans R Soc Lond B Biol Sci. 2006 Apr 29;361(1468):533-42. | PubMed |
Levine SA. The origin of the term neurocirculatory asthenia. N Engl J Med. 1965 Sep 9;273:604-5. | PubMed |
Chávez I. Cinco Lecciones de Clínica Cardiológica. Méndez Oteo; 1933.
Wood P. Da Costa’s Syndrome: Aetiology. Lecture III. Br Med J. 1941 Jun 7;1(4196):845-51. | PubMed |
Ríos-Martínez BP, Huitrón-Cervantes G, Márquez MF, González-Hermosillo JA, Rangel-Rodríguez GA, Pedraza-Moctezuma LG. Estudio descriptivo de la personalidad y psicopatología en pacientes con síncope vasovagal. Arch Cardiol México. 79(3):207-211. | Link |
Lerma A, Lerma C, Márquez MF, Cárdenas M, Hermosillo AG. Correlation of syncopal burden with anxiety symptoms score in recurrent vasovagal syncope. Int J Cardiol. 2013 Jun 5;166(1):266-7. | CrossRef | PubMed |
Davis SD, Kator SF, Wonnett JA, Pappas BL, Sall JL. Neurally mediated hypotension in fatigued Gulf War veterans: a preliminary report. Am J Med Sci. 2000 Feb;319(2):89-95. | PubMed |
Haley RW, Charuvastra E, Shell WE, Buhner DM, Marshall WW, Biggs MM, et al. Cholinergic autonomic dysfunction in veterans with Gulf War illness: confirmation in a population-based sample. JAMA Neurol. 2013 Feb;70(2):191-200. | CrossRef | PubMed |
Li M, Xu C, Yao W, Mahan CM, Kang HK, Sandbrink F, et al.Self-reported post-exertional fatigue in Gulf War veterans: roles of autonomic testing. Front Neurosci. 2014 Jan 7;7:269. | CrossRef | PubMed |
Morillo CA, Eckberg DL, Ellenbogen KA, Beightol LA, Hoag JB, Tahvanainen KU, et al. Vagal and sympathetic mechanisms in patients with orthostatic vasovagal syncope. Circulation. 1997 Oct 21;96(8):2509-13. | PubMed |
Guzmán CE, Sánchez GM, Márquez MF, Hermosillo AG, Cárdenas M. Differences in heart rate variability between cardioinhibitory and vasodepressor responses to head-up tilt table testing. Arch Med Res. 1999 May-Jun;30(3):203-11. | PubMed |
Kochiadakis G, Marketou M, Koukouraki S, Parthenakis F, Chlouverakis G, Karkavitsas N, et al. Cardiac autonomic disturbances in patients with vasovagal syndrome: comparison between iodine-123-metaiodobenzylguanidine myocardial scintigraphy and heart rate variability. Europace. 2012 Sep;14 (9):1352-8. | CrossRef | PubMed |
Efremov K, Brisinda D, Venuti A, Iantorno E, Cataldi C, Fioravanti F, Fenici R. Heart rate variability analysis during head-up tilt test predicts nitroglycerine-induced syncope. Open Heart. 2014 Jun 14;1(1):e000063. | CrossRef | PubMed |
Shim SH, Park SY, Moon SN, Oh JH, Lee JY, Kim HH, Han JW, et al. Baseline heart rate variability in children and adolescents with vasovagal syncope. Korean J Pediatr. 2014 Apr;57(4):193-8. | CrossRef | PubMed |
Estañol B, Porras-Betancourt M, Padilla-Leyva MÁ, Sentíes-Madrid H. Breve historia del reflejo barorreceptor: de Claude Bernard a Arthur C. Guyton. Ilustrada con algunos experimentos clásicos. Arch Cardiol México. 81(4):330-336. | Link |
Chapleau MW, Cunningham JT, Sullivan MJ, Wachtel RE, Abboud FM. Structural versus functional modulation of the arterial baroreflex. Hypertension. 1995 Aug;26(2):341-7. | PubMed |
Hinghofer-Szalkay H, König EM, Sauseng-Fellegger G, Zambo-Polz C. Biphasic blood volume changes with lower body suction in humans. Am J Physiol. 1992 Oct;263(4 Pt 2):H1270-5. | PubMed |
Hinghofer-Szalkay H, Lackner HK, Rössler A, Narath B, Jantscher A, Goswami N. Hormonal and plasma volume changes after presyncope. Eur J Clin Invest. 2011 Nov;41(11):1180-5. | CrossRef | PubMed |
Charkoudian N, Rabbitts JA. Sympathetic neural mechanisms in human cardiovascular health and disease. Mayo Clin Proc. 2009 Sep;84(9):822-30. | CrossRef | PubMed |
Mosqueda-Garcia R, Furlan R, Fernandez-Violante R, Desai T, Snell M, Jarai Z, et al. Sympathetic and baroreceptor reflex function in neurally mediated syncope evoked by tilt. J Clin Invest. 1997 Jun 1;99(11):2736-44. | PubMed |
Jacob G, Ertl AC, Shannon JR, Furlan R, Robertson RM, Robertson D. Effect of standing on neurohumoral responses and plasma volume in healthy subjects. J Appl Physiol (1985). 1998 Mar;84(3):914-21. | PubMed |
Meredith IT, Eisenhofer G, Lambert GW, Jennings GL, Thompson J, Esler MD. Plasma norepinephrine responses to head-up tilt are misleading in autonomic failure. Hypertension. 1992 Jun;19(6 Pt 2):628-33. | PubMed |
Thorén P. Role of cardiac vagal C-fibers in cardiovascular control. Rev Physiol Biochem Pharmacol. 1979;86:1-94. | PubMed |
Kaufmann H. Neurally mediated syncope: pathogenesis, diagnosis, and treatment. Neurology. 1995 Apr;45(4 Suppl 5):S12-8. | PubMed |
Novak V, Honos G, Schondorf R. Is the heart «empty’ at syncope? J Auton Nerv Syst. 1996 Aug 27;60(1-2):83-92. | PubMed |
Liu JE, Hahn RT, Stein KM, Markowitz SM, Okin PM, Devereux RB, et al. Left ventricular geometry and function preceding neurally mediated syncope. Circulation. 2000 Feb 22;101(7):777-83. | PubMed |
Jardine DL, Ikram H, Frampton CM, Frethey R, Bennett SI, Crozier IG. Autonomic control of vasovagal syncope. Am J Physiol. 1998 Jun;274(6 Pt2):H2110-5. | PubMed |
Béchir M, Binggeli C, Corti R, Chenevard R, Spieker L, Ruschitzka F, et al. Dysfunctional baroreflex regulation of sympathetic nerve activity in patients with vasovagal syncope. Circulation. 2003 Apr 1;107(12):1620-5. | CrossRef | PubMed |
Vaddadi G, Esler MD, Dawood T, Lambert E. Persistence of muscle sympathetic nerve activity during vasovagal syncope. Eur Heart J. 2010 Aug;31 (16):2027-33. | CrossRef | PubMed |
Verheyden B, Liu J, van Dijk N, Westerhof BE, Reybrouck T, Aubert AE, et al. Steep fall in cardiac output is main determinant of hypotension during drug-free and nitroglycerine-induced orthostatic vasovagal syncope. Heart Rhythm. 2008 Dec;5(12):1695-701. | CrossRef | PubMed |
Vaddadi G, Guo L, Esler M, Socratous F, Schlaich M, Chopra R, et al. Recurrent postural vasovagal syncope: sympathetic nervous system phenotypes. Circ Arrhythm Electrophysiol. 2011 Oct;4(5):711-8. | CrossRef | PubMed |
Márquez MF, Urias KI, Hermosillo AG, Jardón JL, Iturralde P, Colín L, et al. Familial vasovagal syncope. Europace. 2005 Sep;7(5):472-4. | PubMed |
Márquez MF, Hernández-Pacheco G, Hermosillo AG, Gómez JR, Cárdenas M, Vargas-Alarcón G. The Arg389Gly beta1-adrenergic receptor gene polymorphism and susceptibility to faint during head-up tilt test. Europace. 2007 Aug;9(8):585-8. | PubMed |
Hernández-Pacheco G, González-Hermosillo A, Murata C, Yescas P, Espínola-Zavaleta N, Martínez M, et al. Arg347Cys polymorphism of α1a-adrenergic receptor in vasovagal syncope. Case-control study in a Mexican population. Auton Neurosci. 2014 Jul;183:66-71. | CrossRef | PubMed |
Márquez MF, Urias-Medina K, Gómez-Flores J, Sobrino A, Sotomayor-González A, González-Hermosillo A, et al. [Comparison of metoprolol vs clonazepam as a first treatment choice among patients with neurocardiogenic syncope]. Gac Med Mex. 2008 Nov-Dec;144(6):503-7. | PubMed |
Sheldon R, Connolly S, Rose S, Klingenheben T, Krahn A, Morillo C, et al. Prevention of Syncope Trial (POST): a randomized, placebo-controlled study of metoprolol in the prevention of vasovagal syncope. Circulation. 2006 Mar 7;113(9):1164-70. | PubMed |
Sheldon RS, Morillo CA, Klingenheben T, Krahn AD, Sheldon A, Rose MS. Age-dependent effect of β-blockers in preventing vasovagal syncope. Circ Arrhythm Electrophysiol. 2012 Oct;5(5):920-6. | CrossRef | PubMed |
Benditt DG, Detloff BL, Adkisson WO, Lu F, Sakaguchi S, Schussler S, et al. Age-dependence of relative change in circulating epinephrine and norepinephrine concentrations during tilt-induced vasovagal syncope. Heart Rhythm. 2012 Nov;9(11):1847-52. | CrossRef | PubMed |
Raj SR, Faris PD, Semeniuk L, Manns B, Krahn AD, Morillo CA, et al. Rationale for the Assessment of Metoprolol in the Prevention of Vasovagal Syncope in Aging Subjects Trial (POST5). Am Heart J. 2016 Apr;174:89-94. | CrossRef | PubMed |
Raj SR, Coffin ST. Medical therapy and physical maneuvers in the treatment of the vasovagal syncope and orthostatic hypotension. Prog Cardiovasc Dis. 2013 Jan-Feb;55(4):425-33. | CrossRef | PubMed |
Vyas A, Swaminathan PD, Zimmerman MB, Olshansky B. Are treatments for vasovagal syncope effective? A meta-analysis. Int J Cardiol. 2013 Sep 1;167(5):1906-11. | CrossRef | PubMed |
Romme JJ, Reitsma JB, Black CN, Colman N, Scholten RJ, Wieling W, et al. Drugs and pacemakers for vasovagal, carotid sinus and situational syncope. Cochrane Database Syst Rev. 2011 Oct 5;(10):CD004194. | CrossRef | PubMed |
Pérez V, Puiigdemont D, Gilaberte I, Alvarez E, Artigas F; Grup de Recerca en Trastorns Afectius. Augmentation of fluoxetine’s antidepressant action by pindolol: analysis of clinical, pharmacokinetic, and methodologic factors. J Clin Psychopharmacol. 2001 Feb;21(1):36-45. | PubMed |
Goldstein DS, Holmes C, Frank SM, Dendi R, Cannon RO 3rd, Sharabi Y, et al. Cardiac sympathetic dysautonomia in chronic orthostatic intolerance syndromes. Circulation. 2002 Oct 29;106(18):2358-65. | PubMed |
Schroeder C, Tank J, Boschmann M, et al. Selective norepinephrine reuptake inhibition as a human model of orthostatic intolerance. Circulation. 2002 Jan 22;105(3):347-53. | CrossRef | PubMed |
Schroeder C, Birkenfeld AL, Mayer AF, Tank J, Diedrich A, Luft FC, et al. Norepinephrine transporter inhibition prevents tilt-induced pre-syncope. J Am Coll Cardiol. 2006 Aug 1;48(3):516-22. | PubMed |
Schroeder C, Jordan J. Norepinephrine transporter function and human cardiovascular disease. Am J Physiol Heart Circ Physiol. 2012 Dec 1;30(11):H1273-82. | CrossRef | PubMed |
Sheldon RS, Ritchie D, McRae M, Raj S. Norepinephrine transport inhibition for treatment of vasovagal syncope. J Cardiovasc Electrophysiol. 2013 Jul;24(7):799-803. | CrossRef | PubMed |
Ramirez CE, Okamoto LE, Arnold AC, Gamboa A, Diedrich A, Choi L, et al. Efficacy of atomoxetine versus midodrine for the treatment of orthostatic hypotension in autonomic failure. Hypertension. 2014 Dec;64(6):1235-40. | CrossRef | PubMed |
 El síncope vasovagal.
El síncope vasovagal. Stephen W. Porges , PhD, es un distinguido científico en la Universidad de Indiana , donde dirige el Centro de Investigación de Traumas dentro del Instituto Kinsey. Es el creador de la teoría Polivagal y para iniciarnos en su diálogo, consideremos una frase que, que es del mismo tipo de la que suelen usar los hombres destacados, sean de letras o de ciencia
Stephen W. Porges , PhD, es un distinguido científico en la Universidad de Indiana , donde dirige el Centro de Investigación de Traumas dentro del Instituto Kinsey. Es el creador de la teoría Polivagal y para iniciarnos en su diálogo, consideremos una frase que, que es del mismo tipo de la que suelen usar los hombres destacados, sean de letras o de ciencia