QUE SON LOS (CAR-T):
Linfocitos T modificados con receptores quiméricos antígeno-específicos (CAR-T):
Lifocitos, sensibilizados contra determinadas partículas imprescindible, para algunas células ,y al destruirlas, , la célula pierde esa función ,imprescindible para seguir viviendo Cómo funciona la terapia de células CAR-T
El sistema inmunitario reconoce sustancias extrañas en el cuerpo mediante la búsqueda de proteínas llamadas antígenos en la superficie de esas células. Las células inmunitarias llamadas células T tienen sus propias proteínas llamadas receptores que se unen a antígenos extraños y ayudan a provocar que otras partes del sistema inmunitario destruyan a la sustancia extraña.
Receptores quiméricos de antígenos (CAR)
Las células T utilizadas en las terapias de células CAR-T se alteran en el laboratorio para detectar células cancerosas específicas mediante la adición de un receptor artificial (llamado receptor quimérico de antígenos o CAR). Esto les ayuda a identificar mejor a unos antígenos específicos de las células cancerosas. Dado que los diferentes tipos de cáncer tienen distintos antígenos, cada CAR está hecho para el antígeno específico de un cáncer. Por ejemplo, ciertos tipos de leucemia o linfoma tendrán un antígeno en el exterior de las células cancerosas llamado CD19. Las terapias de células CAR-T para tratar esos cánceres están diseñadas para conectarse al antígeno CD-19 y no funcionarán contra un cáncer que no tenga el antígeno CD19. Las propias células T del paciente se utilizan para producir las células CAR-T.
En la mayoría de los casos, los linfocitos T CAR son células autólogas obtenidas del propio paciente, activadas ex vivo, modificadas con un vector viral que codifica las secuencias CAR y expandidas aún más antes de ser infundidas en el paciente, un proceso que puede durar de 10 a 15 días (excluyendo exámenes de calidad). El proceso para la terapia de células CAR-T puede tomar unas semanas.
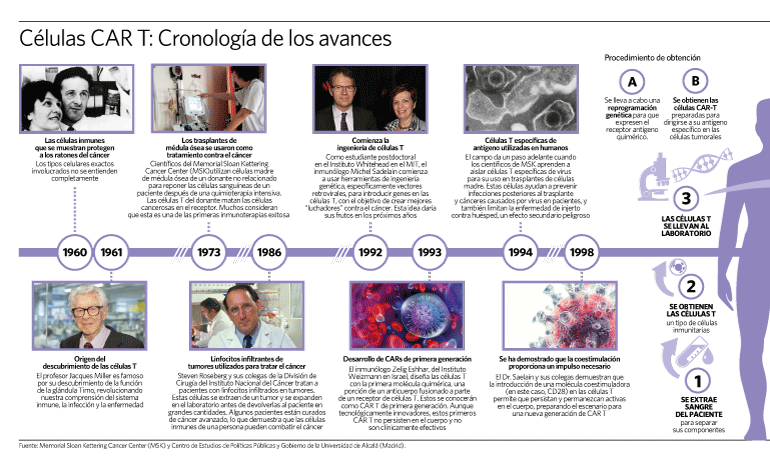
Recolección de las células T
En primer lugar, los glóbulos blancos (que incluyen las células T) se extraen de la sangre del paciente mediante un procedimiento llamado leucoféresis. Durante este procedimiento, los pacientes generalmente se acuestan en una cama o se sientan en un sillón reclinable. Se necesitan dos líneas intravenosas porque la sangre se extrae a través de una línea, y luego se regresa al torrente sanguíneo por otra línea, después de extraer los glóbulos blancos. A veces se utiliza un tipo especial de línea intravenosa llamada catéter venoso central, que tiene ambas líneas intravenosas incorporadas. El paciente tendrá que permanecer inmóvil durante 2 a 3 horas durante el procedimiento. A veces, los niveles de calcio pueden disminuir durante la leucoféresis, lo que puede causar entumecimiento y hormigueo o espasmos musculares. Esto se puede tratar fácilmente con calcio que se puede administrar por vía oral o a través de una vía intravenosa.
Producción de células CAR-T
Después de extraer los glóbulos blancos, las células T se separan, se envían al laboratorio y se alteran genéticamente agregando el receptor quimérico de antígenos (CAR). Esto las convierte en células CAR-T. Puede que tome varias semanas terminar de producir el gran número de células CAR-T necesarias para esta terapia.
Infusión de células CAR-T
Una vez que se han producido suficientes células CAR-T, se devolverán al paciente para lanzar un ataque preciso contra las células cancerosas. Unos días antes de una infusión de células CAR-T, el paciente podría recibir quimioterapia para ayudar a reducir el número de otras células inmunitarias. Esto da a las células CAR-T una mejor oportunidad de activarse para combatir el cáncer. Esta quimioterapia generalmente no es muy potente porque las células CAR-T funcionan mejor cuando hay algunas células cancerosas que puedan atacar. Una vez que las células CAR-T comienzan a unirse a las células cancerosas, empiezan a aumentar en número y pueden destruir aún más células cancerosas
El desarrollo de los llamados CAR de “segunda generación” (principalmente CD28 o 4-1BB) representó un paso crucial hacia la mejora de su eficacia clínica, especialmente en las neoplasias malignas de células B.
Una dosis única de linfocitos T CAR redirigida a la molécula CD19 [expresada en todos los linfomas no Hodgkin de células B (B-NHL) y leucemia linfoblástica aguda (B-ALL)] (CART19) dio como resultado respuestas clínicas espectaculares en pacientes con B-ALL refractaria (80% de respuestas completas, RC) y linfoma difuso de células B grandes, el subtipo B-NHL más prevalente (40% RC)2,3.
Estos datos, considerados como un “avance” clínico extraordinario, llevaron a la aprobación por parte de la EMA de dos tratamientos CART-19 distintos, tisagenlecleucel (Kymriah) y axicabtagene ciloleucel (Yescarta), para el tratamiento de pacientes con linfoma difuso de celulas B grandes (DLBCL) recurrente/refractario (ambos), y pacientes con LAL-B hasta 25 años de edad L (Kymriah).
Si bien estas dos terapias se redirigen a CD19, el tratamiento Kymriah posee una coestimulación mediante 4-1BB, mientras que el tratamiento de Yescarta posee una coestimulación mediante la molécula CD28. Aún no se sabe si esta diferencia en el tipo de coestimulación supone un impacto en la eficacia clínica, aunque es posible que se produzcan diferencias en toxicidad.
Este tratamiento complicaciones potencialmente mortales: el síndrome de liberación de citocinas (CRS por sus siglas en inglés) y el síndrome de neurotoxicidad de las células efectoras inmunitarias (ICANS por sus siglas en inglés)4. El CRS es una complicación muy frecuente (alrededor del 80% de los pacientes) relacionada con la expansión in vivo de las células T y la producción de citocinas (sobre todo de IL-6, entre otras) que requiere un tratamiento de soporte hemodinámico y el uso de anticuerpos que bloqueen la IL-6 (es decir, tocilizumab) y/o esteroides.
Aunque la mayoría de los casos se resolvieron, una proporción significativa de los pacientes (hasta el 30%) puede necesitar tratamiento en una unidad de cuidados intensivos.
Una segunda complicación, el síndrome de neurotoxicidad, presenta diferentes grados de encefalopatía, aunque se han producido casos raros de edema cerebral mortal.
Estas complicaciones dieron lugar al desarrollo de unidades altamente multidisciplinarias para el tratamiento de pacientes con CART, constituídas por hematólogos, neurólogos, médicos de medicina intensiva y farmacéuticos lo que implica que esta terapia esté actualmente limitada a hospitales altamente especializados.
El CART-19 es el más utilizado para tumores malignos hematológicos (>200 ensayos clínicos), se están desarrollando cada vez más CAR que se dirigen a otras moléculas. El antígeno de maduración de células B (BCMA) se expresa en la mayoría de las células de mieloma múltiple, y los diferentes CAR que se dirigen a BCMA ya están sometidos a ensayos clínicos. Como ha ocurrido con los resultados de CART-19, los pacientes con mieloma altamente refractario (>3 líneas de tratamiento previo) tuvieron Autor para correspondencia Javier Briones Meijide Servicio de Hematología. Hospital Santa Creu i Sant Pau Mas Casanovas, 90, 08041 Barcelona, España. Correo electrónico: JBriones@santpau.cat 001_11312_Linfocitos T de receptor de antígeno quimérico_ESP.indd 173 3/11/19 19:10 174 Farmacia Hospitalaria 2019l Vol. 43 l Nº 6 l 173 – 174 l Javier Briones-Meijide una tasa de respuesta del 80% con casi la mitad siendo RC5. Tal tasa de respuesta rara vez se observó con otras terapias en grupos de pacientes con características similares.
Además de CART19, se han desarrollado otros CARs para el linfoma de Hodgkin y las neoplasias mieloides malignas. Se ha probado un CAR dirigido a CD30 (expresado en todas las células tumorales de Hodgkin) en dos ensayos clínicos pequeños con un 30% de RC6, y se espera que a finales de este año se inicie un ensayo clínico con un nuevo CART-30 desarrollado por nuestro grupo en Hematología de Sant Pau después de la aprobación por la AEMPS. A diferencia del éxito de CART-19 para el linfoma de células B y B-ALL, los CAR para la leucemia mieloide aguda (LMA) han sido más difíciles de desarrollar, debido a la ausencia de antígenos tumorales verdaderos no expresados en células madre hemopoyéticas normales.
Los CARs para LMA es un área de investigación intensiva para pacientes con LMA refractaria, una situación que representa una verdadera necesidad médica no cubierta. A pesar del éxito clínico obtenido con CART-19 y CART BCMA, actualmente casi el 50% de los pacientes no se benefician de esta terapia, ya sea porque no responden inicialmente o porque recaen. De modo que es evidente el gran margen de mejora que existe, y, al igual que para otras terapias, se espera con interés el conocimiento de los factores predictores de respuesta y de los mecanismos de resistencia a terapia CART. En esta línea, los datos clínicos preliminares muestran que la persistencia in vivo de las células CART puede estar relacionada con una mejor respuesta clínica y la proporción de subtipos particulares de células T (por ejemplo, células T de memoria) en el producto infundido puede estar asociada a la respuesta clínica.
Por esta razón, se está realizando una investigación intensiva sobre los métodos utilizados para la expansión de células T ex vivo que intentan preservar aquellos subtipos de células T de memoria menos diferenciados que pueden mejorar el efecto antitumoral7 . Otras áreas de investigación activa incluyen el desarrollo de los CAR que secretan citocinas que mejoran aún más el efecto citotóxico de las células T y otras células inmunes (IL-12, IL-18), los llamados CAR de cuarta generación o “armados”. Ya se han iniciado ensayos clínicos con estos diseños novedosos para pacientes con neoplasias linfoides malignas y se espera que la tasa de respuesta mejore.
Un concepto novedoso que se está probando recientemente es el uso del CART en sí mismo como plataforma para secretar agentes antitumorales directamente al microambiente tumoral. En este sentido, los CAR pueden diseñarse para incorporar medicamentos en el formato de ADN que, después de la traducción de proteínas, pueden liberarse tras la estimulación con las células tumorales dentro del microambiente, aumentando así su eficacia y minimizando las toxicidades, una idea que dio lugar al concepto de los CAR como “minifarmacias”. Un buen ejemplo de este concepto es el diseño de los CAR con secuencias de ADN que codifican anticuerpos dirigidos a antígenos tumorales o moléculas de control inmunosupresor (p. ejemplo, anti-PD-1) que ya se ha probado en modelos preclínicos8. El éxito de CART-19 para algunas neoplasias hematológicas ha alentado la aplicación de los CART en tumores sólidos. A pesar de haberse desarrollado ensayos clínicos con los CART dirigidos a varios antígenos diferentes en distintos tumores, como el disialogangliósido (GD2), receptor de interleucina 13 α2, mucina-1 y receptor de factor de crecimiento epidérmico humano 2, entre otros, la eficacia fue moderada9 . Se deben superar varios desafíos, como el tráfico eficiente de células CART a tumores y la inhibición de la inmunosupresión inducida por las céluals cancerígenas para que esta terapia actúe correctamente en tumores sólidos. La terapia CART no solo ha traído una nueva forma de terapia al campo de la oncohematología, sino que también implica una forma diferente de organización. La logística requerida para proporcionar esta terapia es compleja e involucra no solo a equipos de atención clínica multidisciplinarios sino también a las unidades de aféresis y servicios de farmacia hospitalaria. Los bancos de sangre y las unidades de aféresis participan en fases críticas del proceso de producción, como la obtención de células T para la producción de los CART, la criopreservación y el envío al fabricante, así como la recepción del producto CART criopreservado hasta la infusión al paciente.
Todos estos procedimientos deben implementarse con los más altos estándares de calidad, ya que en última instancia pueden afectar el rendimiento del producto. La farmacia hospitalaria tiene un papel muy importante en la coordinación de todo el proceso. El farmacéutico desempeña un papel fundamental al proporcionar acceso a todos los medicamentos necesarios para el tratamiento de las complicaciones de los CART, algunos de ellos de nueva indicación (como tocilizumab), además de crear protocolos para la entrega urgente de estos medicamentos en cualquier momento. Por otro lado, dado que las células CART son medicamentos, el farmacéutico debe garantizar la trazabilidad y la validación de las células hasta el momento de la administración, lo que puede representar una nueva tarea dentro de sus responsabilidades. A este respecto, la amplia experiencia adquirida por los departamentos de hematología y banco de sangre con células para trasplante hematopoyético debería servir como una buena plataforma para introducir la farmacia del hospital en este “nuevo mundo” de la terapia celular.
Como añadido personal, esta técnica que parece de fabula, tiene la dificultad, que el antígeno que hay que añadir al lifocito, tienen que ser especifico para la vida del tumor. Lo cual confiere una dificultad en la búsqueda. Y el riesgo que este antígeno, sea comatiple con la biología de células normales.
Las pruebas que se hacen para bloquear el reparador de ADN de las células tumorales sometidas a quimioterapia o radiaciones en algunos tumires solidos, están tienendo cierta fortuna.
Parece una terapia ingeniosa, pero ariesgada
Bibliografía
1. June CH, Sadelain M. Chimeric Antigen Receptor Therapy. N Engl J Med. 2018;379(1):64-73. 2. Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, et al.; JULIET Investigators. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019;380(1):45-56. 3. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018;378(5):439-48. 4. Lee DW, Santomasso BD, Locke FL, Ghobadi A, Turtle CJ, Brudno JN, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant. 2019;25(4):625-38. 5. Raje N, Berdeja J, Lin Y, Siegel D, Jagannath S, Madduri D. Anti-BCMA CAR TCell Therapy bb2121 in Relapsed or Refractory Multiple Myeloma. N Engl J Med. 2019;380(18):1726-37. 6. Grover NS, Savoldo B. Challenges of driving CD30-directed CAR-T cells to the clinic. BMC Cancer. 2019;19(1):20. 7. Alvarez-Fernández C, Escribà-Garcia L, Vidal S, Sierra J, Briones J. A short CD3/ CD28 costimulation combined with IL-21 enhance the generation of human memory stem T cells for adoptive immunotherapy. J Transl Med. 2016;14(1):214. 8. Rafiq S, Yeku OO, Jackson HJ, Purdon TJ, van Leeuwen DG, Drakes DJ, et al. Targeted delivery of a PD-1-blocking scFv by CAR-T cells enhances anti-tumor efficacy in vivo. Nat Biotechnol. 2018;36(9):847-56. 9. Castellarin M, Watanabe K, June CH, Kloss CC, Posey