«Después de secuenciar más de 100.000 tumores ya conocemos todos los genes implicados en cáncer»
Mi amigo el Dr Antonio Ballesta es sin duda un líder organizando congresos o similares. Tiene un alto cargo en “analizA” y he teido la suerte de asistir a alguno.
Antonio, es sencillo, andaluz y catalán y madrileño y de todas partes, buen amigo y un investigador y gestor “DE CHUPA DE DOMINE”.
El articulo sobre Mariano Barbacid, es absolutamente explicativo de los éxitos sobre el Cancer, esa maldita enfermedad que tanto hace sufrir y a la que se le está cogiendo el “tranquillo”, y convirtiéndola por lo menos en una “enfermedad crónica” y esperamos que aumente su conocimienrto y eficacia en su tratamiento
Y la razón es imprecindible siempre “buscar los orígenes”, y el próximo paso será evitar la polucion que seguramente es el principal de sus desencadenantes.
Tiene poco sentido que yo copie la publicación de Mariano Barbacid, pero me gusta hacerlo y creo que el merece que se divulguen sus conocimientos.

..Pablo Malo Segura.
En las dos décadas que llevamos de siglo XXI se ha producido una auténtica revolución en las terapias que hoy día se aplican al cáncer. Hay tres grandes avances: medicina de precisión, inmunoterapia e inmunoterapia celular (CAR-T cells). Los inicios de la medicina de precisión se remontan a 1998, cuando se aprobó Herceptina, un anticuerpo monoclonal dirigido contra el receptor HER2. «Desde entonces se ha avanzado muchísimo, sobre todo, gracias a la ultrasecuenciación. Hoy en día podemos decir que después de secuenciar más de 100.000 tumores ya conocemos todos los genes implicados en cáncer, tanto oncogenes como genes supresores». Así lo ha señalado el Dr. Mariano Barbacid, profesor AXA-CNIO de oncología molecular del Centro Nacional de Investigaciones Oncológicas (CNIO), durante las IV Jornadas Científicas de Biomedicina, organizadas por Analiza.

Para el bioquímico este es un gran avance, pero a su vez es un reto importante. «Por el momento casi todos los fármacos de los que disponemos son inhibidores de quinasa, inhibidores enzimáticos, y hay un gran porcentaje de genes mutados en cáncer que todavía la ciencia no sabe cómo inhibirlos». Según ha explicado, la medicina de precisión consiste en el desarrollo de fármacos selectivos contra aquellas proteínas producidas por los genes mutados en cada tipo tumoral, independientemente del órgano de origen o las características del tumor.
«Uno de los grandes retos de la medicina personalizada es que conocer el gen no es suficiente para desarrollar un fármaco», ha precisado. Además, ha identificado otros dos grandes retos. «El primero, que la gran mayoría de los genes de cáncer no sabemos cómo inhibirlos sino son enzimas. El segundo, son las resistencias que aparecen antes de un año». Por otro lado, el Dr. Barbacid resaltó la importancia de agilizar los ensayos clínicos y recordó que «el cáncer lo producen nuestras propias proteínas».
Medicina de precisión y estratificación molecular de los tumores
El Dr. Barbacid ha destacado que para que la medicina de precisión sea aplicable y efectiva, además de la clasificación anatomopatológica de los tumores es necesario un diagnóstico molecular que permita identificar los genes mutados y realizar una estratificación de los tumores de acuerdo a este diagnóstico. «Hoy en día es absolutamente esencial que los hospitales implementen análisis moleculares que identifiquen la presencia de genes mutados, siempre y cuando para estos genes ya existan fármacos efectivos». En este sentido, ha indicado que el que te detecten un oncogen de la familia NTRK puede salvarte la vida. «El fármaco que te van a dar va a ser muchísimo más eficaz que si te dan una quimioterapia o algún otro fármaco».
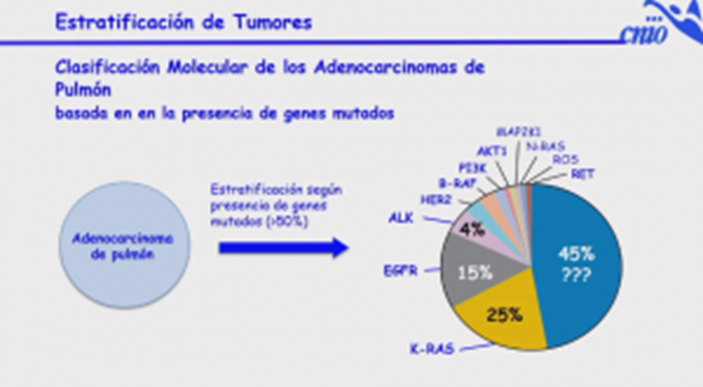
«
El cáncer de pulmón es donde la medicina personalizada ha tenido un impacto mayor». En concreto, donde más se ha avanzado es el adenocarcinoma. En más de la mitad de ellos se conoce el gen iniciador y para la mayoría ya existen inhibidores. «Un inhibidor solo se convierte en fármaco cuando lo aprueba la FDA», ha recordado. KRAS es uno de los oncogenes más frecuentes dentro de los adenocarcinosmas y es uno de los más malignos. El primer inhibidor de KRAS, sotorasib, se ha aprobado en 2021, pero solo es efectivo en la mutación KRASG12C (frecuente en fumadores).
Los tumores agnósticos son aquellos cuyo tratamiento sigue determinado por la presencia de un gen mutado en lugar de por sus características anatomopatológicas o clínicas. «En las últimas dos décadas con la llegada de la ultrasecuenciación masiva se han identificado nuevos oncogenes NTRK, muy frecuentes en tumores raros ya sean pediátricos o de adultos», ha manifestado.
Implementación de la medicina de precisión en la medicina molecular
El Dr. Santiago Ramón y Cajal, jefe del servicio de anatomía patológica del Hospital Universitario Vall d’Hebron y catedrático de anatomía patológica de la Universidad Autónoma de Barcelona, ha destacado que tras la implementación de la medicina de precisión ha habido un «espectacular cambio en el pronóstico y mortalidad de los pacientes con cáncer».
El Dr. Ramón y Cajal ha asegurado que la medicina de precisión debe basarse en tres pilares: un diagnóstico anatomopatológico correcto, un estadiaje del tumor y la búsqueda de biomarcadores asociados al mismo con el fin de realizar una terapia dirigida. «En metástasis estamos avanzando lentamente y hacen falta cambios de paradigma». Según ha señalado, los motivos de que el pronóstico de la metástasis sea tan malo son la heterogeneidad intertumoral e intratumoral.
En cuanto al diagnóstico anatomopatológico es indispensable un control de calidad para disminuir el grado de discordancias, que es elevado (20%). Algunas de las razones son la falta de conocimiento y especialización de los patólogos y el déficit de estudios moleculares. «Para mejorar el día a día en diagnóstico molecular es muy importante intentar concentrar el análisis patológico clásico en centros de referencia». En definitiva, el Dr. Ramón y Cajal ha abogado por trabajar en redes y nodos moleculares. «En primer lugar, habría que digitalizar las imágenes patológicas e incrementar la telepatología y los pátologos de referencia. En segundo, implementar una tecnología NGS que permita diagnosticar múltiples alteraciones moleculares, dianas terapéuticas y factores de resistencia».
Existen 17 tipos tumorales diferentes que pueden presentar una mutación en el gen NTRK. Actualmente, hay una serie de fármacos aprobados que pueden ser utilizados para atacarlos. Asimismo, el Dr. Díaz Rubio ha recalcado la importancia de disponer de «biomarcadores que sean de tipo predictivo» para conocer si el tumor puede responder a una diana terapéutica. En este sentido, ha subrayado la importancia de utilizar la tecnología para que todos los pacientes tengan las mismas oportunidades de acceso. «En oncología se financia el fármaco, pero no se financia el biomarcador», ha lamentado. De hecho, para tener biomarcadores tienen que conseguir convenios con la industria farmacéutica al no haber una financiación específica.
La inmunoterapia es un hito que abre una nueva etapa en el tratamiento contra el cáncer. «Tenemos un sistema inmunológico suficientemente potente como para destruir los tumores. No necesitaríamos fármacos si ese sistema inmunológico estuviera activado y reconociera claramente a las células tumorales», ha enfatizado el catedrático. Según ha precisado, la inmunoterapia tiene un beneficio consistente en muchos tumores, pero no responden a ella todos los pacientes. «Tenemos que trabajar con biomarcadores que nos digan cuales son los pacientes que se van a beneficiar».
Finalmente, ha enumerado algunos de los grandes retos que existen en inmunoterapia: estudiar la expresión de PDL-1, la carga mutacional, si hay inestabilidad de microsatélite, si hay alteración en los genes repadores del DNA, firmas genómicas, la infiltración por células TILs, utilizar dos marcadores en lugar de uno, la resistencia, y la posibilidad de hacer marcadores en biopsia líquida. «La medicina multidisciplinaria es el avance más importante que hemos hecho en oncología», ha destacado.
Esto alienta al medico y sobre todo al enfermo y anima a seguir en la línea de que a la pratica de la medicina se una imprescindiblemente la investigación y además buscar el origen.
¿Por qué tantas enfermedades degenerativas incluyendo al cancer.
Porque han crecido tanto estas enfermedades desde la revolución industrial.
Tanta miasma, que nos bombardean tienen que ver con los hechos, pero como combatirlas.
Limitar la polucion es factible, pero dudo de la eficacia necesaria. Hace falta enseñar al organismo utilizar su gran capacidad * Nuestro sistema inmunológico es suficientemente potente como para destruir los tumores*
Que Dios reparta suerte, dicen los toreros cuando salen a la plaza