LA TERAPIA CART EN LA FIBROSIS ENDOMIOCÁRDICA
La inmunoterapia se está relevando como extraordinaria, por su efectividad y porque cada dia tiene mas aplicaciones.
La fibrosis endomiocárdica, es una infrecuente inflamación del endocardio (endocarditis) caracterizada por un engrosamiento fibrótico de porciones del corazón, en especial el ápice del y una o ambas válvulas cardíacas que separan las aurículas de los ventrículos.1
Por ello, es una miocardiopatía restrictiva y una de las formas del síndrome hipereosinofílico. Ocasionalmente, puede asociarse con trombos y depósitos de calcio sobre la pared ventricular. Tiene una notoria predisposición geográfica por el África ecuatorial, aunque se han descrito con cierta frecuencia en climas tropicales, incluyendo Suramérica.2.
Este trabajo demuestra que las células fibróticas del corazón pueden ser destruidas y favorecer su reparación.
Un trabajo en ratones señala que el uso de células modificadas puede reducirlas.
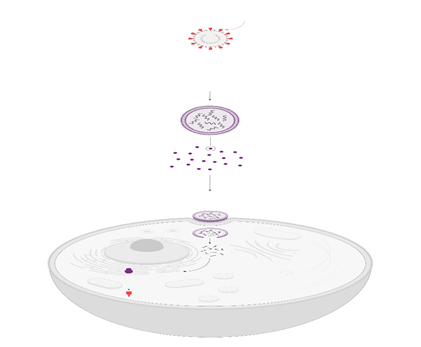
Una nueva estrategia de inmunoterapia que emplea la terapia CART, a través de la administración de ARNm modificado, puede reducir la fibrosis y restaurar la función cardiaca en un modelo de ratón de insuficiencia cardíaca, informan los investigadores. 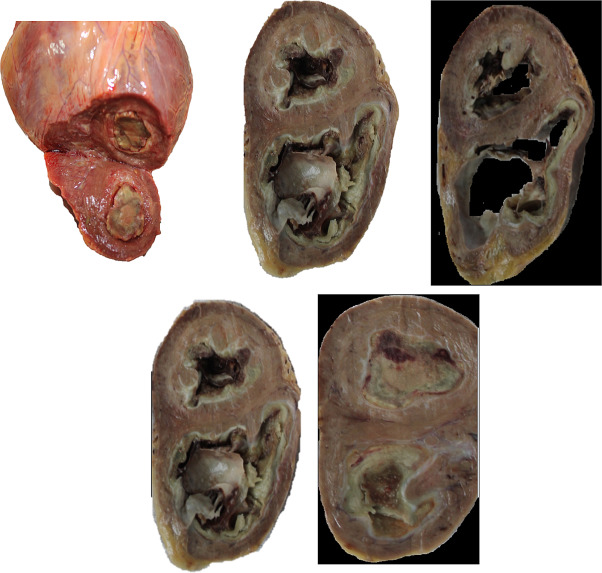
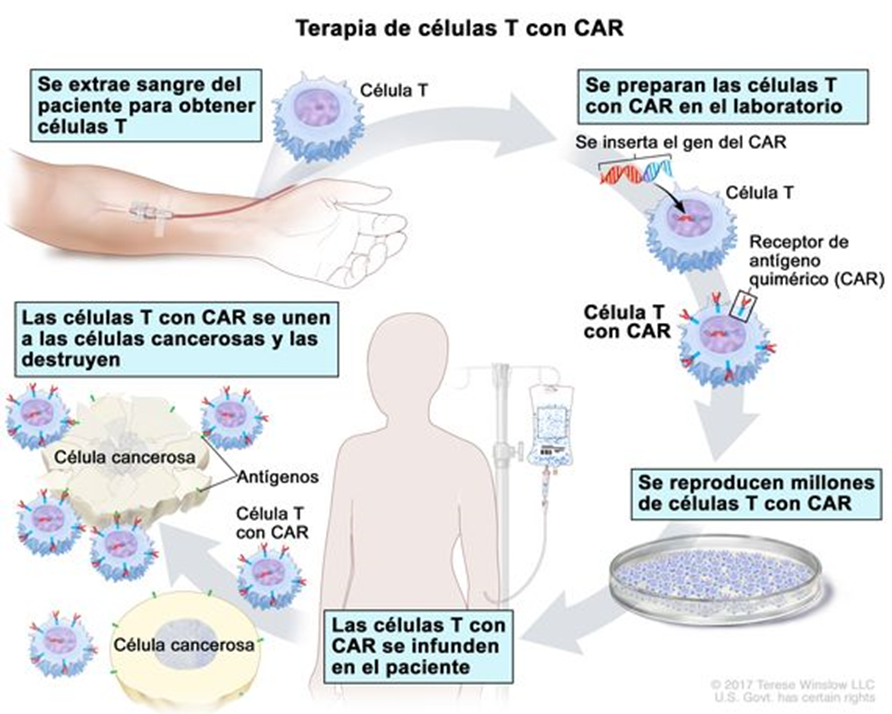
Las células T son obtenidas de la sangre del paciente y se alteran en el laboratorio al añadirles un gen con un receptor sintético (llamado receptor quimérico de antígenos o CAR). Esto les ayuda a identificar mejor a unos antígenos específicos de las células cancerosas. Luego, las células CAR-T son de nuevo inyectadas al paciente Los hallazgos, publicado en la revista “Science”, muestran que el enfoque podría ser útil como una plataforma terapéutica personalizada para tratar varias otras enfermedades fibróticas o trastornos asociados.
El sistema inmunitario mantiene un registro de todas las sustancias que normalmente se encuentran en el cuerpo. Cualquier sustancia nueva que el sistema inmunitario no reconozca provoca una alarma, causando que el sistema la ataque.
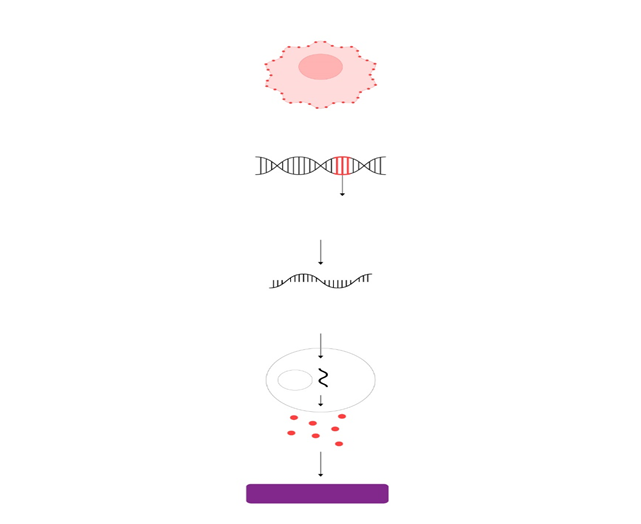
La terapia de células T con receptores quiméricos de antígenos (CAR-T) es una manera de hacer que las células inmunitarias llamadas células T (un tipo de glóbulos blancos) luchen contra el cáncer al alterarlas en el laboratorio para que puedan encontrar y destruir a las células cancerosas. La terapia de células CAR-T de tal forma que la terapia génica celular es capaz de alterar los genes dentro de las células T para ayudar a combatir el cáncer.
Este tipo de tratamiento puede ser muy útil en el tratamiento de algunos tipos de cáncer, incluso cuando otros tratamientos dejen de surtir efecto.
El sistema inmunitario reconoce sustancias extrañas en el cuerpo mediante la búsqueda de proteínas llamadas antígenos en la superficie de esas células. Las células inmunitarias llamadas células T tienen sus propias proteínas llamadas receptores que se unen a antígenos extraños y ayudan a provocar que otras partes del sistema inmunitario destruyan a la sustancia extraña.
La relación entre los antígenos y los receptores inmunes es como una cerradura y una llave. Al igual que una cerradura solo se puede abrir con la llave correcta, cada antígeno extraño tiene un receptor inmune único que puede unirse a él.
Las células cancerosas también tienen antígenos, pero si las células inmunitarias no tienen los receptores adecuados, no pueden adherirse a los antígenos y ayudar a destruir a las células cancerosas.
Dado que los diferentes tipos de cáncer tienen distintos antígenos, cada CAR está hecho para el antígeno específico de un cáncer. Por ejemplo, en ciertos tipos de leucemia o linfoma, las células cancerosas contienen un antígeno en el exterior de las células cancerosas llamado CD19. Las terapias de células CAR-T para tratar estos cánceres están diseñadas para adherirse al antígeno CD-19 y no funcionarán contra un cáncer que no contenga el antígeno CD19.
El proceso para la terapia de células CAR-T puede tomar varias semanas esto es un problema de tiempo y de dinero.
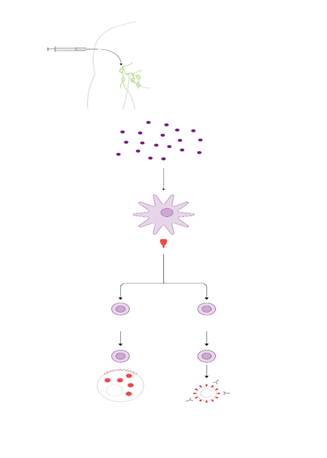
Recolección de las células T, en primer lugar, los glóbulos blancos (que incluyen las células T) se extraen de la sangre del paciente mediante un procedimiento llamado leucoféresis. Durante este procedimiento, los pacientes generalmente se acuestan en una cama o se sientan en un sillón reclinable. Se requiere de dos líneas intravenosas debido a que la sangre es extraída por una de ellas para así separar los glóbulos blancos y luego retornar la sangre al cuerpo a través de la otra línea. A veces un tipo especial de línea intravenosa llamada catéter venoso central es usado el cual tiene ambas líneas intravenosas incorporadas.
El paciente tendrá que permanecer sentado o recostado durante 2 a 3 horas durante el procedimiento. A veces, los niveles de calcio en la sangre pueden disminuir durante la leucoféresis, lo que puede causar entumecimiento y hormigueo o espasmos musculares. Esto se puede tratar fácilmente al reponer el calcio, el cual se puede administrar por vía oral o a través de una vía intravenosa.
Después de extraer los glóbulos blancos, las células T se separan, se envían al laboratorio y se alteran agregando el receptor quimérico de antígenos (CAR). Esto las convierte en células CAR-T. Estas células luego son producidas y multiplicadas en el laboratorio. Puede que tome varias semanas reproducir el gran número de células CAR-T necesarias para esta terapia.
Una vez que se han producido suficientes células CAR-T, se devolverán al paciente . Unos días antes de la infusión de células CAR-T, el paciente podría recibir quimioterapia para ayudar a reducir el número de otras células inmunitarias. Esto da a las células CAR-T una mejor oportunidad de activarse para combatir el cáncer. Esta quimioterapia generalmente no es muy potente porque las células CAR-T funcionan mejor cuando hay algunas células cancerosas que puedan atacar. Una vez que las células CAR-T comienzan a unirse a las células cancerosas, empiezan a aumentar en número y pueden ayudar a combatir aún más células cancerosas.
Las terapias de células CAR-T han sido aprobadas para el tratamiento contra ciertos linfomas y leucemias, así como del mieloma múltiple. La terapia de células CAR-T por lo general se usa después de haber intentado otros tratamientos.
Entre las terapias de células CAR-T aprobadas se incluye:
Tisagenlecleucel, que también se conoce como tisa-cel (Kymriah)
Axicabtagene ciloleucel, que también se conoce como axi-cel (Yescarta)
Brexucabtagene autoleucel, que también se conoce como brexu-cel (Tecartus)
Lisocabtagene maraleucel, que también se conoce como liso-cel (Breyanzi)
Idecabtagene vicleucel, que también se conoce como ide-cel (Abecma)
Muchas otras terapias de células CAR-T (y tipos de tratamiento similares) están actualmente siendo analizados en estudios clínicos con la expectativa de usarse en el tratamiento de otros tipos de cáncer.
La fibrosis cardíaca, la rigidez y la cicatrización del tejido cardíaco después de una lesión, es un sello distintivo de la enfermedad cardíaca y desempeña un papel crítico en la insuficiencia cardíaca y la muerte de millones de personas en todo el mundo. Sin embargo, las terapias dirigidas a la fibrosis cardíaca siguen siendo limitadas y solo demuestran un efecto positivo modesto en el mejor de los casos.
Basándose en investigaciones anteriores que demostraron el uso de células CAR-T para eliminar fibroblastos activados como terapia para la insuficiencia cardíaca, Joel Rurik y su quipo desarrollaron un nuevo enfoque, que aprovecha la generación in vivo de células T CAR transitorias diseñadas que reconocen selectivamente y se dirigen a las células fibróticas en el corazón. Para hacer esto, los investigadores entregaron ARNm modificado en nanopartículas lipídicas dirigidas a células T en un modelo de ratón de insuficiencia cardíaca, que reprogramó los linfocitos T y facilitó la generación de células T CAR terapéuticas completamente dentro del cuerpo.
Los autores encontraron que el enfoque de tratamiento redujo con éxito la fibrosis y restauró la función cardíaca después de la lesión. “Este trabajo representa un paso emocionante hacia la traducción de inmunoterapias personalizadas en productos de células T diseñados ‘listos para usar’ accesibles y asequibles”.
La terapia CART se emplea en la actualidad con gran éxito para determinados cánceres sanguíneos en los que han fracasado todos los tratamientos disponible.
Bibliografia.
REFERENCIAS
1. Treon, S.P., Castillo, J.J., Skarbnik, A.P., et al. (2020). El inhibidor de BTK ibrutinib puede proteger contra la lesión pulmonar en pacientes infectados por COVID-19. Blood, 135 (21), 1912-1915.
2. Bucktrout, S.L., Bluestone, J.A., Ramsdell, F.R. (2018). Avances recientes en inmunoterapias: desde la infección y la autoinmunidad hasta el cáncer y viceversa. Medicina del genoma 10 (1), 79. 3. Ortega-Prieto, A.M., Marcus Dorner, M. (2017). Estrategias de evasión inmunológica durante la infección crónica por el virus de la hepatitis B y C. Vacunas 5 (3), 24.
4. Ye, B., Liu, X., Li, REFERENCES 1. Treon, S.P., Castillo, J.J., Skarbnik, A.P., et al. (2020). The BTK inhibitor ibrutinib may protect against pulmonary injury in COVID-19–infected patients. Blood, 135(21), 1912–1915.
5. Fanning, G.C., Zoulim, F., Hou, J., Bertoletti A. (2019). Therapeutic strategies for hepatitis B virus infection: towards a cure. Nat. Rev. Drug. Discov. 18(11), 827–844.
6. Ramamurthy, D., Nundalall, T., Cingo, S. et al. (2021). Recent advances in immunotherapies. Immunotherapy Advances. 1(1), 1–16
7. Tanaka, A., Sakaguchi, S. (2019). Targeting Treg cells in cancer immunotherapy. Eur. J. Immunol. 49(8), 1140–1146.
8. Cortez, J.T., Montauti, E., Shifrut, E. et al. (2020). CRISPR screen in regulatory T cells reveals modulators of Foxp3. Nature. 582, 416–420.
9. Hultquist, J.F., Hiatt, J., Schumann, K. et al. (2019). CRISPR-Cas9 genome engineering of primary CD4+ T cells for the interrogation of HIV-host factor interactions. Nat. Protoc. 14(1), 1-27.
10. Torahito Gao e Yvonne Chen. L. Mannelli, V. Cherian, A. Nayar, M. Srichai-Parsia
Loeffler’s endocarditis in hypereosinophilic syndrome
Curr Probl Diagn Radiol., 41 (2012), pp. 146-148
ArticleDownload PDFView Record in ScopusGoogle Scholar
12 P.E. Séguéla, X. Iriart, P. Acar, M. Montaudon, R. Roudaut, J.B. Thambo
Eosinophilic cardiac disease: Molecular, clinical and imaging aspects
Arch Cardiovasc Dis., 108 (2015), pp. 258-268
ArticleDownload PDFView Record in ScopusGoogle Scholar
13 A.C. Barretto, P.L. da Luz, S.A. de Oliveira, N.A. Stolf, C. Mady, G. Bellotti, et al.
Determinants of survival in endomyocardial fibrosis Circulation, 80 (3 pt 1) (1989), pp. I177-I182 Google Scholar
14 V. Salemi, C.E. Rochitte, A.A. Shiozaki, J.M. Andrade, J.A. Parga, L.F. Avila, et al.
Late Gadolinium Enhancement Magnetic Resonance Imaging in the Diagnosis and Prognosis of Endomyocardial Fibrosis Patients Circ Cardiovasc Imaging., 4 (2011), pp. 304-311 View PDF View Record in ScopusGoogle Scholar
15 U. Schneider, R. Jenni, J. Turina, M. Turina, O.M. Hess Long term follow up of patients with endomyocardial fibrosis: effects of surgery Heart., 79 (1998), pp. 362-367 View PDF CrossRefView Record in ScopusGoogle Scholar
16 I. Dato How to recognize endomyocardial fibrosis?J Cardiovasc Med, 16 (2015), pp. 547-551View Record in ScopusGoogle Scholar





 Anticuerpos biespecíficos
Anticuerpos biespecíficos DescripciónReconoce un antígenoReconoce dos antígenosObjetivo (antígeno)Marcadores de activaciónMarcadores inhibidores de las células inmunesLigandos inhibidores en células tumoralesAntígenos asociados a tumores (TAA)Receptor activador en células inmunes y TAADos puestos de control inmunesFunciónAgotamiento de células de leucemia y linfoma (ex Rituximab)Iniciar citotoxicidad mediada por células dependiente de anticuerpos (ADCC)Bloqueo de puntos de control inmunológicoRedirección citotóxica: acerque las células inmunitarias y las células diana para facilitar la opsonización o la muerte celular.Co-bloqueo de puntos de control inmunológico: bloquea simultáneamente dos objetivos de puntos de control inmunitariosNota: Puede encontrar más información sobre los ADC en el
DescripciónReconoce un antígenoReconoce dos antígenosObjetivo (antígeno)Marcadores de activaciónMarcadores inhibidores de las células inmunesLigandos inhibidores en células tumoralesAntígenos asociados a tumores (TAA)Receptor activador en células inmunes y TAADos puestos de control inmunesFunciónAgotamiento de células de leucemia y linfoma (ex Rituximab)Iniciar citotoxicidad mediada por células dependiente de anticuerpos (ADCC)Bloqueo de puntos de control inmunológicoRedirección citotóxica: acerque las células inmunitarias y las células diana para facilitar la opsonización o la muerte celular.Co-bloqueo de puntos de control inmunológico: bloquea simultáneamente dos objetivos de puntos de control inmunitariosNota: Puede encontrar más información sobre los ADC en el 
 Datos de ELISA funcional que muestran un bloqueo exitoso de la interacción receptor-ligando con el anticuerpo bloqueador del receptor. La línea naranja muestra que el ligando recombinante se une al receptor de manera dependiente de la dosis, en ausencia del anticuerpo. (Izquierda) A 0.09-0.72 µg / mL,
Datos de ELISA funcional que muestran un bloqueo exitoso de la interacción receptor-ligando con el anticuerpo bloqueador del receptor. La línea naranja muestra que el ligando recombinante se une al receptor de manera dependiente de la dosis, en ausencia del anticuerpo. (Izquierda) A 0.09-0.72 µg / mL,  PD-L1 es un objetivo clínico para el bloqueo de puntos de control inmunológico. Anticuerpo anti-PD-L1 altamente validado con reactividad cruzada en tejidos humanos, de ratón y de rata. ICC / IF de la línea celular U-251 de glioblastoma maligno. Las células se fijaron en paraformaldehído al 4% durante 10 minutos y se permeabilizaron en Triton X-100 al 0,05% en PBS durante 5 minutos. Las células se incubaron con
PD-L1 es un objetivo clínico para el bloqueo de puntos de control inmunológico. Anticuerpo anti-PD-L1 altamente validado con reactividad cruzada en tejidos humanos, de ratón y de rata. ICC / IF de la línea celular U-251 de glioblastoma maligno. Las células se fijaron en paraformaldehído al 4% durante 10 minutos y se permeabilizaron en Triton X-100 al 0,05% en PBS durante 5 minutos. Las células se incubaron con  Bloqueo / neutralización de HHLA-2 en un ensayo de citometría de flujo funcional. Brevemente, la línea celular de riñón embrionario humano HEK293 se transfectó con B7-H7 / HHLA-2
Bloqueo / neutralización de HHLA-2 en un ensayo de citometría de flujo funcional. Brevemente, la línea celular de riñón embrionario humano HEK293 se transfectó con B7-H7 / HHLA-2 
 La expresión de HLA-G contribuye a la función inmunomoduladora de los queratinocitos humanos. Expresión de superficie de HLA-G determinada por citometría de flujo de queratinocitos humanos teñidos con
La expresión de HLA-G contribuye a la función inmunomoduladora de los queratinocitos humanos. Expresión de superficie de HLA-G determinada por citometría de flujo de queratinocitos humanos teñidos con  Receptor inhibidor de LAG-3 expresado en la superficie de células T estimuladas. Las células mononucleares de sangre periférica humana (PBMC) no se trataron (panel inferior) o se trataron con 5 μg / ml de PHA (panel superior). Las PBMC se tiñeron con
Receptor inhibidor de LAG-3 expresado en la superficie de células T estimuladas. Las células mononucleares de sangre periférica humana (PBMC) no se trataron (panel inferior) o se trataron con 5 μg / ml de PHA (panel superior). Las PBMC se tiñeron con  ScFv
ScFv EstructuraCadena pesada completa (Hc) y cadena ligera (Lc) de dos anticuerpos monoclonalesFragmentos de unión a antígeno de longitud completa (F (ab)) de dos anticuerpos monoclonales, ligados químicamenteFragmentos variables de cadena única (scFv) de la cadena pesada y ligera de dos anticuerpos monoclonalesFunciónSe une a dos antígenos y la región constante (Fc) puede activar receptores Fc (FcR) en DC, macrófagos y células NKBifuncional: une dos antígenos sin dominio Fc funcionalBifuncional: une dos antígenos sin dominio Fc funcionalVentajasPuede activar FcR para una funcionalidad adicional:ADCCFagocitosisTalla pequeñaBaja inmunogenicidadAgregar funcionalidad en las regiones del vinculadorTalla pequeñaBaja inmunogenicidadPuede diseñarse fácilmente para ser tri-específicoAgregar funcionalidad en las regiones del vinculadorEl azul y el verde representan dos especificidades antigénicas diferentes. Sólo se muestra un ejemplo de estructuras de fragmentos F (ab) 2 y ScFv.
EstructuraCadena pesada completa (Hc) y cadena ligera (Lc) de dos anticuerpos monoclonalesFragmentos de unión a antígeno de longitud completa (F (ab)) de dos anticuerpos monoclonales, ligados químicamenteFragmentos variables de cadena única (scFv) de la cadena pesada y ligera de dos anticuerpos monoclonalesFunciónSe une a dos antígenos y la región constante (Fc) puede activar receptores Fc (FcR) en DC, macrófagos y células NKBifuncional: une dos antígenos sin dominio Fc funcionalBifuncional: une dos antígenos sin dominio Fc funcionalVentajasPuede activar FcR para una funcionalidad adicional:ADCCFagocitosisTalla pequeñaBaja inmunogenicidadAgregar funcionalidad en las regiones del vinculadorTalla pequeñaBaja inmunogenicidadPuede diseñarse fácilmente para ser tri-específicoAgregar funcionalidad en las regiones del vinculadorEl azul y el verde representan dos especificidades antigénicas diferentes. Sólo se muestra un ejemplo de estructuras de fragmentos F (ab) 2 y ScFv. Los anticuerpos biespecíficos para redirigir las células citotóxicas son de gran interés para la inmunoterapia del cáncer. El objetivo principal de este tipo de inmunoterapia es acercar la célula citotóxica, ya sea célula T o célula NK, a la célula tumoral para facilitar su destrucción. Idealmente, el anticuerpo biespecífico está diseñado para activar la célula citotóxica a través de
Los anticuerpos biespecíficos para redirigir las células citotóxicas son de gran interés para la inmunoterapia del cáncer. El objetivo principal de este tipo de inmunoterapia es acercar la célula citotóxica, ya sea célula T o célula NK, a la célula tumoral para facilitar su destrucción. Idealmente, el anticuerpo biespecífico está diseñado para activar la célula citotóxica a través de  La expresión de VEGFR1 / Flt-1 se limita a las células cancerosas y no se expresa en las células del estroma tumoral. Análisis IHC-Parafina (IHC-P) de una sección de tejido de carcinoma de mama humano embebido en parafina (FFPE) fijada con formalina usando una dilución 1: 500 de
La expresión de VEGFR1 / Flt-1 se limita a las células cancerosas y no se expresa en las células del estroma tumoral. Análisis IHC-Parafina (IHC-P) de una sección de tejido de carcinoma de mama humano embebido en parafina (FFPE) fijada con formalina usando una dilución 1: 500 de  Los anticuerpos Bio-Techne están validados para una variedad de aplicaciones, incluido ICC / IF. Análisis inmunofluorescente confocal de la línea celular de cáncer de ovario SK-OV-3 usando
Los anticuerpos Bio-Techne están validados para una variedad de aplicaciones, incluido ICC / IF. Análisis inmunofluorescente confocal de la línea celular de cáncer de ovario SK-OV-3 usando  CD16 se expresa en la superficie de las células NK humanas. Se tiñeron células mononucleares de sangre periférica humana (PBMC) con
CD16 se expresa en la superficie de las células NK humanas. Se tiñeron células mononucleares de sangre periférica humana (PBMC) con