Terapia de células T con CAR es un tratamiento que cambia las células T (un tipo de célula inmunitaria) de un paciente en el laboratorio a fin de que se unan a las células cancerosas y las destruyan.
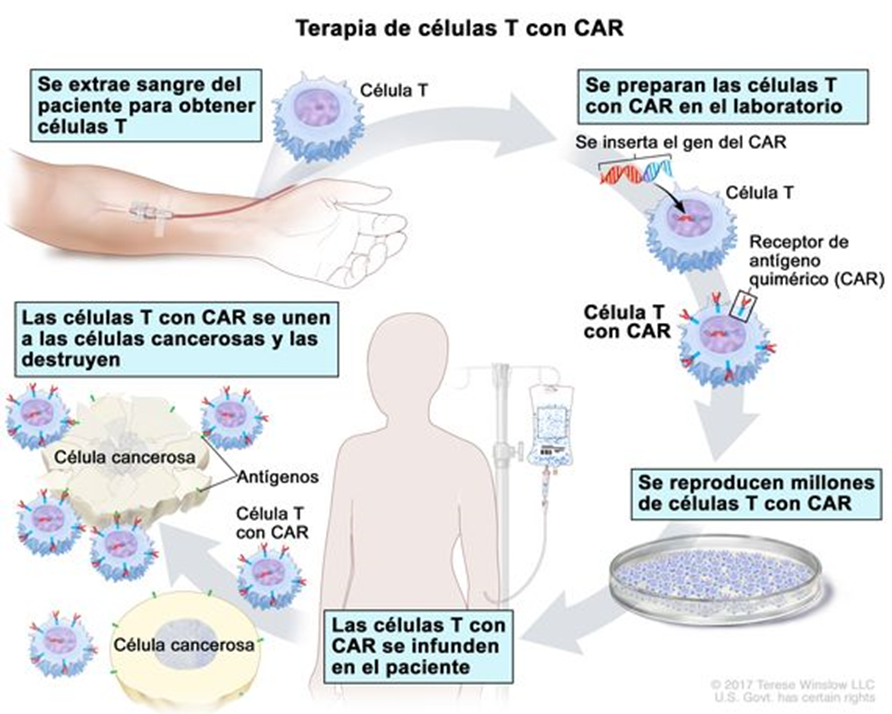
las células T (tipo de célula del sistema inmunitario) del paciente se modifican en el laboratorio para que ataquen a las células cancerosas. Las células T se extraen de la sangre del paciente, y en el laboratorio, se les añade el gen de un receptor especial que se une a cierta proteína de las células cancerosas del paciente. Este receptor especial se llama receptor de antígeno quimérico (CAR). En el laboratorio se producen grandes cantidades de células T con CAR y se administran al paciente mediante infusión. La terapia de células T con CAR se usa para el tratamiento de ciertos cánceres de la sangre, y está en estudio para el tratamiento de otros tipos de cáncer. También se llama terapia CAR-T, terapia celular CAR-T, terapia con células CAR-T, terapia de células T con receptor de antígeno quimérico, terapia de linfocitos T con CAR y tratamiento con linfocitos T-CAR.
La sangre de una vena del brazo del paciente pasa por un tubo hasta una máquina de aféresis (no se muestra) que extrae los glóbulos blancos, incluso las células T, y devuelve el resto de la sangre al paciente. Luego, en el laboratorio, se inserta en estas células T el gen que produce un receptor especial, que se llama receptor de antígeno quimérico (CAR). Se reproducen millones de células T con CAR en el laboratorio y después el paciente las recibe mediante infusión. Las células T con CAR se unen a un antígeno d

Zaida y Silvia son dos personas que han vivido en primera persona lo que supone contar con tratamientos avanzados como la terapia CAR-T.
Conocer la experiencia de la terapia de primera mano es una gran ayuda.
Estaba en el hospital recibiendo uno de los seis ciclos de quimioterapia por un linfoma B difuso de células grandes que le acababan de encontrar.
Entonces escuchó a algunos pacientes y a sus familiares que “venían del TAMO” referirse a una nueva terapia “muy prometedora”; comentaban que se asociaba a una buena expectativa de curación.
“Llevaba un tiempo sintiéndome muy cansada que achacaba al ritmo del trabajo y de la casa-, pero también me levantaba con la cara muy hinchada (luego se me pasaba), me dolía la espalda y a veces me costaba respirar”.
En Urgencias, los médicos constataron en una radiografía la presencia de una masa de 13×10 centímetros (“como una patata”) en el mediastino. “Me dijeron que tenía que quedar ingresada. En ese momento no me asusté, creo que no era consciente de lo que estaba pasando”.
El tratamiento inicial consistió en quimioterapia. “Mi primera pregunta fue si se me caería el pelo. No es que me importara mucho, pero casi lo pregunté por un acto reflejo, porque me encontraba en shock”. En realidad, reconoce Silvia, casi pensaba más en cómo iba a explicarle a su hija que tenía que pasar su tercer cumpleaños en el hospital.
La quimioterapia se administró a largo de seis ciclos, que recibía durante unas 24 horas en el hospital; luego descansaba en casa unas semanas hasta el siguiente. “En general, los toleré bastante bien. Estaba cansada y perdí el pelo, pero intentaba hacer una vida lo más normal posible en los periodos de descanso. El peor ciclo fue el sexto, tras el cual tuvieron que ingresarme por una infección intestinal,
El linfoma respondió bien a la quimioterapia. Se había quedado en un centímetro y ahora tocaba tratarlo con radioterapia, pero en las pruebas previas observaron que había vuelto a crecer, y ya medía cinco centímetros.
Mi sensación era que la quimioterapia no iba a funcionar; lo cierto es que los ciclos fueron espantosos, estuve fatal.
Los ciclos apenas lograron reducir el linfoma, que por entonces medía unos cuatro centímetros. Así que empezaron a prepararla para administrar las células CAR. y Silvia pudo someterse con normalidad a la aféresis; sus linfocitos viajaron en avión a Estados Unidos para que el laboratorio farmacéutico modificara las células genéticamente.
Una noticia positiva era que las células habían llegado, a pesar de todas las restricciones de movilidad de esos primeros momentos de pandemia.
El linfoma: seguía avanzando; apareció incluso de forma subcutánea, localizado en la zona de la clavícula. Los médicos de Silvia recurrieron a una terapia puente con inmunoterapia. “Al terminar el confinamiento, pudimos retomar el tratamiento con las CAR-T, con todas las precauciones.
En junio, finalmente le infundieron las células. El proceso de la infusión apenas duró cinco minutos. Lo que más llamó la atención fue el olor a berberechos”. Las células hematopoyéticas, células CAR-T, células mesenquimales) se congelan en una solución que contiene un 10% de dimetil-sulfóxido (DMSO), que es el componente que desprende ese olor a berberecho que notan los pacientes o cualquiera que entra en la habitación durante unas horas].
La terapia fue como se esperaba: tuve algo de fiebre, pero nada preocupante. Lo pasé mucho peor con los últimos ciclos de la quimioterapia que con las CAR-T”. No solo las toleró bien, sino que además resultaron eficaces. El PET realizado al mes de la infusión mostró remisión completa, un resultado que se mantuvo a los seis meses.
Más de un año después de recibir este tratamiento, Silvia se encuentra mejor físicamente, si bien continúa haciéndose revisiones periódicas y tomando tratamiento profiláctico frente a potenciales infecciones.
Además de la vacuna contra la covid (tres pinchazos, porque dos dosis no bastaron para generar anticuerpos) también está recibiendo todas las vacunas del calendario pediátrico.
Silvia es de momento la paciente más joven tratada en el Hospital Universitario de Salamanca.
Su caso ha tenido lugar en paralelo con el de Zaida Rodríguez. Esta veinteañera canaria acababa de empezar la carrera de Enfermería en Fuerteventura cuando recibió el diagnóstico.
Hacía tiempo que sentía un dolor en la espalda muy fuerte. Un día se acostó y no pudo volver a ponerse de pie. Su padre la llevó al hospital, donde le hicieron todo tipo de pruebas.
Tenía una masa en la columna vertebral con todos los indicios de ser un linfoma. “ella ya se lo esperaba. En enero de ese año (era 2019), le había salido un bulto en el cuello que, al cabo de poco, desapareció. Un ganglio inflamado debido a una infección, pensaron entonces.
La evacuaron de urgencia al Hospital Insular de Gran Canaria, donde le confirmaron la sospecha: la masa de la columna y otra que se localizaba en el mediastino se debían efectivamente a un linfoma. “Al igual que Silvia, Zaida se enfrentaba a un linfoma B difuso de células grandes. También tras varios intentos con quimioterapia, el linfoma seguía avanzando y se había extendido al hígado y a los ovarios.
Fue entonces cuando le hablaron de las células CAR-T. El Hospital Universitario Doctor Negrín, de Las Palmas de Gran Canaria, es uno de los nueve hospitales de adultos en toda España designados por el Ministerio de Sanidad para administrar esta terapia.
En agosto trataron al primer paciente. Zaida fue la tercera; también la más joven del hospital. Explica que para los médicos la decisión no resultó fácil: cuando se había seleccionado para la terapia, empezó a empeorar rápidamente y tuvo que ingresar en la UCI; allí le extrajeron las células.
Por suerte, toleró muy bien la terapia. Permaneció ingresada casi veinte días, durante los cuales le controlaban cada pocas horas la posible aparición de efectos adversos neurológicos. “Me dijeron que podía sentirme desorientada o decir tonterías, por eso todos los días me hacían pruebas básicas, como preguntarme el día que era o que apuntara una frase, pero no nunca tuve ningún síntoma”.
Instruir de nuevo al sistema inmunitario cuando empieza a fallar en su misión de defensa o editar y reparar el código genético que está en la base de todas las funciones de nuestro organismo cuando se detecta un error, y llevar a cabo, además, ambas estrategias de forma personalizada para responder, no ya a una enfermedad, sino a las necesidades de un paciente en concreto, es una realidad cada vez más instaurada en el día a día de los especialistas y de los propios pacientes. Así son los medicamentos del futuro o lo que técnicamente se conoce como terapias avanzadas o medicina personalizada.
Las nuevas terapias avanzadas (en concreto las células CAR-T) han cambiado el panorama para pacientes con algunos tumores hematológicos, como leucemias, linfomas o mielomas, que no respondían a los tratamientos convencionales y en los que con estos nuevos tratamientos se han logrado resultados positivos en cuanto a remisión de la enfermedad entre un 50 y un 90% de los casos, según explica Fermín Sánchez-Guijo, vicepresidente de la Sociedad Internacional de Terapia Celular y jefe de la Sección de Terapia Celular del Servicio de Hematología del Hospital Universitario de Salamanca. También diversas estrategias de terapia génica están ofreciendo resultados prometedores en algunas enfermedades congénitas.
Más de 2.500 pacientes se han beneficiado ya en Europa de tratamientos con células CAR-T, y en España, aunque no hay datos públicos actualizados, las solicitudes han superado los 500 pacientes.
Como terapias avanzadas se describe a los medicamentos basados en el uso de genes (terapia génica), células (terapia celular) o tejidos (ingeniería tisular) para prevenir o tratar diversas enfermedades, pudiendo considerarse también cualquier combinación de estas alternativas, como sucede con las células CAR T, en las que se utiliza terapia génica y celular.
La utilización de terapias celulares en medicina no es una novedad reciente. Un ejemplo es el trasplante de médula ósea (denominado actualmente trasplante de progenitores hematopoyéticos), que ofrece una solución curativa a muchos pacientes con enfermedades de la sangre a través del reemplazo de sus células madre sanguíneas por las de un donante sano. En España se realizan cada año más de 1.300 trasplantes de progenitores hematopoyéticos de un donante sano, tanto de donantes familiares compatibles como de donantes del registro internacional.
Otro elemento que diferencia a las terapias celulares de otras estrategias terapéuticas es que son «medicamentos vivos», es decir, «las células van multiplicándose y reaccionando de forma diferente en función de las señales que reciben desde la sangre y los tejidos del paciente», precisa el experto.
Esta es una de las razones por las que resulta clave una vigilancia estrecha en las semanas posteriores al tratamiento celular para controlar la posible aparición de complicaciones. Y por eso su desarrollo y administración están concentrados en centros de referencia especializados con equipos humanos muy bien entrenados para actuar ante cualquier complicación. En España, son 15 los hospitales públicos acreditados por el Ministerio de Sanidad para administrar terapias CAR-T.