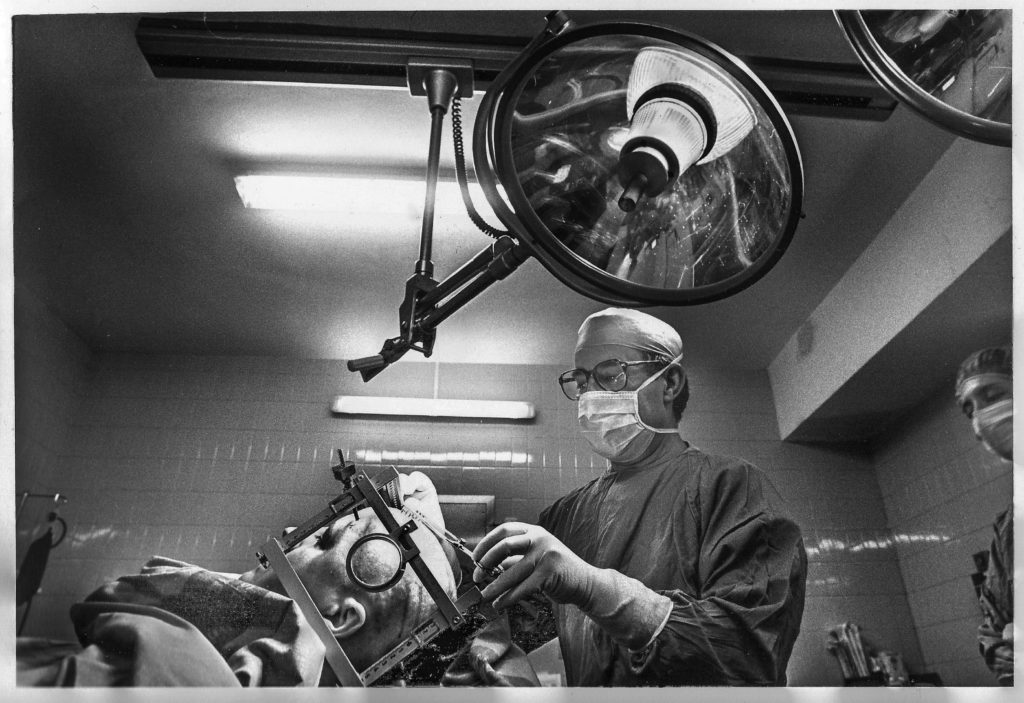
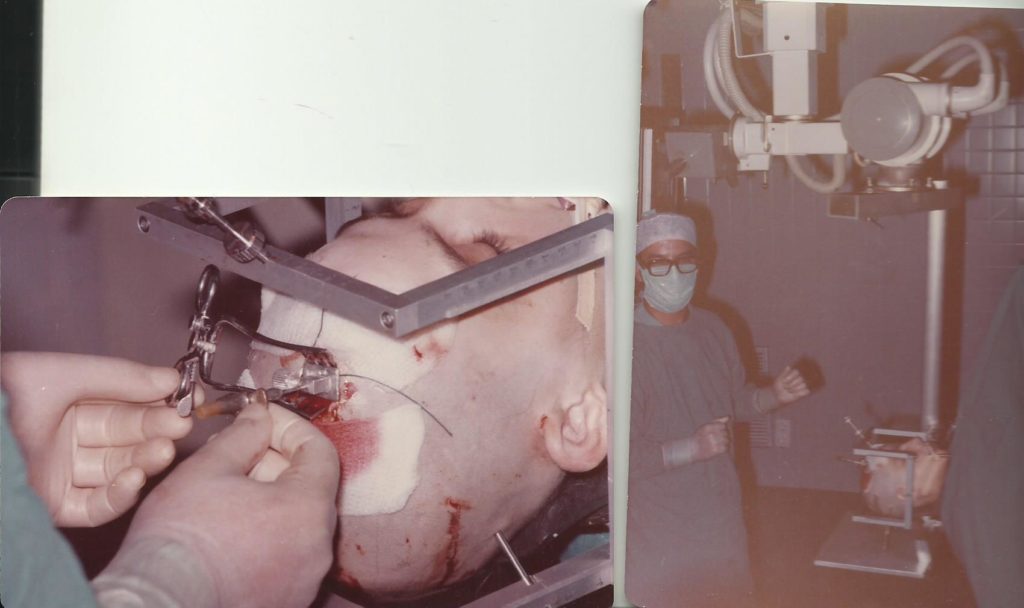
LEUCOTOMIA-LOBOTOMIA
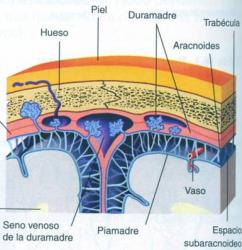
Desde la época neolítica, es frecuente la trepanación, llegando su técnica a grados insospechados de perfección en las tribus que habitaban el Alto Perú y en las del norte de Africa.
Ella se hacía de preferencia en los parietales, frontal y occipital. Se han encontrado cráneos sometidos a dos o más trepanaciones, efectuadas en condiciones satisfactorias a juzgar por el estudio de cicatrización de ellas.
En épocas más recientes, especialmente en el siglo Xix1 el conocimiento de la asepsia y de la anestesia impulsó notablemente la cirugía. Se ensayaron nuevos tratamientos cruentos contra la locura, dirigidos erróneamente a las manifestaciones orgánicas que aparecen frecuentemente en las psicopatías. La esfera sexual, las glándulas de secreción interna, fueron intervenidas quirúrgicamente con miras a suprimir Ia causa de las psicosis.
A fines del siglo pasado se localiza nuevamente la causa de las psicopatías en el cerebro y se intenta de nuevo la trepanación como tratamiento. En trabajos publicados en 1895, por Macferson, la trepanación se indicaba − a juzgar por la casuística que presenta − en enfermos que además de sus síntomas psíquicos presentaban alteraciones de Ia vista, cefaleas, vómitos, crisis convulsivas o trastornos motores. La intervención consistía en dos agujeros de trepanación, de preferencia en la zona rolándica y la abertura y drenaje de la cavidad subdural. Los síntomas regresaban ostensiblemente − a la luz de nuestros conocimientos los interpretamos como síntomas de hipertensión intracraneana por tumores probables de los lóbulos frontales que explicaban Ia sintomatologia psíquica.
Goltz y Burkhart − Director de un sanatorio suizo − experimentando en perros, pudieron apreciar que la resección de la parte anterior de los hemisferios los tornaba menos agresivos. Burkhart basado en estas experiencias sometió a un paciente que sufría de una típica esquizofrenia hebefrénica de 15 años de evolución − a repetidas intervenciones, observando sus resultados. La operación se hacía solamente en el lado izquierdo en la región temporal, parietal y frontal sucesivamente. La enferma mentalmente no se recuperó, pero quedó tranquila y ligeramente eufórica. Operó un total de seis enfermos y el gran escolio eran los trastornos motores y afásicos consecutivos a la intervención. Burkhart limitó sus aspiraciones a transformar un alienado peligroso en uno tranquilo.
EI desarrollo ulterior de Ia neurocirugía impulsado tan decididamente durante la guerra del 14 al 18, ha permitido a su vez el avance de la psico-cirugía. Las lesiones cerebrales traumáticas aceleraron el estudio de las localizaciones, ubicando con cierta precisión los polos frontales como el asiento de la conciencia
La primera vez que en la historia de la medicina, conocemos que una lesión en los lóbulos frontales, altera la personalidad del enfermo.
Sabíamos, que las lesiones cerebrales, eran incapaces de lesionar sentidos como, el lenguaje, la visión o áreas motoras en general. Pero nunca se había visto un distrés en la personalidad de un paciente.
Ocurrió una tarde de verano de 1848, durante las labores de construcción de una nueva línea de ferrocarril en el estado norteamericano de Vermont. Para allanar el terreno, los barreneros introducían pólvora en el fondo de un agujero perforado en la roca, colocaban el detonante, añadían arena para taponarlo y aplastaban la mezcla con una barra de hierro. En una de estas operaciones, al capataz, Phineas Gage , se le olvida poner la arena, de tal manera que, al explotar la pólvora, la barra sale disparada y le atraviesa la cabeza de abajo arriba.
Para sorpresa de todos, el joven de 25 años no solo no muere en el acto, sino que además se recuperará de forma milagrosa, aunque sufrirá un cambio de personalidad radical. “Gage ya no fue Gage”, en palabras de su médico. Tal es su carácter que le acaban echando de todos los trabajos por falta de disciplina. Los ataques de epilepsia, secuela de la herida, se hacen cada vez más frecuentes hasta su muerte, en 1860 y además le aparece un síndrome de Falso Diogenes
La “lobotomía” accidental de Gage ha pasado a la historia de la neurología como el primer caso que documenta los efectos causados por una lesión en los lóbulos frontales del cerebro, que es la parte que se interviene en las lobotomías quirúrgicas.
La especialización cerebral
Aunque en la prehistoria ya se practicaban trepanaciones, en tiempos modernos, las primeras cirugías sobre un cerebro físicamente sano con el fin de remediar los síntomas de un trastorno o enfermedad mental –práctica conocida como psicoterapia– no se producen hasta el último cuarto del siglo XIX. Por entonces, los científicos ya habían aportado pruebas de la especialización cerebral. Paul Broca, por ejemplo, había identificado las áreas cerebrales que controlan las funciones del lenguaje, ubicadas en el lóbulo frontal izquierdo.
La observación de estos primeros trabajos llevaron al psiquiatra suizo Gottlieb Burckhardt a pensar que quizá podría paliar los desórdenes psíquicos de sus pacientes de la Maison de Santé de Préfargier aligerando su masa cerebral. La primera candidata fue una mujer de 51 años aquejada de alucinaciones, a la que, en 1889, Burckhardt extirpó una pequeña porción de corteza cerebral de unos cinco gramos por un procedimiento quirúrgico llamado topectomía.
La intervención se repitió otras cuatro veces durante los siguientes catorce meses, y, aunque las alucinaciones no cesaron, la conducta violenta de la mujer fue disminuyendo poco a poco. Entre 1889 y 1891, Burckhardt practicó la técnica con cinco enfermos más, obteniendo resultados desiguales.
Cuando, al año siguiente, presentó su informe, la comunidad médica se le echó encima, al considerar una auténtica aberración el hecho de lesionar un cerebro físicamente intacto. Tal fue el rechazo que habría que esperar casi medio siglo antes de que alguien se atreviera a repetir una psicocirugía.
Las primeras leucotomías
En julio de 1935 tiene lugar en Londres el Segundo Congreso Internacional de Neurología, en el que John F. Fulton y Carlyle Jacobsen, fisiólogos de la Universidad de Yale, presentan los resultados de unos experimentos en los que se habían extirpado los lóbulos frontales a dos chimpancés Lucy y Becky. Antes de la operación, estos animales tenían un temperamente histericos y tenían ataques de coleras cuando cometían errores al realizar tareas que se recompensaban con comida. Inmediatamente despues de la cirugía, se tornaban dociles y apacibles.
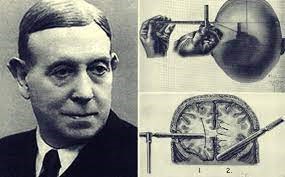
A la presentación acudieron, varios investigadores, entre ellos António Egas Moniz, de la Universidad de Lisboa, que tenia . 61 años, muy conocido por su carrera política y diplomática –había sido ministro de Asuntos Exteriores de Portugal y practico la primera angiografía cerebral como por haber descubierto la angiografía cerebral, que permitía visualizar las arterias del cerebro y por la que estuvo nominado dos veces para el Premio Nobel.
En noviembre del mismo 1935 Moniz y Pedro Almeida Lima, al que yo y en repetidas ocasiones he conocido, en las reuniones de la Sociedad Luso Española de Neurocirugia
Operan a una paciente de 63 años que presenta alucinaciones y violentos ataques de ansiedad, entre otras psicopatologías
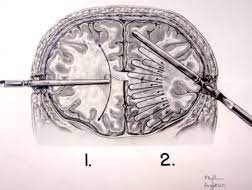
Almeida practica dos trepanos en ambas regiones frontales del cráneo.
Inyecta alcohol puro en el interior del cerebro.
La idea era que al igual que había pasado con los monos Lucy y Becky, destruirían la zona cerebral, que elaboraba la patología de obsesiones y delirios.
En 5 meses, intervinieron a una veintena de pacientes, introduciendo una modificación en la técnica, a la que bautizaron con el nombre de leucotomía.
Posteriormente El propio Moniz diseñó el leucotomo, un instrumento de acero en forma de estilete hueco que cortaba un trozo de lóbulo frontal, coreteza y sustancia blanca .
En 1937 publicaron un libro y trece artículos por lo que concedieron a Moniz del Nobel en 1949.
El procedimiento era eficaz en algunas personas.
Inmediatamente la comunidad cientifica argumento que no era seguro, puesto que se basaba en especulaciones y ni siquiera se habían realizado investigaciones previas en animales.
Los 20 primeros casos alcoholizados por Egaz Moniz obtuvo una recuperación franca en 7, una recuperación dudosa en otros 7 y ninguna mejoría para los 6 restantes. EI síndrome más accesible al tratamiento fué Ia agitación de los enfermos.
Nunca antes de Egaz Moniz se había intentado una intervención bilateral, aún cuando se comprendía su necesidad, en los trabajos experimentales.
La contribución de Egaz Moniz es una de las más brillantes en el campo de la psico-cirugía que abre un panorama pleno de posibilidades a la terapéutica psiquiátrica.
Siguiendo la escuela de Egaz Moniz numerosos cirujanos practican las leucotomías, modificando la técnica o sustituyendo el alcohol por novocaína, formalina.
Dr. Freeman a los 28 años, es el director de laboratorio del hospital psiquiátrico St. Elizabeths, en Washington, Walter Freeman está obsesionado con identificar alguna diferencia física entre el cerebro de los individuos psicóticos y el de los sanos, disparidades que le den alguna pista sobre la enfermedad y su cura. En 1936 lee los trabajos de Moniz y se abre un mundo ante él.
En septiembre de ese mismo año, Freeman, asistido por el cirujano James W. Watts, realiza la primera intervención para tratar un trastorno psiquiátrico en Estados Unidos. La paciente, una mujer de 63 años diagnosticada de depresión agitada, fue sometida a una leucotomía prefrontal siguiendo el procedimiento de Moniz.
Entusiasmados con los resultados favorables, Freeman y Watts repiten una y otra vez las lobotomías –término que ellos acuñan– e introducen algunas variables, como, por ejemplo, el uso de una espátula plana para realizar los cortes con anestesia local.
Pronto aparecen titulares sensacionalistas como “La cirugía del alma” o “Milagro de la cirugía”, creando una verdadera repulsión en unos y adicción a la técnica en otros.
Algunos pacientes presentaron graves secuelas la tras la lobotomía.
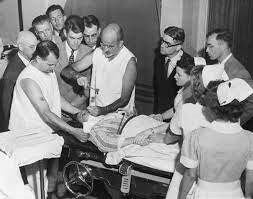
Freeman se entusiasmo con este empezó a practicar por su cuenta lobotomías, en masa, utilizando directamente un picahielos como instrumento.
Llegaban al hospital en un “lobotomóvil”, el personal ya tenía colocados a los enfermos en fila. Freeman insertaba el punzón metálico bajo el párpado para atravesar la cuenca de los ojos con unos ligeros golpes de martillo. Con cada martillazo, el punzón se adentraba suavemente en el lóbulo frontal del paciente, seccionándolo y destruyéndolo.
Esta técnica desplazada hoy, parece atroz se popularizó en todo el mundo .
Pero hay que situarse en la primera mitad del siglo XX, la comprensión científica de la enfermedad mental era muy limitada, por lo que no existía una cura real. El psicoanálisis no era eficaz para los grandes trastornos de la personalidad, y las llamadas “terapias somáticas”, como el electrochoque o los comas insulínicos, eran alternativas tremendamente agresivas.
Así pues, los centros psiquiátricos se convirtieron en puros almacenes de enfermos mentales, que se colapsaron, en especial, después de las dos guerras mundiales.
La leucotomía de Moniz y, más tarde, la lobotomía transorbital de Freeman eran procedimientos rápidos y baratos porque no requerían quirófanos ni material demasiado especializado. En algunos casos, además, funcionaban, por lo que se veían como una opción viable para descongestionar los centros, se practicaron 40.000 Leucotomias solo en Estados Unidos.
Entre estos trabajos se destaca el de Rizatti-Bogarello que presentó una serie de los casos y posteriormente 200 casos más. Como resultado de su experiencia insiste en el valor de la leucotomía combinada al shock cardiazólico e insulínico.
Desde 1935 a esta época la técnica de la leucotomía ha sufrido continuas variaciones, tantas que puede decirse sin exageración que cada psico-cirujano que la practica posee una técnica propia. Entre estas modificaciones merecen citarse la de Freeman y Watts de Estados Unidos de N. A. que es la que cuenta con mayores partidarios.
Aparece la clorpromazina.
Hasta que en 1954 se descubre la clorpromazina, la primera sustancia con efectos antipsicóticos, y poco a poco se abandonan las lobotomías Los fármacos revoluciónaron la psiquiatría.
A la altura de las ciencias de nuestro tiempo, la técnica permite hacer lesiones selectivas de vías fronto-talamicas con esteretoxia y mas actualmente con ultrasonidos, sin cirugía.
Los resultados, no terminan de dar resultados buenos, ya que por otra parte los tratamientos con , medicamentes si que dan unos resultados casi buenos.
Conclusiones
Estas son las conclusiones que proporciona , las cuales no creo que tengan ubicación hoy, pero por respeto a las opiniones las copio
REV CHIL NEURO-PSIQUIAT 2011; 49 (3): 225-240 Prof. Alfonso Asenjo, Dr. Isaac Horvitz, Dra. Adriana Vergara, Dr. Mario Contreras Instituto Central de Neurocirugta y Sección A de Psiquiatría del Manicomio Nacional
El análisis de las leucotomías realizadas hasta el día de hoy, nos permite sacar conclusiones de conjunto, que pasamos a resumir en los siguientes puntos:
1) La lobotomía debe practicarse en enfermos crónicos que hayan sido sometidos a los tratamientos de rigor.
2) Debe limitarse a los enfermos psiquiátricos crónicos e intentarse en las psiconeurosis sólo cuando se trata de enfermos de larga evolución que no han respondido a otras terapias.
3) El éxito de la lobotomía es más probable en aquellos enfermos que no han experimentado un deterioro mental muy acentuado y en los que no se hayan desconectado totalmente del ambiente.
4) La conducta antisocial (agresividad e impulsividad) y los síndromes angustiosos son los más beneficiados por la lobotomía.
5) Los síndromes delirantes alucinatoríos persisten en la mayoría de los casos, igual en su forma, pero disminuye enormemente su repercusión emocional.
6) La avaluación definitiva de los resultados sólo debe apreciarse por lo menos después de tres años de la intervención.
7) Los riesgos operatorios no son mayores que en cualquiera otra intervención quirúrgica (Hemorragia de la cerebral anterior).
8) Hacia el final de la intervención el paciente experimenta una desorientación total.
9) Los accidentes post-opera torios son escasos. La enuresis transitoria es casi constante. No se observan otros trastornos neurológicos de importancia.
10) En Ia evolución post-operatoria revelan frecuentemente un estado de estupor e indiferencia, cuya duración e intensidad no tienen valor pronóstico.
11) Posteriormente se observa una regresión al estado infantil (falta de control de las funciones escretoras, bulimia).
12) Gradualmente el enfermo vuelve a Ia normalidad (3-6 meses).
13)La evolución posterior depende en gran parte de Ia personalidad pre-psicótica y pre-operatoria del enfermo.
14) Debe insistirse, cada vez más, en la importancia del cuidado psiquiátrico post-operatorio (educación de los familiares, reeducación del enfermo, actividad ocupacional vigilada y graduada).
15) Los éxitos obtenidos por la mayoría de los neuro-cirujanos y los nuestros autorizan para considerar la lobotomía como tratamiento habitual de las psicosis.
BIBLIOGRAFIA
1. Allen, William F.− Results of prefrontal lobectomy on acquired and on acquiring correct conditioned differential responses with auditory, general cutaneous and optic stimuli. Am. J. Physiol. 139: 525-531. Agosto 1943.
2. Egas Moniz.−Tentatives opératoires en quelques cas de psichoses]
3. Fleming, G. W. Τ. H. y Me Kissok, Wilie.−Prefrontal leukotomy. Lancet 1: 361-362, Marzo 20-1943.
4. Freeman, Waiter.− Surgical aspects of prefrontal lobotomy, 1945.
5. Freeman, Walter.− Intelligence following prefrontal lobotomy in obsessive tension states, 1945. 6. Freeman, Walter.− Prefrontal lobotomy, 19467. Freeman, Walter y cols.− Neurosurgical treatment of certain abnormal mental states, 1944. 8. Freeman, Walter y Watts, James W.− Psico-cirugía. [ Links ]
9. Freeman, Walter y Watts, James, W.− Prefrontal lobotomv. Am. J. Psych. 101: 839-748. Mayo, 1945. [ Links ]
10. Fulton, J.− Fisiología del sistema nervioso. [ Links ]
11. Hostatter, Leopold, Smolik Edmund A. y Busch Anthony K. Prefrontal lobotomy in treatment of chronic psychoses with special reference to section of orbital areas only. Arch. Neurol, and Psvch. 53: 125-130. Febr., 1943. [ Links ]
12. Hutton E. L.− Results of prefrontal leukotomy. Lancet 1: 362־ 366. Marzo 20, 1943. [ Links ]
13. Houssay y cols.− Fisiología humana. [ Links ]
14. Kindwall, Josef A. y Cleveland David.− Prefrontal lobotomy. Am. J. Psych. 101: 749-755. Mayo, 1945. [ Links ]
15. Schroedder Α.− El lóbulo frontal. Montevideo 1942.
16. Lobotomias, revista Historia y Vida. Numero 608
17. REV CHIL NEURO-PSIQUIAT 2011; 49 (3): 225-240 Prof. Alfonso Asenjo, Dr. Isaac Horvitz, Dra. Adriana Vergara, Dr. Mario Contreras Instituto Central de Neurocirugta y Sección A de Psiquiatría del Manicomio Nacional.