SOBRE CIATICA
El término ciática describe un síntoma que hace referencia a una condición de dolor, originado en la cara posterior de la pelvis que se irradia por el borde posterior y/o lateral del muslo, que puede abarcar por debajo de la rodilla hasta la pierna y/o planta del pie y ortejos. Y de acuerdo a sus características (fenómenos acompañantes, condicionantes, atenuantes y maniobras especiales) puede ser condicionado por causas espinales y extraespinales
El objetivo de este trabajo es hacer un recuerdo histórico y muy complicado, de todos los autores que se han dedicado altema, y marcar las diferencias de conceptos que se han utilizado para explicar su origen.
Los dolores ciáticos, son muy frecuentes y muy crónicos y su origen no solo es plural, sino que posiblemente se le asocian enfermedades degenerativas, que la complican y empeoran. 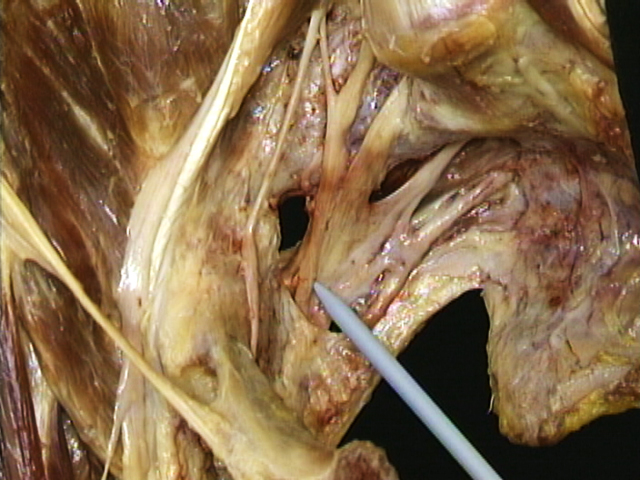
El término ciática se origina de sciatic derivada del latín [Sciaticus]; y del griego [ischiadikos]: que significa perteneciente al nervio o vena ciáticos o localizado cerca de ellos3.
Ciatalgia es una palabra compuesta (sciatic) y algia derivadas del griego algos que significa dolor1, por lo tanto se traduce como dolor en el trayecto del nervio ciático.
El primero en utilizar el término «sciatica» fue Hipócrates que lo empleó para describir dolor de la articulación de cadera (gr. ischios = cadera), secundaria a problemas de luxación. Posteriormente Galeno lo relacionó con problemas de la columna vertebral (lordosis, cifosis, escoliosis), involucrando los Humores como los responsables2. Aurelianus describió los primeros síntomas: dolor lumbar con irradiación hacia el glúteo, perineo, en ocasiones al hueco poplíteo, pierna, pie y dedos de los pies, lo asociaba con constipación2. Aegina (625-690 a.C.) lo atribuyó a un tumor de la cadera. Cotugno en 1794 atribuye los problemas de ciática debido a alteraciones de la circulación a través de los vasos sanguíneos y de la circulación cerebroespinal. En el Siglo XIX Kocher describe como causa de ciática el desplazamiento del disco intervertebral L1-2, y en 1881 Forst, un discípulo de Lasegué, en su tesis médica5, describió su maniobra para poner a tensión la raíz del nervio ciático y reproducir la sintomatología. En 1901 Krause y Herman Oppenheim reportaron la realización de una Laminectomía y resección de un encondroma7. Ya en 1911, distintos autores reportaban estas asociaciones (Goldthwait, Middelton y Teacher)5. 1927 Vittorio Putti y Lancet reconoció los cambios degenerativos del disco intervertebral y de las carillas articulares proponiéndolos como posible causa de ciática y denominándolos como artritis o ciática vertebral7.
En 1929 Schmorl G propone que los «encondromas» encontrados en el canal lumbar pudieran ser restos del disco y del núcleo pulposo, siendo descrito en el mismo año por Dandy W como una etiología de la cauda equina8.
Schmorl y Andrae describieron protrusiones discales en estudios post mortem sin asociarlo a ciática8.
Hasta este momento se consideraba que este síntoma era condicionado por encondromas espinales9. A partir de los trabajos publicados en 1934 y 1937 por Mixter y Barr4,5 se atribuyó a la ciática como consecuencia de una hernia de disco espinal al encontrar restos del núcleo pulposo en el canal medular que se encontraba irritando la raíz y producía la sintomatología5,7. Y manifestaron su clínica como un dolor profundo, localizado en la región glútea, que irradia en sentido inferior por la cara posterior del muslo por la cara posterolateral de la pierna y ocasionalmente en el borde lateral del pie y en el primer dedo, incrementando al toser, estornudar, flexión del tronco y el decúbito ventral5,10.
A partir de dichas descripciones en la actualidad la interpretación que se da a este término está asociada principalmente a la hernia de disco lumbar o al conducto lumbar estrecho lateral, olvidando las causas extra espinales que lo pueden condicionar o simularlo.
Existen reportes que www.medigraphic.org.mx Volumen 21, Núm. 2, abril – junio 2009 Ciática: una interpretación histórica 35 www.medigraphic.com describen entre 90 a 95%11,12 como causa de ciática a la hernia discal (independiente de que sea un fenómeno mecánico, químico o inflamatorio)16-18, y se pueden encontrar reportes de una prevalencia de los pacientes con ciática por síndrome del piramidal de 0.33 al 6%13,14. En 1987 el trabajo publicado por Bernard TN y Kirkaldy-Willis W, refiere como primera causa de síndromes de dolor referido al síndrome articular sacroiliaco y al síndrome articular posterior (54.21% de causas extraespinales y 45.32 de causas espinales)15. Con todo lo anterior ¿Qué importancia tiene el poder definir ciática? La controversia en la interpretación de un término puede afectar de manera importante los resultados de los estudios de incidencia, prevalencia y etiología de un problema frecuente1. Este término podría ser utilizado como sinónimo de ciatalgia, pero no de radiculopatía o síndrome radicular. Por lo analizado anteriormente el problema del uso del término debe ser considerado de igual forma como se emplea lumbalgia o dolor de espalda baja, como un síntoma y no una enfermedad. Y no debe perderse de vista que los síndromes son conjuntos de síntomas y signos clínicos que pueden ser provocados por distintas patologías.
.
Domenico Cotugno, que en 1764 en un trabajo titulado «De Ischiatis Nervosum», atribuye al sufrimiento del nervio ciático los dolores que parten del glúteo descendiendo por detrás del muslo y la pierna hasta el pie.
Charles Lasègue, un filósofo arrastrado hacia la medicina por Claude Bernard, deja para la posteridad el signo que llevará su nombre, pero sobre el que él nada ha escrito nunca. Sus estudios médicos no hacen mención del « signo ». Son sus alumnos quienes, tras su fallecimiento, describen en artículos de revistas o de tratados “el signo observado repetidas veces por el señor Lasègue en los enfermos afectos de neuralgia ciática”. Los puntos dolorosos descritos en la misma época por François Valleix, han inmortalizado el nombre de su descriptor.
También Édouard Brissaud, habría merecido que las actitudes anormales del raquis llevaran su nombre, las llamadas escoliosis ciáticas provocadas por ciáticas intensas; ya que las describió con precisión, distinguiendo las escoliosis cruzadas (en las que la inclinación lateral del cuerpo se hace al lado contrario de la ciática) y las escoliosis directas u « homólogas » (en las que la inflexión lateral se hace del mismo lado que la ciática). Para Brissaud, la escoliosis cruzada se entiende bien ya que, dice « es la posición que por instinto adopta el enfermo para aliviar el miembro doloroso, desplazando el cuerpo al otro lado ». Por el contrario no entiende la escoliosis homóloga que le parece « paradójica » ya que carga todo el peso del cuerpo sobre el miembro doloroso. Brissaud no pensó en que esta inflexión lateral directa podía tener el efecto de relajar, distender el nervio ciático o sus raíces. Con Brissaud, fallecido en 1909, se entra en los primeros años del siglo veinte y es entonces cuando aparece una especie de revolución en la comprensión de la ciática; un verdadero paso de gigante hará que el origen de la ciática pase del nervio ciático a las raíces del nervio ciático. Y esta evolución se hará en dos etapas que podemos llamar: a la primera “etapa Déjerine”, y a la segunda “etapa Sicard”.
La etapa Déjerine La ciática, de enfermedad troncular a enfermedad radicular. Jules Déjerine, Profesor Titular de la Cátedra Clínica de las Enfermedades del Sistema Nervioso en la Salpétrière, en los primeros años del siglo, traslada el origen de la ciática del nervio a las raíces. Habiendo observado que algunas ciáticas se acompañan de zonas de hipoestesia o de anestesia cutánea, Déjerine, que desde mucho tiempo se interesa en la topografía sensitiva de los nervios y de las raíces nerviosas, señala que en las ciáticas la distribución de las zonas de insensibilidad cutánea no se corresponde con los territorios que dependen del nervio ciático, sino a los territorios de las raíces del nervio. Estas anestesias cutáneas no se disponen en capas amplias como lo hacen las anestesias de origen troncular. Su disposición es en bandas longitudinales características, como demostró, a modo de como lo hacen las anestesias de tipo radicular. Estas anestesias dibujan los territorios de la raíces de la 5ª lumbar y de la 1ª sacra, tal como las dibujó en sus esquemas de la sensibilidad radicular. A partir de ese momento la ciática no es neuralgia ni neuritis, es una radiculitis. La punción lumbar, en aquel entonces técnica novedosa, permitió que Dejerine encontrara una hiper-albuminosis en el líquido cefalorraquídeo en algunos casos. En ello vio la prueba biológica de la radiculitis. Pero con el origen de esta radiculitis, Dejerine, tuvo menor suerte. Siguiendo la tendencia, frecuente en la época, en la que la sífilis atormentaba los espíritus, atribuyó la inflamación de las raíces ciáticas a la sífilis…y el aumento de la albúmina raquídea le parecía como a la mayoría de los neurólogos de su época una especia de marchamo de la sífilis nerviosa… hacía falta pues ir más lejos.
La etapa Sicard Jean-Anselme Sicard, también médico neurólogo, no de la Salpétrière, sino del hospital Necker, tendrá el honor de ser el primero en haber pensado que la afectación de la raíz ciática podía tener lugar fuera del saco dural, a la salida del agujero de conjunción. A esta parte extra-dural de la raíz nerviosa, Sicard la llama funículo. La radiculitis se convierte en funiculitis. Y especto a la causa de esta funiculitis, Sicard (este es su gran descubrimiento) es el primero en tener la idea de buscarla en los elementos óseos y ligamentosos de la columna vertebral que rodean el funículo apretándolo de cerca. Este doble desplazamiento de la responsabilidad, que se hace en algunos años (de 1915 a 1925), primero de la raíz intradural hacia la raíz extradural, y de allí hacia la columna vertebral, es la obra conjunta de un neurólogo, Sicard, que observa las ciáticas en el hospital Necker, y el Doctor Henri Forestier, médico termalista, que las observa en Aix-les-Bains. Es por primera vez en 1918 con Sicard, que se presenta la ciática como una afección de causa vertebral. J. A. Sicard estaba sorprendido de que las gruesas raíces del nervio ciático (las más gruesas raíces del organismo), para salir del canal vertebral lo hicieran en canales osteo-ligamentosos particularmente estrechos. Piensa en especial en la 5ª raíz lumbosacra, muy voluminosa, que pasa por un canal lumbar de conjunción muy angosto. En un artículo de la Presse Médicale (1918) titulado: « Néurodocites et Funiculites vertébrales », expone su idea, según la cual, en una ciática la raíz L5 se encuentra irritada por modificaciones de congestión o inflamatorias, que afectan al «neurodoque»; dicho de otra manera, el canal óseo que sigue la raíz para salir del raquis. Dos años más tarde, en 1920, Henri Forestier, junto con Sicard, sugiere que esta inflamación de la raíz en el interior del canal de conjunción podría provenir de una artritis (en sentido de artrosis) de la articulación interapofisaria posterior, que es la pared posterior del canal de conjunción. Este concepto se expone ampliamente en la tesis de Jacques Forestier, hijo de Henri Forestier, e interno de Sicard. En este estudio, la ciática se presenta oficialmente como una enfermedad de origen vertebral, originada por la compresión de la raíz ciática de las producciones artrósicas provenientes de la articulación intervertebral posterior. Jacques Forestier Este concepto recibirá el apoyo de los trabajos del cirujano ortopédico italiano Putti, quien de 1920 a 1927, para defender esta nueva patogenia del dolor ciático se esforzará incansablemente en precisar la anatomía, la fisiología, y las lesiones patológicas de las articulaciones vertebrales posteriores. Faltaba pues alcanzar una última etapa: la que consistía en mostrar que aunque el rol de las articulares posteriores en la patogenia de las ciáticas no debía despreciarse, existe el rol aún más importante de un órgano desconocido entonces por los médicos, es decir los anatomistas, que es el del disco intervertebral, que forma la pared anterior de los angostos desfiladeros por los que transcurren las principales raíces del ciático. La evolución de las ideas que conducen a este descubrimiento se prolonga casi durante veinte años, y puede contemplarse en varias etapas. Del condroma a la Hernia Discal Primera fase: la que podemos llamar etapa de las parálisis de la cola de caballo por condroma del disco intervertebral. Entre 1920 y 1928, neurocirujanos de los que recordaremos los nombres de Ott y Anderson (dos condromas del disco lumbar), y de Elsberg (siete condromas cervicales), operando pacientes afectos de parálisis de la cola de caballo encuentran una lesión extradural adherida al disco intervertebral, de consistencia fibrocartilaginosa que interpretan como un tumor benigno del cartílago: un condroma. Segunda fase: la del reconocimiento de la hernia del disco intervertebral. En 1928, dos autores franceses, un neurólogo, Alajouanine, de la Cátedra de la Clínica de las Enfermedades del Sistema Nervioso en el Salpétrière y un neurocirujano Petit-Dutaillis reconocen en el pretendido condroma a la hernia del disco intervertebral tal y como la describen en el cadáver los anatomistas de la Escuela de Dresde, Schmorl y su alumno Androe. Alajouanine y PetitDutaillis leyeron los trabajos anatómicos de Schmorl. En dos de sus operados encontraron al pretendido condroma; señalan el estrecho parecido que existe entre estos nódulos blanquecinos que están junto al disco y las imágenes de hernias posteriores del disco intervertebral tal y como aparecen en el libro de Schmorl. A partir de ese momento remplazan el término de tumor del disco por el de nódulo fibroso de la parte posterior del disco. Dos años más tarde, en 1930, agrupando 3 casos personales con 21 casos entresacados de la literatura establecen basándose en pruebas irrefutables que estos pretendidos condromas del disco operados por los neurocirujanos y las hernias posteriores del disco intervertebral encontradas por Schmorl y Androe en cadáveres de su instituto anatómico, no son más que una misma lesión. No es un tumor del disco sino una parte de la sustancia prolapsada en el canal raquídeo de ese mismo disco. Esta parte herniada es el núcleo pulposo. Se debe pues a Alajouanine y a Petit-Dutaillis el honor de introducir la hernia del disco intervertebral en la patología del sistema nervioso por primera vez. Pero apoyándose en una de sus observaciones, estos mismos autores hacen otro descubrimiento tan importante como el primero. Uno de sus pacientes no presentaba (como los demás) una paraplejia por compresión global de los nervios de la cola de caballo. Esencialmente sufría una ciática que parecía banal, con la diferencia de que un análisis neurológico extremadamente fino permitía descubrir además de la ciática, una ligera afectación motriz, sensitiva y esfinteriana, que permitían hablar de un hemi-síndrome de la cola de caballo. Pero de hecho, y a pesar de todo, era una ciática. Era un descubrimiento importante. Se probaba por esta observación princeps (Alajouanine et Petit-Dutaillis) que una hernia posterior del disco intervertebral puede provocar una paraplejia pero también ser la causa de una ciática parecida a la ciática banal. Aunque ¡atención! (dicen los autores): si puede simular una ciática banal, estrictamente no lo es, y es muy importante distinguirlas, ya que su pronóstico es infinitamente diferente en cuanto a la gravedad; si no se opera rápidamente, la compresión (según Alajouanine y Petit-Dutaillis) se agravará inexorable y progresivamente; o con crisis entrecortadas con falsas remisiones; para acabar final y fatalmente en una severa parálisis con trastornos de esfínteres irreversibles. La tesis de Mauric en 1933, también escrita en la Salpêtrière bajo la inspiración de su maestro Alajouanine, apunta sobre este tema. La ciática por hernia discal posterior se presenta como una nueva causa más bien rara de ciática sintomática por compresión intravertebral. Es la falsa ciática la que el medico debe reconocer para no confundirla con una ciática ordinaria ya que en este último caso hay que operar rápidamente antes de que provoque graves desórdenes motores o esfinterianos. Las publicaciones de Alajouanine y Petit-Dutaillis llamaron la atención de los neurocirujanos de los Estados Unidos que se lanzaron por esta línea abierta con el dinamismo y la eficacia habituales de los americanos. De 1930 a 1939 harán con el concepto de ciática por hernia discal un progreso sorprendente. Ayudándose del lipiodol-diagnóstico inventado por Sicard, del cual modifica la técnica para adaptarlo a la busca de las hernias discales, los neurocirujanos americanos, Barr, Mixter, Spurway, Lowe, Camp junto a otros, descubren que la ciática por hernia discal posterior, lejos de ser una rara afección, es frecuente, de manera que número de sus operados aumenta vertiginosamente año tras año: Lowe opera 500 casos en 1940. No obstante, como Alajouanine y Petit-Dutaillis, estos neurocirujanos americanos insisten en que estos dolores debidos a una compresión por hernia discal no deben ser confundidos con la ciática común y con la neuralgia ciática ordinaria, que deben seguir perteneciendo a la patología reumatológica. En el tratado de Lewin, un clásico en Estado Unidos, titulado «Backache and sciatic neuritis» encontramos aún en la edición de 1944, el estudio aparte de la hernia discal en el capítulo XXIX y de la ciática en el capítulo XXI en el que se citan las causas por infección, por intoxicación, por avitaminosis, por diabetes, por artritis posteriores, por enfriamiento; pero no por hernia discal posterior. Faltaba pues superar la tercera fase: la que consiste en reconocer que ciática discal y ciática «a secas» no son más que la misma enfermedad, que una y otra no son más que la expresión común de lo que hemos llamado conflicto disco-radicular. Es decir, mostrar que la compresión o simplemente la irritación de las raíces L5 o S1 por el disco intervertebral no es tan solo la causa de un cierto número de ciáticas severas de pronóstico particularmente grave que hay que operar obligatoriamente bajo pena de parálisis grave; sino que este mecanismo también interviene de manera no constante, pero sí habitual) en el origen de la ciática primitiva, o esencial, o reumática. Instruido por una basta experiencia en la inexactitud de las búsquedas bibliográficas y por la vanidad de las querellas de prioridad, diré aquí, que salvo prueba en contrario, pienso haber sido personalmente el artífice, quizás incluso el principal artífice de esta última etapa. En un trabajo preparado en el Salpétrière donde era asistente de LévyValensi acabado el periodo militar durante la «drôle de guerre», procuramos las pruebas de la identidad esencial de la ciática discal y de la ciática común. Estos dos artículos se titulaban: el primero «La ciática llamada banal esencial o reumática, y el disco lumbosacro» (publicado en la Revue du Rhumatisme de diciembre de 1939), el segundo titulado «Ciática banal y discos lumbosacros» (esta vez en plural) publicado en “la Presse médicale” el 10 junio de 1940. Dos fechas evidentemente mal escogidas para facilitar la difusión internacional de un trabajo francés. En estos dos trabajos se demostraba, pienso que por primera vez, que ante cualquier planteamiento, fuera clínico, radiológico, evolutivo, u otro, no se podía encontrar un elemento que permitiera oponer la ciática común y la ciática discal como dos enfermedades esencialmente diferentes, y que todo incitaba a unirlas, es decir, integrarlas en el cuadro que entonces vinimos en llamar el conflicto disco-radicular. Esta concepción, a despecho de algunas resistencias, se aceptó en general entre el conjunto de los reumatólogos y los neurólogos. Durante la guerra y en la post-guerra se hizo rápidamente habitual el considerar al conflicto discoradicular como causa más frecuente de la ciática. Ello comporta dos elementos: una irritación mecánica de origen discal, y una reacción inflamatoria de la raíz irritada. Según los casos el conflicto puede situarse en el último disco lumbar, el disco L5-S1 afectando la primera raíz sacra S1, o en el disco anterior L4-L5, afectando entonces la quinta raíz lumbar. Es un conflicto de gravedad variable según la importancia respectiva de la agresión discal y de la inflamación radicular. La solución para este conflicto en habitualmente médica, pero precisa de la intervención del cirujano en las ciáticas rebeldes que resisten a varios meses ante un tratamiento médico bien llevado. Está claro que los estudios y los progresos no se detienen aquí. Durante los decenios siguientes aparece una semiología clínica y radiológica cada vez más precisa, enriquecida con algunos nuevos signos como los que nosotros hemos descrito con el nombre de “el timbre” y el signo del “bostezo discal electivo”, simple o provocado, permitirá fácilmente en la mayoría de los casos hacer el diagnóstico de ciática disco-radicular y localizar el conflicto con los únicos datos de la clínica y de la radiografía vertebral. Las ciáticas no discales No obstante, para el diagnóstico de los casos difíciles, aquellos de localización incierta, aquellos en los que el origen discal es dudoso, el progreso de las técnicas de opacificación proponen medios de contraste cada vez más manejables y mejor tolerados; al lipiodol, al discolipiodol, al methiodal, al dimer, les sucede finalmente el Amipaque actualmente en uso. Se proponen nuevas técnicas de opacificación, con mayor o menor éxito: discografía, nucleografía. La tomodensitometría, llamada también scanner, y la resonancia magnética nuclear. Recomendados por su total inocuidad, no comportan dolor ni complicaciones, y permiten una exploración ; que permiten una exploración global de la zona dando a la vez una imagen de las raíces nerviosas del ciático, del espacio peridural por donde transcurren, del disco intervertebral que las amenaza por delante y de las articulaciones vertebrales posteriores que las amenazan por detrás. Con estas nuevas técnicas de exploración se verá facilitada la solución del viejo problema que consiste en medir con exactitud, en cada caso de ciática, la responsabilidad proveniente del disco intervertebral por delante y las anomalías intervertebrales posteriores por detrás. En los años de post-guerra la importancia de los descubrimientos del papel del disco intervertebral en la patogenia de la ciática, había dejado en un segundo plano el papel que podían tener las articulaciones vertebrales posteriores con formaciones artrósicas en algunas ciáticas. No es que fueran desconocidas, ya que en los años 20, Henri y Jacques Forestier, Sicard, en Francia, et Putti, en Italia, habían subrayado su importancia. Pero para que los médicos franceses se volvieran a interesar en ellas fue preciso que las ciáticas por artrosis posterior volvieran desde Inglaterra y América con el nombre de “facet-syndrome”, o con el nombre de “estenosis del canal raquídeo lumbar”, o incluso con el de “canal lumbar estrecho”. Digamos a continuación que no reconocemos los canales estrechos congénitos, a los que Verbiest dedicó numerosos trabajos, como causa de ciática (quizás como una incierta y vaga causa predisponente). Por el contrario, hay que tener en cuenta esos estrechamientos adquiridos en las zonas inter-disco-articulares L4-L5 y L5-S1 de Latarjet et Magnin, que normalmente son relativamente estrechos. Estrechez que puede aumentar bajo la influencia de la edad y la hiperlordosis, por la hipertrofia de las articulares posteriores de forma aislada o asociada a las protusiones disco-osteofíticas de origen disco-artrósico. Estos estrechamientos adquiridos por lesión de la pared anterior, de origen articular, y de la pared anterior, de origen discal, pueden afectar un solo nivel disco-articular, pero pueden extenderse a varios niveles lumbares; en este último caso a veces aparece una evolución clínica particular en forma de verdadera claudicación radicular intermitente. La exploración con scaner tiene entonces una importancia especial, ya que muestra (mejor que la disco-radiculografía opaca o gaseosa), con precisión la extensión en altura y amplitud de las estenosis. Y muestra lo que le sucede al disco y a las estructuras posteriores. El scaner le permite al cirujano preveer al mismo tiempo la importancia de las resecciones óseas que serán necesarias para devolver el espacio vital a las raíces. Completados nuestros conocimientos de la ciática, ¿hemos agotado el tema y podemos acabar el estudio? Ciertamente, no; aunque solo sea por los estudios radiológicos y exploraciones quirúrgicas relativamente frecuentes que siguen siendo negativas a pesar del empleo de las técnicas más avanzadas, incluso en manos de los radiólogos y cirujanos más expertos. Ello nos obliga a dejar abierto el estudio de las ciáticas no discales que no muestran más que una artrosis hipertrófica de las articulaciones posteriores. Conclusión En conclusión, aquí mismo, entre estos viejos edificios del hospital de la Salpêtrière, neurólogos pertenecientes a cuatro generaciones sucesivas han hecho lo que han podido para esclarecer los misterios de los dolores ciáticos. Han visto cosas interesantes, pero ciertamente, no lo han visto todo. Nuestros más jóvenes colegas, que hoy festejan con nosotros el Centenario de la Clínica de las Enfermedades del Sistema Nervioso.
La ciática (también, neuritis ciática, ciatalgia o lumbociática) es un conjunto de síntomas que incluye, sobre todo, el dolor en el territorio del recorrido de la espalda nervio ciático, que puede estar acompañado de alteraciones en la función neurológica local.1
Entre sus causas están la compresión general o irritación de una de las cinco raíces de los nervios espinales que dan origen a cada nervio ciático y, también, la compresión o irritación de la izquierda o hacia la derecha o ambos nervios ciáticos. El dolor se percibe en la zona lumbar, en los glúteos o diversas partes de la pierna y el pie. Además del dolor, puede haber entumecimiento, debilidad muscular, hormigueo o sensación de hormigueo, sensación de ardor y dificultad en el movimiento o en el control de la pierna. Generalmente, los síntomas se sienten en un solo lado del cuerpo.
A pesar de que la ciática es una forma relativamente común de dolor de espalda baja y dolor en las piernas, el verdadero significado del término no se comprende con mucha frecuencia. La ciática es un conjunto de síntomas más que un diagnóstico de lo que irrita la raíz del nervio y causa el dolor. Este punto es importante, porque el tratamiento para los síntomas de la ciática suele ser diferente, dependiendo de la causa subyacente de los síntomas.
El primer uso conocido de la palabra ciática se remonta a 1451.2
Etiología
La ciática es causada generalmente por la compresión de los nervios lumbares L4 o L5 o de los nervios sacros, S2 S1 o S3, o, con mucha menor frecuencia, por la compresión del nervio ciático en sí. Cuando la ciática es causada por la compresión de una raíz nerviosa dorsal (base) se considera una radiculopatía lumbar (radiculitis o cuando se acompaña con una respuesta inflamatoria) de una hernia de disco vertebral (hernia de disco intervertebral, una en la columna vertebral), o de la rugosidad, la ampliación o pérdida de alineación de las vértebras (espondilolistesis), o discos degenerados. La ciática debido a la compresión de una raíz nerviosa es una de las formas más comunes de la radiculopatía.
La pseudociática o-discogénico ciática, que causa síntomas similares a la compresión de la raíz del nervio espinal, no es más que dolor causado a menudo por daños a las articulaciones de la espalda baja y se siente como dolor en la espalda baja y posterior de los muslos. Este dolor pseudociático en algunos casos también puede ser causado por la compresión de las secciones periféricas del nervio, por lo general por tensión de los tejidos blandos del músculo piriforme o relacionados (ver Síndrome piriforme y ver más adelante).
Hernia de disco vertebral
Una de las posibles causas de la ciática es una hernia de disco vertebral que presione una de las raíces del nervio ciático. Los discos intervertebrales se componen de un anillo espongiforme de cartílago o (anillo fibroso) con un centro más maleable (núcleo de pulposis).
Los discos separan las vértebras, abriendo así un espacio para que las raíces nerviosas puedan salir correctamente a través de los espacios entre la L4, L5, y las vértebras sacras. Los discos amortiguan las fuerzas de compresión de la columna vertebral, pero son débiles a la presión aplicada durante los movimientos de rotación. Es por eso que una persona que se inclina hacia un lado, en un mal ángulo para recoger algo, puede tener más probabilidades de herniar un disco vertebral que una persona que salta de una escalera y aterriza sobre sus pies.
La hernia de disco se produce cuando el centro líquido del disco sobresale hacia el exterior, rompiendo el anillo exterior de las fibras, extrudidas en el canal espinal, y comprime una raíz nerviosa contra la lámina o pedículo de la vértebra, lo que causa la ciática. Este líquido salido del núcleo pulposo puede causar inflamación e hinchazón de los tejidos circundantes que pueden a su vez causar una mayor compresión de la raíz nerviosa en el espacio cerrado del canal espinal.
La ciática causada por la presión de una hernia de disco y la hinchazón de los tejidos circundantes puede desaparecer espontáneamente si el desgarro en la cura del disco y extrusión de la pulposis y la inflamación cesan.
La ciática puede también ser causada por tumores que afecten a la médula espinal o las raíces nerviosas. El dolor severo de la espalda que se extiende a las caderas y los pies, pérdida de la continencia urinaria o del control del intestino o del músculo, pueden resultar de tumores de la médula. Los traumatismos en la columna, por ejemplo derivados de un accidente automovilístico, también pueden llevar a la ciática.
Otras causas incluyen la compresión vertebral por estenosis espinal. En esta condición, el canal espinal (o espacio a través de los que pasa la médula espinal) se reduce y comprime la médula espinal, la cola de caballo o raíces nerviosas del nervio ciático. Este estrechamiento puede ser causado por los espolones óseos, espondilolistesis, inflamación, o hernia de disco que disminuye el espacio disponible para la médula espinal, lo que comprime e irrita los nervios de la médula espinal en que van los nervios ciáticos.
El síndrome piriforme.
En el 15% de la población el nervio ciático pasa a través del músculo piriforme y no por debajo. Cuando el músculo se acorta u ocurren espasmos debidos a un traumatismo o uso excesivo, puede ocurrir la compresión o estrangulación del nervio ciático por debajo del músculo.
Condiciones de este tipo se conocen generalmente como neuropatías por atrapamiento. En el caso particular de la ciática y el músculo piriforme, esta condición se conoce como «síndrome piriforme». Coloquialmente se conoce como «ciática de cartera», que puede ocurrir por la billetera colocada en el bolsillo posterior de la cadera, comprimiendo los músculos de los glúteos y el nervio ciático cuando el portador se sienta. El síndrome piriforme puede ser causa de la ciática cuando la raíz del nervio es normal. 34
Los puntos gatillo
Otra fuente de los síntomas de ciática son los puntos gatillo activos de la zona lumbar y los músculos glúteos. En este caso, el dolor referido no es consecuencia de la compresión del nervio ciático, aunque la distribución de dolor en los glúteos y la pierna es similar. Los puntos gatillo se producen cuando los músculos se isquémisan (con bajo flujo sanguíneo) debido a una lesión o contracción muscular crónica. Los músculos más comúnmente asociados con los puntos gatillo que provocan síntomas ciático son: el cuadrado lumbar, el glúteo medio, el glúteo menor, y los rotadores de la cadera de profundidad.
Embarazo
La ciática puede ser experimentada durante el embarazo, principalmente como resultado de que el útero presione el nervio ciático, y, en segundo lugar, por la tensión muscular o como consecuencia de la compresión vertebral de llevar el peso adicional del feto, y los cambios posturales inherentes al embarazo.5
Hábitos
El riesgo de ciática autoinfligida se ha incrementado en los últimos años. Por ejemplo, puede producirse al sentarse sobre la cartera colocada en el bolsillo posterior del pantalón6 o al permanecer de pie durante períodos prolongados de tiempo todos los días, lo que puede causar la ciática autoinfligida. Los síntomas de entumecimiento o dolor detrás de la rótula de la rodilla se asocian a esta forma de ciática. La ciática relacionada con el trabajo puede ser causada por el uso de cinturones de herramientas que cuelguen alrededor de las caderas y causen un desalineamiento significativo de las vértebras sacras durante largos períodos.
Fascia
De acuerdo a nuevos estudios, se postula que una posible causa de dolor de espalda y del nervio ciático se debe a alteraciones en la fascia.
Diagnóstico
Debido a las muchas circunstancias que pueden comprimir las raíces nerviosas y causar la ciática, el tratamiento de ésta y los síntomas a menudo difieren de paciente a paciente. Algunos indicadores comunes de la ciática son: entumecimiento en los pies o las piernas, sensaciones extrañas, alteración de los reflejos y debilidad.7 Las pruebas de diagnóstico pueden adoptar la forma de una serie de exámenes por un médico. Se les pedirá a los pacientes que adopten numerosas posiciones y realicen diversas acciones como agacharse, caminar sobre los dedos del pie, inclinarse hacia adelante y hacia atrás, girar la columna vertebral, sentarse, acostarse sobre la espalda y levantar una pierna de cada vez. En alguna de estas actividades se produce aumento del dolor.
Si no se ha producido mejoría en los síntomas en seis semanas o las banderas rojas están presentes, es apropiado un diagnóstico por imagen, que puede incluir TAC o resonancia magnética.8 La neurografía RM se ha demostrado eficaz en el diagnóstico del 95% de los pacientes con ciática grave, mientras que tan sólo el 15% de los enfermos de ciática en la población general son diagnosticados de problemas relacionados con discos.9 La neurografía RM es una técnica modificada de resonancia magnética que se vale del software de resonancia magnética para proporcionar mejores imágenes de los nervios espinales y el efecto de compresión en los nervios. Puede ayudar a diagnosticar el síndrome del piriforme, que es otra causa de la ciática que no implica una hernia de disco.10 [cita requerida]
Tratamiento
Cuando la causa de la ciática se debe a una hernia de disco lumbar o prolapso de disco, el 90% de los casos es resuelto sin intervención, siempre que se pueda tratar la causa subyacente de la compresión, si bien la cirugía sigue siendo necesaria en casos de absceso epidural, tumores epidurales, o del síndrome de cauda equina.
Los casos de ciática son tratados con medidas diferentes. Sin embargo, la evidencia de la eficacia de estas medidas es limitada.8 Algunas de estas medidas son las siguientes:
Los medicamentos anti-inflamatorios (como por ejemplo, AINE o esteroides orales. Sin embargo, los AINE no son más efectivos que el placebo para la ciática aguda)11
El paracetamol (acetaminofeno): evidencia de su eficacia limitada
Narcóticos: a menudo se utilizan si el dolor es severo
La fisioterapia y los ejercicios de estiramiento. Aquí se incluyen tanto los tratamientos de fisioterapia, quiropraxia y osteopatía.
Las inyecciones epidurales de esteroides no ofrecen mejoras a largo plazo en los resultados, pero proporcionan algunos beneficios a corto plazo
Descompresión espinal no quirúrgica
Terapia de masaje. Puede ser costoso acudir con un quiropráctico o masajista, y solo acceden a los músculos superficiales. Existen aparatos ortopédicos como el cordus, que pueden utilizarse domiciliariamente para eliminar espasmos en los músculos intervertebrales profundos.[cita requerida]
La pérdida de peso reduce la presión sobre las raíces del nervio espinal
Cirugía
La cirugía acelera la resolución del dolor. Dos años después, sin embargo, las técnicas quirúrgicas y no quirúrgicas tienen los mismos resultados, de modo que la preferencia de un paciente puede ser una razón válida para elegir un procedimiento u otro.8 La microdiscectomía es una cirugía abierta. Puede producir adherencias al cabo de las dos semanas como regeneración del tejido conectivo dañado por la incisión. Este proceso es llamado fibroaracnoiditis y puede reactivar la sensación de ciática a largo plazo.
Prevención
Ejercicios como la natación fortalecen los músculos que sostienen la espalda, sin poner ninguna presión sobre él o someterlo a una sacudida repentina, y se puede prevenir y reducir los síntomas de la ciática. Yoga o Pilates pueden ayudar a mejorar la flexibilidad y la fuerza de los músculos de la espalda.12
La mala postura puede agravar la ciática. La adopción de medidas para mejorar la postura puede aliviar el dolor y la hinchazón:
De pie
Ponerse de pie con la espalda recta y la cabeza mirando al frente. El peso debe ser equilibrado, manteniendo ambas piernas rectas.
Sentado
Sentarse en posición vertical con un soporte, como un cojín o una toalla enrollada en la parte baja de la espalda. Las rodillas y las caderas deben estar al mismo nivel y los pies deben estar planos sobre el suelo, con la ayuda de un taburete si es necesario.
Conducir
La espalda debe estar debidamente asentada. Posición correcta de espejos retrovisores para evitar tener que girar la espalda. Los pedales deben estar directamente en frente de los pies. Si conduces largas distancias, deben tomarse pausas regulares para estirar las piernas.
Dormir
Dormir en un colchón medianamente firme (no demasiado firme). El colchón debe ser lo suficientemente firme como para sostener el cuerpo, mientras que soporta el peso de los hombros y las nalgas, manteniendo la columna recta. Apoyar la cabeza en una almohada, asegurándose de que el cuello no se vea obligado a estar en un ángulo empinado.
De elevación y manipulación
Para evitar lesiones como la ciática, debe seguirse el método correcto para levantar y/o manipular objetos.12
REFERENCIAS
1. Mixter WJ. Rupture of the lumbar intervertebral disk. Annals of Surgery 1937; 106(4): 777-87. 2. Pearce JMS. A brief history of sciatica. Spinal Cord 2007/09; 45(9): 592–596. 3. Dorland. Diccionario enciclopédico ilustrado de Medicina. McGraw-Hill Interamericana Ed 28: 1997. 4. Filler AG, Haynes J, Jordan SE et al. Sciatica of nondisc origin and piriformis syndrome: diagnosis by magnetic resonance neurography and interventional magnetic resonance imaging with outcome study of resulting treatment. J Neurosurg Spine 2005; 2: 99-115. 5. Stafford MA, Peng P, Hill DA. Sciatica: a review of history, epidemiology, pathogenesis, and the role of epidural steroid injection in management. Br J Anaesth 2007; 99(4): 461-3. 6. Rebian R, Baxter GD, Mcdonough S. A systematic review of the passive straight leg raising test as a diagnostic aid for low back pain (1889 to (2000). Spine 2002; 27(17): E388-95. 7. Konstantinou K, Dunn K. Review of Epidemiological Studies and Prevalence Estimates. Spine 2008; 33(22): 2464-2472. 8. Barr JS, Mixter WS. Posterior protrusion of the lumbar intervertebral discs. J Bone & Joint Surg 1941; 23(2): 444-56. 9. Parisien RC, Ball PA. Historical perspective William Jason Mixter (1880-1958): Ushering in the «Dynasty of the disc». Spine 1998; 23(21): 2363-2366. 10. Koew BW, van Tulder MW, Peurl W. Diagnosis and treatment of sciatica. BMJ 2007; 334: 1313-7. 11. Kinkade S. Evaluation and treatment of acute low back pain. Am Fam Physician 2007; 75: 1181-8. 12. Foster MR. Piriformis syndrome. Orthopedics 2002; 25(8): 821-4. 13. Geenevay S, Stingelin S, Gabay C. Efficacy of etanercept in the treatment of acute, severa sciatica: a pilot study. Ann Rheum Dis 2004; 63: 1120-23. 14. Howe JF, Loeser JD, Calvin WH. Mechanosensitivity of dorsal root ganglia and chronically injured axons: A physiological basis for the: radicular pain of nerve root compression. Pain 1977; 3(I 97-7): 25-41. 15. Valat JP, Giraudeau B, Rozenberg S et al. Epidural corticosteroid injections for sciatica: a randomized, double blind, controlled clinical trial. Ann Rheum Dis 2003; 62: 639-43. 16. Byrd TJW. Piriformis Syndrome. Oper Tech Sports Med 2005; 13: 71-79. 17. Bernard TN, Kirkaldy-Willis WH. Recognizing specific characteristics of non-specific low back pain. Clin Orthop 1987; 217: 266-80. 18. Luijsterburg PA, Arianne P, Verhagen et al. Physical therapy plus general practitioners´ care versus general practitioners´ care alone for sciatica: a randomized clinical tria
Fitzgerald, Robert H; Kaufer, Herbert; Malkani, Arthur L (2004). «Lumbalgia y ciática». Ortopedia. Ed. Médica Panamericana. pp. 1308-1322. ISBN 950060793X. Consultado el 30 de diciembre de 2013.
Diccionario inglés de Oxford, 2a. ed. «A1450a la Humanidad (Brandl).»
Kirschner JS, Foye PM, Cole JL (2009). «Piriformis syndrome, diagnosis and treatment». Muscle Nerve 39 (1): 10-8. PMID 19466717. doi:10.1002/mus.21318.
Lewis AM, Layzer R, Engstrom JW, Barbaro NM, Chin CT (2006). «Magnetic resonance neurography in extraspinal sciatica». Arch. Neurol. 63 (10): 1469- PMID 17030664. doi:10.1001/archneur.63.10.1469. . ↑ en:Iliacus
BBC News: ¿Es su cartera un dolor en la espalda?
«How do you know if you have sciatica?». Archivado desde el original el 28 de julio de 2011.
Saltar a:a b c Gregory DS, Seto CK, Wortley GC, Shugart CM (octubre de 2008). «Acute lumbar disk pain: navigating evaluation and treatment choices». Am Fam Physician 78 (7): 835-42. PMID 18841731.
Filler, Aaron; Haynes, J., Sheldon, E., Prager, J., Villablanca, J.P., Farahani, K., McBride, D., Tsuruda, J.S., Morisoli, B., Batzdorf, U. & Johnson, J.P. (febrero de 2005). «Sciatica of nondisc origin and piriformis syndrome: diagnosis by magnetic resonance neurography and interventional magnetic resonance imaging with outcome study of resulting treatment.» (PDF). Journal of Neurosurgery: Spine 2 (2): 99-115. PMID 15739520. doi:10.3171/spi.2005.2.2.0099. Archivado desde el original el 12 de mayo de 2014.
Dolor de ciática – Causas y Tratamiento – Dolores-de.com». «Non-steroidal anti-inflammatory drugs for low back pain».
Editorial Ciática: una interpretación histórica Dr. Roberto Coronado Zarco,* Dr. Juan Carlos Macedo González,** Dra. María De La Paz Gutiérrez Parra***





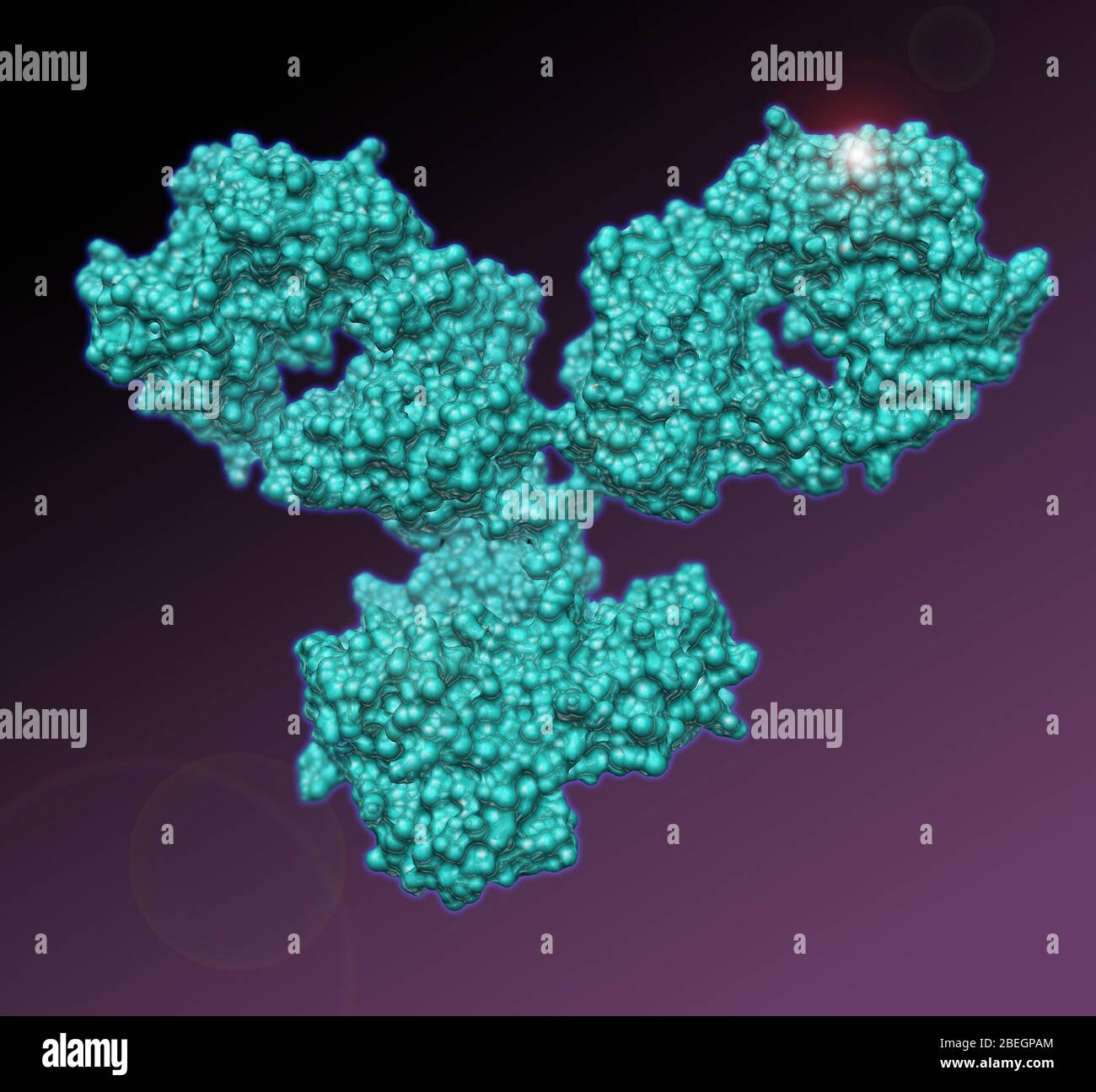
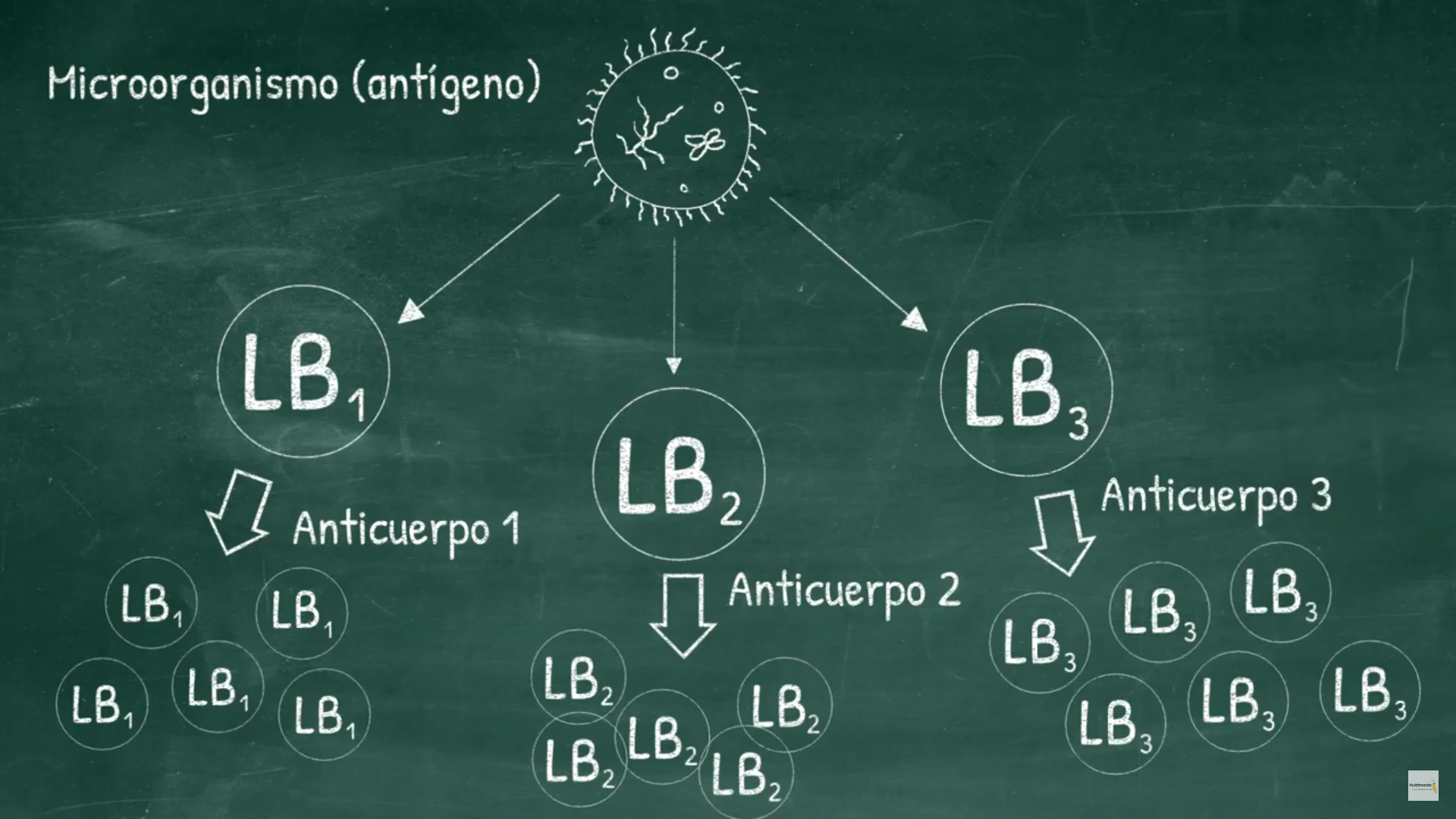 Esta mezcla fisiológica natural de anticuerpos es conocida como antisuero policlonal. Para producir anticuerpos monoclonales, primero se extraen células B del bazo de un animal que ha sido expuesto al antígeno. Estas células B son fusionadas en presencia de PEG (polietilenglicol) con células tumorales de mieloma múltiple , que pueden crecer indefinidamente en cultivo celular.
Esta mezcla fisiológica natural de anticuerpos es conocida como antisuero policlonal. Para producir anticuerpos monoclonales, primero se extraen células B del bazo de un animal que ha sido expuesto al antígeno. Estas células B son fusionadas en presencia de PEG (polietilenglicol) con células tumorales de mieloma múltiple , que pueden crecer indefinidamente en cultivo celular. 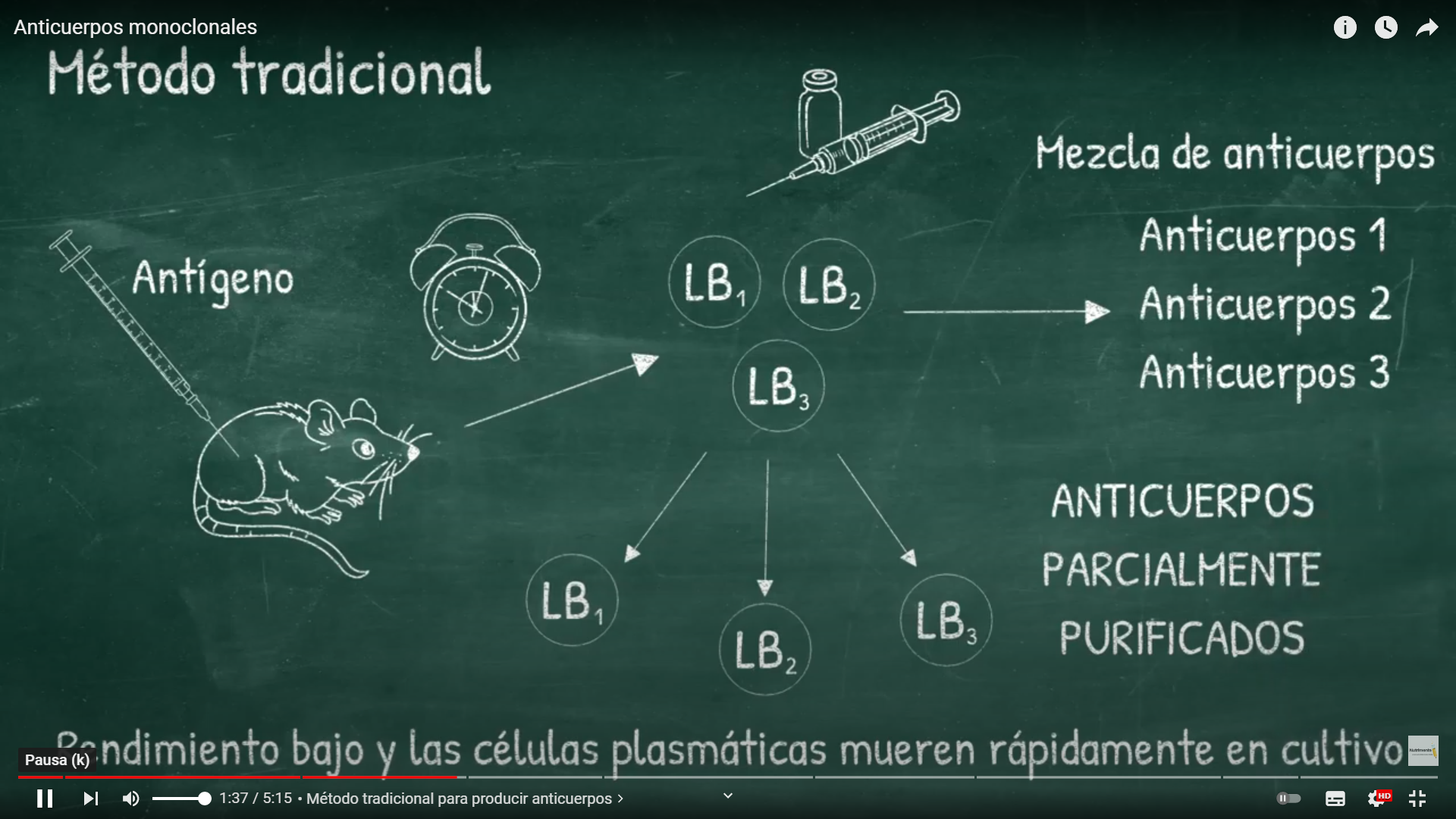 Estas células fusionadas híbridas, llamadas hibridomas pueden multiplicarse rápida e indefinidamente (ya que son células tumorales después de todo) y pueden producir gran cantidad de anticuerpos. Los hibridomas son suficientemente diluidos y cultivados para obtener un número diferente de determinadas colonias, las cuales producen sólo un tipo de anticuerpo. Los investigadores Niels K. Jerne, Georges Köhler y Cesar Milstein, describieron la técnica que permitía el cultivo de hibridomas o células híbridas de linfocitos B con células plasmáticas tumorales de mieloma múltiple.
Estas células fusionadas híbridas, llamadas hibridomas pueden multiplicarse rápida e indefinidamente (ya que son células tumorales después de todo) y pueden producir gran cantidad de anticuerpos. Los hibridomas son suficientemente diluidos y cultivados para obtener un número diferente de determinadas colonias, las cuales producen sólo un tipo de anticuerpo. Los investigadores Niels K. Jerne, Georges Köhler y Cesar Milstein, describieron la técnica que permitía el cultivo de hibridomas o células híbridas de linfocitos B con células plasmáticas tumorales de mieloma múltiple. 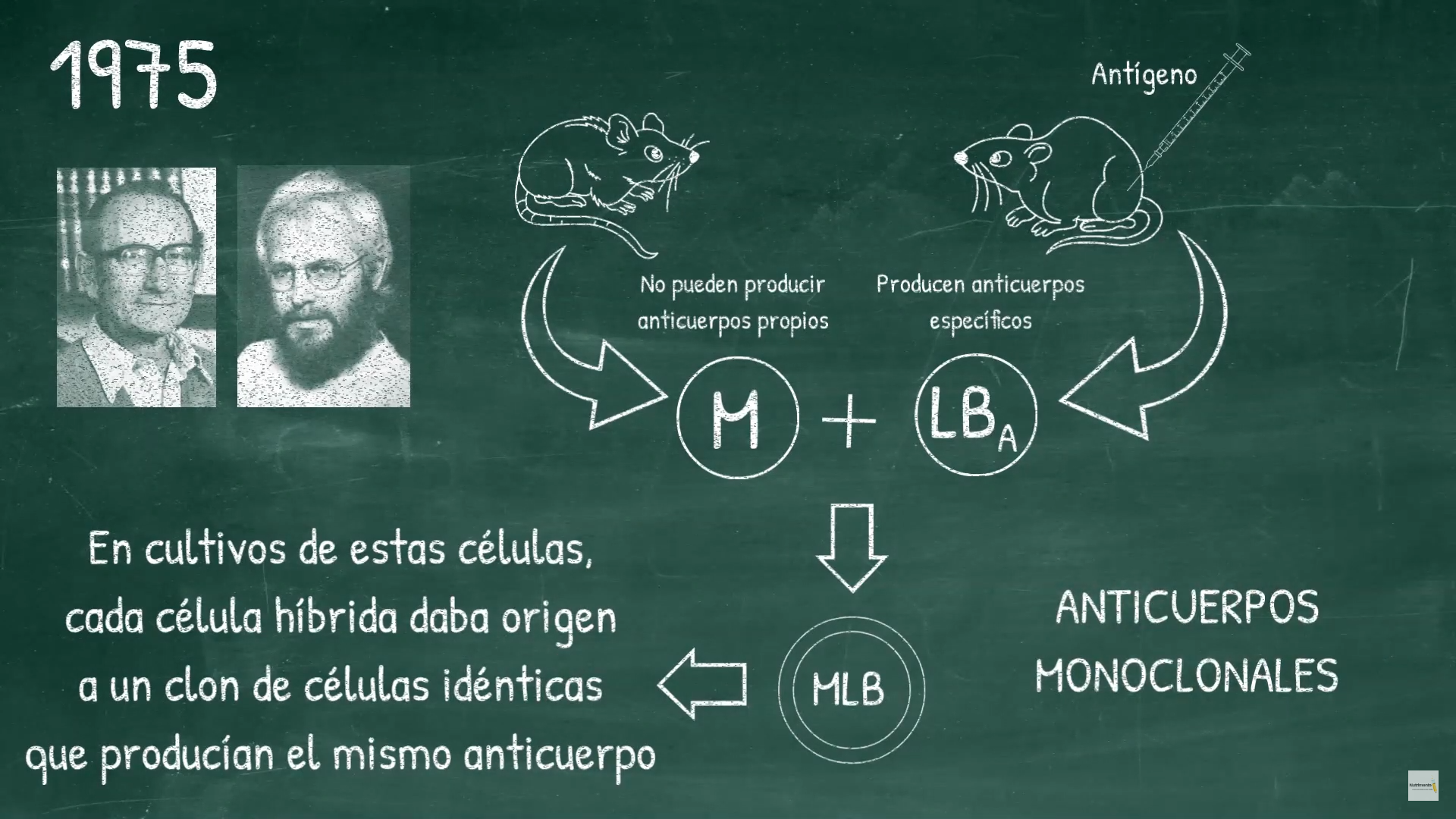
 Niels K. Jerne, Georges Köhler y Cesar Milstein
Niels K. Jerne, Georges Köhler y Cesar Milstein
 Friedrich Nietzsche nació en 1844 y murió en 1900 (Friedrich Nietzsche, hacia 1900.
Friedrich Nietzsche nació en 1844 y murió en 1900 (Friedrich Nietzsche, hacia 1900.