La idea de que las enfermedades neurodegenerativas, sobre todo el Alzheimer , estarían producidas por gérmenes sobre los que se depositan posteriormente macrófagos, TAU y Beta amiloide, es conocida.
Pero ahora se imbrincan el papel de los genes APOE y SLC1A2 en la sobreexpresión de estos genes se relaciona con su acumulación cerebral.
Desde hace años se conoce el papel de la proteína tau en el desarrollo de la enfermedad de Alzheimer (EA), como también la importancia de los genes APOE y SLC1A2, aunque sin haberse establecido una relación clara entre todos ellos.
Un nuevo trabajo ha descrito por primera vez la asociación entre la acumulación de tau en determinadas zonas del cerebro y la sobreexpresión de APOE y SLCA1A2 en las mismas áreas.
«Cada región del cerebro tiene una composición diferente que atiende a su funcionalidad y a los tipos de células que hay, lo que hace que pueda haber más o menos sobreexpresión de la proteína», explica Víctor Montal.
La proteína tau tiene una función fisiológica muy importante, ya que es la encargada de mantener la estructura de las neuronas. Sin embargo, cuando esta proteína se fosforila, es decir, se produce la adición de un grupo fosfato, pierde esta función y acaba provocando la desintegración de la estructura neuronal.
APOE y SLC1A2, y laTau
Los investigadores estudiaron el patrón de propagación de tau en el cerebro por medio de técnicas de imagen PET y estudiaron su asociación con datos genéticos empleando técnicas transcriptómicas de alta resolución. «Observamos que existen gradientes específicos a lo largo de la red de propagación de tau en el cerebro. En particular, identificamos 577 genes cuya expresión está asociada con la propagación espacial de tau»,  Víctor Montal, investigador del IIB Sant Pau y primer firmante del artículo. Foto: IIB SANT PAU.
Víctor Montal, investigador del IIB Sant Pau y primer firmante del artículo. Foto: IIB SANT PAU.
De estos genes, los que tienen una mayor relevancia son APOE, que se ha asociado en múltiples estudios a la enfermedad de Alzheimer, y SLC1A2, un gen transportador del glutamato.
«Lo que observamos es que en aquellas regiones en las que se comenzaba a acumular tau inicialmente había dos genes que tenían mucha más expresión en comparación a las regiones en las que se acumulaba tau de forma más tardía.
¿Cómo se comportan estos genes?
Desde hace años se conoce que el gen APOE está muy relacionado con la acumulación de la proteína beta-amiloide y ahora varios trabajos están demostrando que «este gen está también muy relacionado con la proteína tau. La función de APOE es de transportador de lípidos a las neuronas y se expresa especialmente en los astrocitos».
«El otro gen, SLC1A2, es un transportador del glutamato. Es decir, coge el neurotransmisor glutamato de la hendidura sináptica y lo introduce en la neurona. Esto es muy interesante porque varios estudios han reportado que las neuronas excitatorias son más vulnerables a sufrir patología tau. De este modo, lo que hemos corroborado es que este gen puede ser la responsable de esta mayor vulnerabilidad en este grupo neuronal”, añade este investigador.
La hipótesis de los investigadores se resume en que tanto APOE como SLC1A2 pueden ser los responsables de promover una vulnerabilidad selectiva en algunas regiones cerebrales y poblaciones neuronales específicas a acumular tau (y no otras), dando lugar a la sintomatología característica de la enfermedad de Alzheimer.
«Las estrategias que se han diseñado hasta ahora para el tratamiento de la enfermedad de Alzheimer han resultado mayoritariamente un fracaso. Es una urgencia comprender mejor que sucede a nivel de bioquímica en esta enfermedad para poder desarrollar nuevas estrategias y nuestro trabajo profundiza en este sentido.
Pero al mismo tiempo, la infección no termina de ser desechada.
Las infecciones tratadas con atención hospitalaria especializada en edad temprana y media de la vida se asocian con un mayor riesgo posterior de padecer enfermedades neurodegenerativas como Alzheimer (EA) y Parkinson (EP), pero no la esclerosis lateral amiotrófica (ELA), según un nuevo estudio desarrollado en el Instituto Karolinska y publicado en PLOS Medicine.
En el nuevo estudio, los investigadores utilizaron datos de personas diagnosticadas con EA, EP o ELA entre 1970 y 2016 en Suecia, así como cinco controles emparejados por caso, todos identificados a partir del Registro Nacional de Pacientes de Suecia. El análisis incluyó 291.941 casos de EA, 103.919 de EP y 10.161 de ELA. Una infección tratada en el hospital 5 o más años antes del diagnóstico se asoció con un 16% más de riesgo de EA y un 4% más de riesgo de EP, con riesgos similares observados para las infecciones bacterianas, víricas y de otro tipo y para los diferentes sitios de infección. El mayor riesgo de enfermedad se observó en personas con múltiples infecciones tratadas en el hospital antes de los 40 años, con más del doble de riesgo de EA y más de un 40% de aumento del riesgo de EP. No se observó ninguna asociación para la ELA, independientemente de la edad en el momento del diagnóstico.
Estos hallazgos sugieren que los eventos infecciosos pueden ser un desencadenante o amplificador de un proceso de enfermedad preexistente, lo que lleva a la aparición clínica de la enfermedad neurodegenerativa a una edad relativamente temprana, pero los autores advierten que, dada la naturaleza observacional del estudio, estos resultados no prueban formalmente una relación causal.
Nuevos fármacos para APOE
Así, es posible que se desarrollen nuevos fármacos que tengan como diana el gen APOE y para estos ensayos será muy importante poder seleccionar a los pacientes que obtendrían un beneficio mayor de participar.
«Saber cuanto de avanzada está la enfermedad en función de la expresión de APOE nos ayudará a diferenciar sujetos, pero a nivel práctico, la mejora del diagnóstico de la enfermedad no mejorará con nuestro trabajo”, puntualiza Montal, quien recalca que lo novedoso de su trabajo está no tanto en conocer el papel de tau en el desarrollo del Alzheimer como en entender el rol muy importante del gen APOE en la propagación de esta proteína».
Gérmenes en las enfermedades neurodegenerativas
Todas las enfermedades neurodegenerativas se caracterizan por el acumulo de proteínas en lugares múltiples que bloquean de forma progresivas , no solo funciones nerviosas sino múltiples estructuras de nuestra economía

Células de levaduras en depósitos de Amiloide
Es bastante probable que las enfermedades degenerativas y concretamente las neurodegenerativas, tengan un patrón microbiano y desde aquí desarrollen una respuesta inmunitaria que sea responsable de la destrucción cerebral
El Parkinson que se caracteriza por perdida de las estructuras dopaminérgicas donde se depositan las proteínas cuerpos de Lewy.
Los cuerpos de Lewy son depósitos anormales de proteína llamada alfa-sinucleína. Que son propias en la demencia producidas por estosl deposito de Pero saben que otras enfermedades, como el mal de Parkinson, también involucran la acumulación de esta proteína.
Demencia con cuerpos de Lewy y demencia por enfermedad de Parkinson. Ambos tipos causan los mismos cambios en el cerebro, y, con el tiempo, provocan los mismos síntomas. La principal diferencia es cuándo los síntomas cognitivos (del pensamiento) y del movimiento comienzan.
También la demencia con cuerpos de Lewy causa problemas con la habilidad de pensar similar a la enfermedad de Alzheimer . Posteriormente, causa otros problemas, como síntomas de movimiento, alucinaciones visuales y ciertos problemas del sueño. También causa más problemas con las actividades mentales que con la memoria.
La demencia por enfermedad de Parkinson comienza como un trastorno del movimiento. Primero causa los síntomas de la enfermedad de Parkinson, movimientos lentos, rigidez muscular, temblor y caminar arrastrando los pies. Más adelante, causa demencia.
La demencia con cuerpos de Lewy ocurre cuando se acumulan cuerpos de Lewy en partes del cerebro que controlan la memoria, el pensamiento y el movimiento.
Otras dos enfermedades neurodegenerativas tienen un acumulo anormal de proteínas, que actúan como macrofagos
El Alzheimer (AL) es una enfermedad neurodegenerativa, y la causa principal y más conocida en enfermedades demenciales, cuya característica principal es la pérdida de memoria. Su relación con la proteína amiloide y tau es indiscutible. Su acumulo en el lóbulo temporal entre otras zonas del cerebro mutila la funciones cognoscitiva y produce demencia.
La administración de proteínas beta-amiloide fuera del cerebro, concretamente se inyectó en el vientre de los ratones y no en el cerebro. Aunque los sistemas inmunes de estos ratones estaban preparados para atacar al aislante nervioso o mielina, con la administración de la beta-amiloide se produjo todo lo contrario.
Así lo expresa Steinman: “Esta es la primera vez que la beta amiloide demuestra tener propiedades antiinflamatorias”
En definitiva, la beta-amiloide fuera del sistema nervioso central tendría propiedades como antiinflamatorio, todo lo contrario a lo que produce cuando se encuentra dentro del mismo cerebro o de los nervios.
El juego inflamatorio en enfermedades degenerativas, llegan siempre a las misma situaciones, un problema de inflamación y reparación complejo e imbricado.
No es la primera vez que se analizan las propiedades de la beta amiloide, El Hospital General de Massachusetts (MGH,), evidencio que la proteína beta-amiloide se deposita en forma de placas en el cerebro de pacientes con enfermedad de AL y se la considera una parte normal del sistema inmune innato, primera línea de defensa del cuerpo contra la infección.
Su estudio, publicado en ‘Science Translational Medicine’, concluye que la expresión de beta-amiloide humana resulta protectora contra las infecciones potencialmente letales en ratones, en el C elegans y en células cerebrales humanas en cultivo.
Se admite que la neurodegeneración en la enfermedad de AL es causada por el comportamiento anormal de moléculas de beta-amiloide, que son conocidas por reunirse en resistentes estructuras de fibrillas llamadas placas amiloides en el cerebro de los pacientes
En 2010 , Moir y Rudolph Tanzi, director del MGH-MIND y concluyeron que la beta-amiloide tenía muchas de las cualidades de un péptido antimicrobiano (AMP) y se trata de una pequeña proteína innata del sistema inmune que protege contra una amplia gama de patógenos.
En ese estudio se compararon formas sintéticas de A-beta con un conocido AMP llamado LL-37 y se encontró que la beta inhibe el crecimiento de varios patógenos importantes, a veces igual de bien o mejor que LL-37. La beta amiloide de los cerebros de los pacientes de AL también suprimió el crecimiento del hongo ‘Candida’ cultivado para esa investigación y, posteriormente, otros grupos han documentado la acción de A-beta sintético contra los virus de influenza y herpes.
En este nuevo trabajo, los investigadores encontraron que los ratones transgénicos que expresan A-beta humano sobrevivieron significativamente más tiempo después de inducir la infección por ‘Salmonella’ en sus cerebros frente a los ratones sin alteración genética. Los ratones que carecen de la proteína precursora de amiloide murieron incluso más rápidamente.
La expresión de la beta transgénica parece proteger a los gusanos ‘C.elegans’ de cualquier infección por ‘Candida’ o ‘Salmonella’. Del mismo modo, la expresión de beta humana protege las células neuronales cultivadas de ‘Candida’. De hecho, la beta amiloide humano expresado por células vivas parece ser mil veces más potente contra la infección que el beta amiloide sintético utilizado en estudios previos.
Esa superioridad parece referirse a propiedades de beta amiloides que se han considerado parte de la patología en la enfermedad AL, la propensión de moléculas pequeñas a combinarse en lo que se denominan oligómeros y luego se agregan en placas de beta-amiloide.
Moir añade: “Nuestros resultados plantean la intrigante posibilidad de que puede surgir la patología de AL, cuando el cerebro se percibe a sí mismo como bajo el ataque de los patógenos invasores, aunque se necesitan estudios adicionales. No parece probable que las vías inflamatorias del sistema inmune innato puedan ser posibles dianas de tratamiento. Si se validan, nuestros datos también justifican la necesidad de tener precaución con terapias dirigidas a la eliminación total de las placas de beta-amiloide. Las terapias basadas en la disminución de amiloides, pero no en la eliminación de beta amiloide en el cerebro podría ser una estrategia mejor”.
Un nuevo estudio de la Universidad de Florida, en Estados Unidos, establece, por primera vez, un vínculo entre especies específicas de bacterias y manifestaciones físicas de enfermedades neurodegenerativas.
Investigaciones recientes sugieren que las personas con estas enfermedades presentan cambios en la composición bacteriana de su tracto digestivo.
Una nueva investigación publicada en ‘PLOS Pathogens’ establece, por primera vez, un vínculo entre especies específicas de bacterias y manifestaciones físicas de enfermedades neurodegenerativas.
Algunas otras bacterias producen compuestos que contrarrestan estas bacterias ‘malas’. Estudios recientes han demostrado que los pacientes con la enfermedad de Parkinson y de Alzheimer son deficientes en estas bacterias ‘buenas’, por lo que nuestros hallazgos pueden ayudar a explicar esa conexión y abrir un área de estudio futuro», añade.
Todas las enfermedades neurodegenerativas tienen su origen en en el manejo de las proteínas en el organismo. Si las proteínas están mal plegadas, se acumulan en los tejidos. Estos agregados de proteínas, como los llaman los científicos, interfieren en el funcionamiento de las células y provocan trastornos neurodegenerativos.
Czyz y sus coautores querían saber si la introducción de ciertas bacterias en los gusanos ‘C. elegans’ iría seguida de la agregación de proteínas en los tejidos de los gusanos.
» Con una forma de marcar los agregados para que brillen en verde bajo el microscopio, se vio que los gusanos colonizados por ciertas especies de bacterias se iluminaban con agregados que eran tóxicos para los tejidos, mientras que los colonizados por las bacterias de control no lo hacían. Esto ocurría no sólo en los tejidos intestinales, donde están las bacterias, sino en todo el cuerpo de los gusanos, en sus músculos, nervios e incluso órganos reproductores».
Sorprendentemente, las crías de los gusanos afectados también mostraron un aumento de la agregación de proteínas, a pesar de que estas crías nunca se encontraron con las bacterias originalmente asociadas a la enfermedad.
«Esto sugiere que estas bacterias generan algún tipo de señal que puede transmitirse a la siguiente generación»,
En la actualidad, el laboratorio de Czyz está probando cientos de cepas de bacterias presentes en el intestino humano para ver cómo afectan a la agregación de proteínas en ‘C. elegans’. El grupo también investiga cómo las bacterias asociadas a la neurodegeneración provocan el mal plegamiento de las proteínas a nivel molecular.
Czyz también está interesado en las posibles conexiones entre las bacterias resistentes a los antibióticos y el mal plegamiento de las proteínas.
Lo que se deduce de estos estudios, es que el deposito de proteínas mal plegadas, se hace sobre gérmenes previos y no al revés. Pero ahora además se termina el dilema encontrando los genes que motivan el problema, que serian los promotores de todo el cuadro
Genes, Germenes, TAU y Beta Amiloide
Varios autores sobre todo Carrasco y Moir, han repetido de forma machacona, como los gérmenes están presentes en las enfermedades neurodegenerativas y que los depositos de proteínas plegadas que son macrófagos es un intento del organismo por eliminar estos gérmenes.
Bibliografia
Víctor Montal, investigador del IIB Sant Pau
Miguel Ramudo. Barcelona Mar, 20/09/2022 – 14:00
Carrasco y Moir Enriquerubio.net
Science Translational Medicine: Instituto de Investigación del Hospital de la Santa Creu i Sant Pau de Barcelona (IIB Sant Pau) y del Hospital General de Massachussetts
Czyz y los gusanos ‘C. elegans’
Steinman: “la beta amiloide demuestra tener propiedades antiinflamatorias

 maría inés lópez-ibor,catedrática de psiquiat
maría inés lópez-ibor,catedrática de psiquiat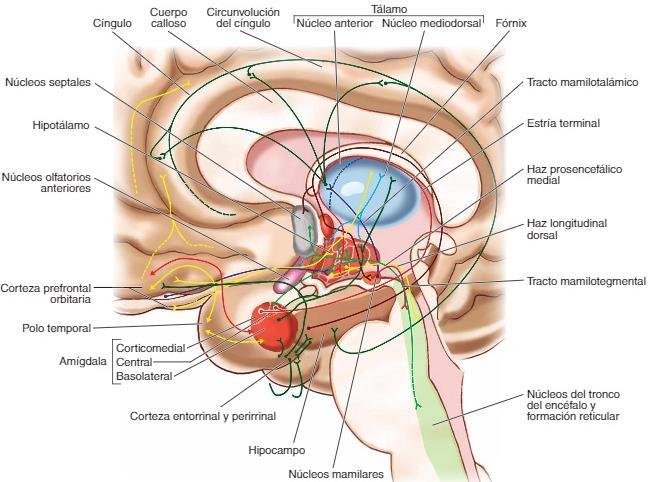 ría; indaga sobre la alegría
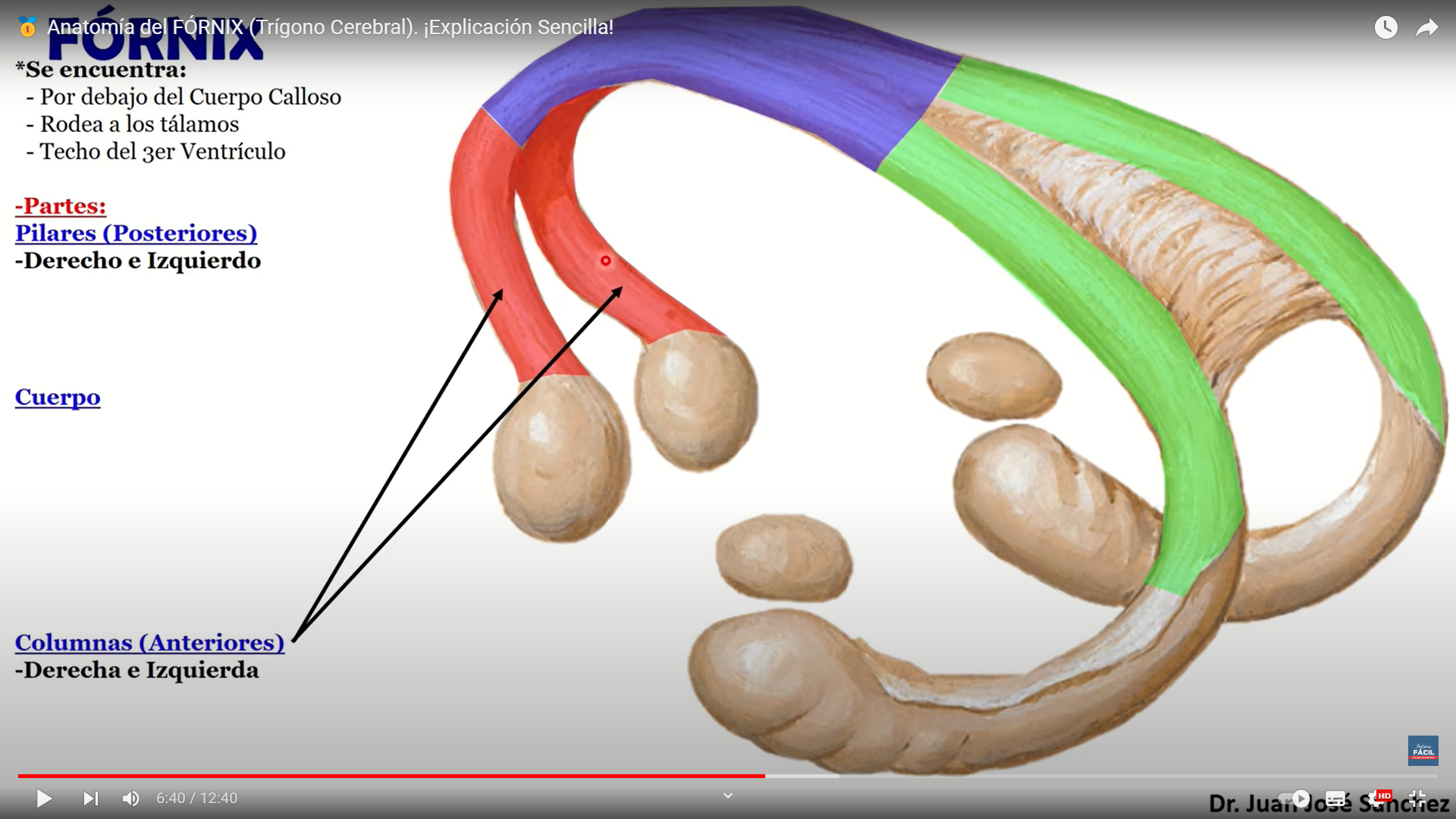
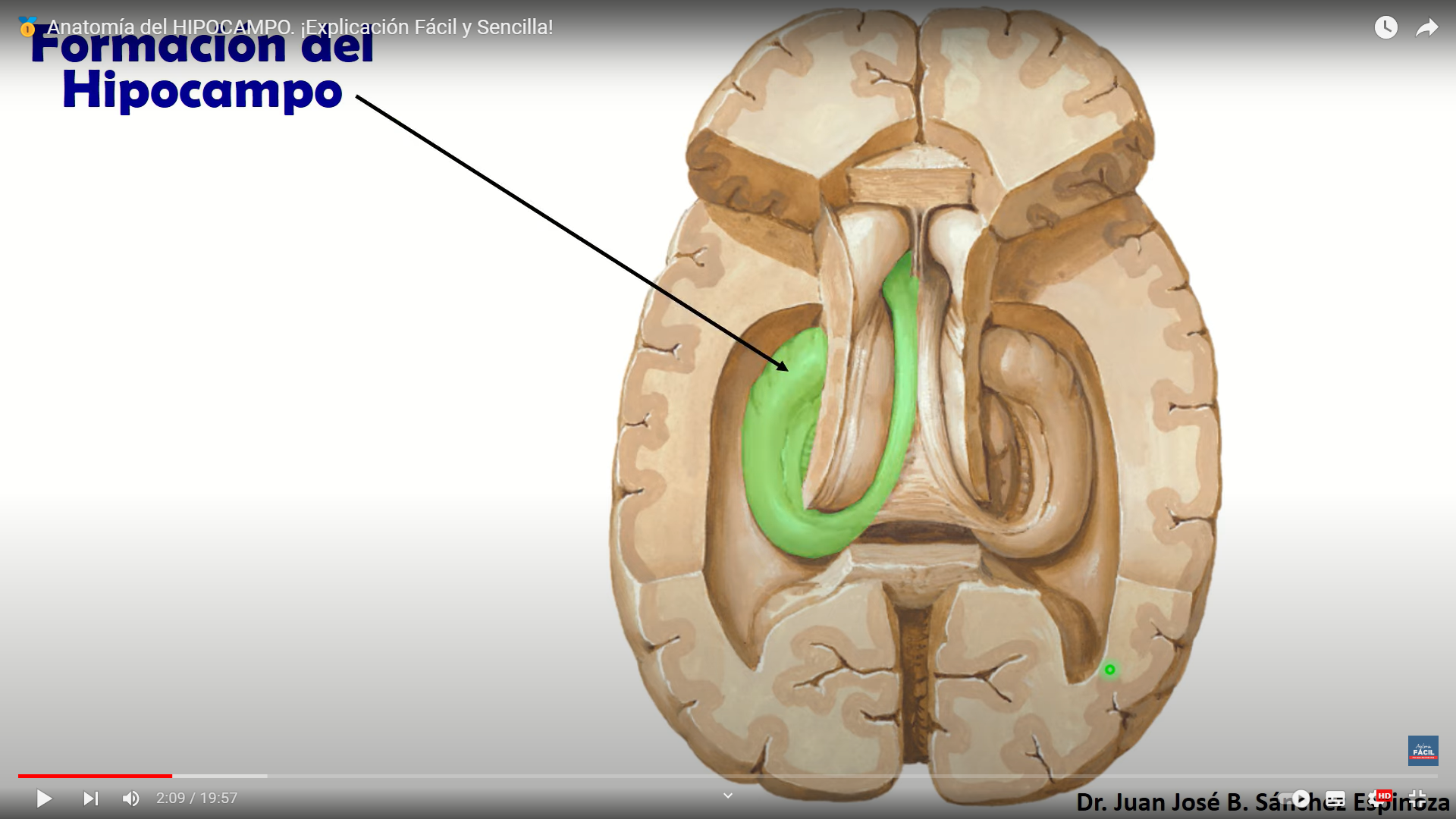
ría; indaga sobre la alegría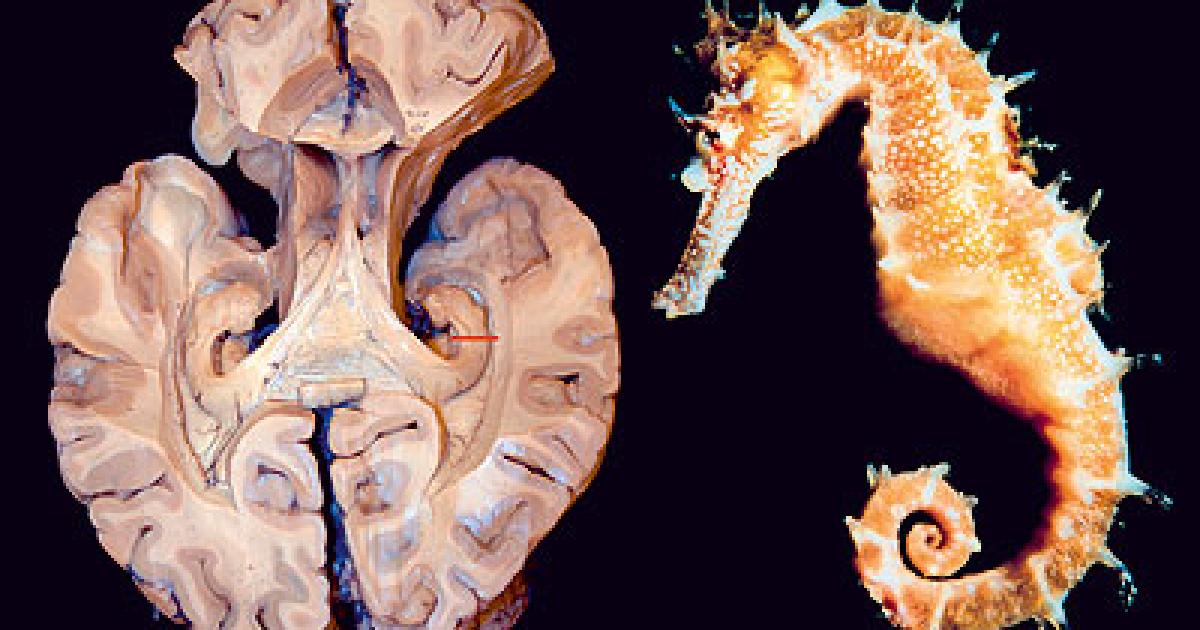 esta estructura es fundamental para el almacenamiento de la memoria a largo plazo también parece que se asocia a la llamada memoria episódica y a la memoria espacial las personas con daños en el hipocampo no pueden almacenar la información con lo que sin perder la capacidad de aprendizaje no recuerdan lo acontecido un tiempo
esta estructura es fundamental para el almacenamiento de la memoria a largo plazo también parece que se asocia a la llamada memoria episódica y a la memoria espacial las personas con daños en el hipocampo no pueden almacenar la información con lo que sin perder la capacidad de aprendizaje no recuerdan lo acontecido un tiempo