recientes sugieren
recientes sugieren
HIPOCAMPO: NEUROGÉNESIS MEMORIA Y APRENDIZAJE
La generación de nuevas neuronas en el cerebro de los mamíferos, incluyendo el cerebro humano, es un fenómeno descrito desde hace ya varios años. Dicho fenómeno se conoce como neurogénesis y ocurre únicamente en dos regiones del cerebro adulto; la pared de los ventrículos laterales y el giro dentado del hipocampo.
La presencia de neurogénesis se ha asociado a múltiples factores entre los que destaca el aprendizaje y su respectiva consolidación denominada memoria. Un número considerable de trabajos realizados en roedores han mostrado que cuando se aprende una tarea, el número de nuevas neuronas en el giro dentado del hipocampo se incrementa de forma abundante. Lo cual sugiere que el aprendizaje es un factor que estimula la proliferación de nuevas neuronas, muchas de las cuales no sobreviven y pocas se integran al circuito cerebral para ser funcionales.
Aprendizaje y memoria
MEMORIA ALARGO PLAZO
El segundo gran bloque de la memoria individual es la memoria a largo plazo que a su vez se divide, en memoria explícita y memoria implícita.
La primera se refiere a todos los conocimientos conscientes que tenemos sobre eventos del pasado para términos de practicidad tenemos dos grandes bloques de memoria explícita la episódica y la semántica así los recuerdos que tenemos sobre experiencias personales específicas o eventos autobiográficos cómo saber quién es tu familia qué hiciste ayer cuál es tu profesión etcétera corresponde a la memoria episódica mientras que los recuerdos semánticos están relacionados a los conocimientos léxicos o conceptuales que no necesariamente están vinculados a una experiencia personal es decir tú sabes el concepto de adicción que implica agregarle un valor anterior a otro valor todos lo aprendimos en el colegio sin embargo no necesariamente recordamos el momento exacto de este aprendizaje por tanto la memoria explícita semántica corresponde a todos los conocimientos que tenemos sobre loque son las cosas, dentro de sus características se encuentra que el aspecto emocional que no juega un rol tan importante como en la memoria episódica y tiende al olvido es decir puedes la factorización que viste en tu secundaria pero si los pares craneales de tu clase de neuroanatomía y que son un conocimiento más reciente el segundo bloque de memoria a largo plazo es la memoria implícita que también es conocida como memoria procedimental esto debido a su rol de automatización de las acciones ya que no requiere de un control consciente para realizar actos aprendidos anteriormente. Para montar en bici no es necesario recordar que recordar paso por paso como pones tus pies sobre el pedal ni mucho menos controlas la forma como se da el equilibrio este. Este tipo de memoria se automatiza con la práctica. Cuando se aprende a montar en bicicleta se utiliza el consciente y después se convierte en un automatismo.
Dentro de la memoria implícita hay dos grandes bloques la implícita asociativa y la no asociativa la primera va a corresponder a todos los aprendizajes generados mediante la asociación de estímulos donde encontramos el condicionamiento clásicoy el operante y por último en la memoria explícita no asociativa tenemos la procedimental ya que es mediante la sumación de pasos que se va a generar un aprendizaje el ejemplo de la bicicleta anteriormente mencionado nos puede servir acá también ya que vamos a utilizar diferentes procedimientos motores para poder lograr montar la bicicleta como sentarnos impulsarnos mover los pedales y los brazos van a controlar la dirección ahora bien ya teniendo nuestro esquema de memoria completo vale la pena explicar cómo se da el proceso de codificación de la información para esto vamos a tener en cuenta tanto las características del estímulo como las del sujeto y que juntos interactúan para que se den los cambios neuro estructurales a nivel del hipocampo y corteza cerebral para las características del estímulo tenemos la intensidad del estímulo es decir la duración del mismo la carga emocional que le otorguemos el estímulo y la frecuencia con la que se presente así por ejemplo si un día alguien nos asalta la carga emocional y la intensidad de ese estímulo van a ser suficientes para que aprendamos a no andar por una calle específica en este caso la frecuencia de la ocurrencia del mismo no es tan necesaria como la que necesitamos para aprender a andar en bicicleta o manejar un coche ahora bien las características del individuo también van a ser importantes para la memorización como lo es el estado de activación del individuo l as estrategias que emplee y la experiencia previa con el estímulo es por esto que pese a que un tema sea fácil si nuestro estado de arousal es bajo o tenemos sueño el aprendizaje no se consolida y cuando queremos aprender un tema y tenemos estrategias como utilizar nemotecnia o mapas conceptuales
Adaptativamente, el aprendizaje y la memoria son procesos cognitivos vitales para los organismos que forman parte del reino animal. El ambiente es un entorno cambiante, por lo que animales que viven en ambientes que cambian continuamente necesitan de una plasticidad conductual.
La plasticidad es una propiedad de los sistemas biológicos que les permite adaptarse a los cambios del medio para sobrevivir, la cual depende de los cambios fisiológicos que ocurran al interior. En este sentido, el sistema nervioso posee una plasticidad altamente desarrollada y evidente en las primeras etapas del desarrollo, sobre todo en los mamíferos. A nivel neuronal los cambios plásticos pueden ser visualizados a través de un incremento del árbol dendrítico y del número de espinas dendríticas, que mejoran los contactos sinápticos y en consecuencia la comunicación entre las neuronas. Desde hace tiempo se sabe que el aprendizaje y la memoria son eventos que favorecen la plasticidad, y entre cuando más plástico es el sistema nervioso mayor es la capacidad de aprendizaje de los organismos.
El aprendizaje puede considerarse como una modificación estructural y funcional del sistema nervioso queda como resultado un cambio en la conducta relativamente permanente. 
La información aprendida es retenida o almacenada en los circuitos neuronales que forman el cerebro y constituye lo que denominamos memoria.
La memoria es la consecuencia usual del aprendizaje y difícilmente nos referimos a alguno de estos términos de manera independiente.
En los mamíferos se han descrito diferentes tipos de memoria y cada uno de estos tipos involucra la participación de áreas cerebrales y neurotransmisores específicos.
De acuerdo a las características conductuales y las estructuras cerebrales implicadas, se han caracterizado tres tipos de memoria:
la de trabajo, la implícita y la explícita 1.
La memoria de trabajo también llamada cognición ejecutiva, consiste en la representación consciente y manipulación temporal de la información necesaria para realizar operaciones cognitivas complejas, como el aprendizaje, la comprensión del lenguaje o el razonamiento 2, 3.
La corteza prefrontal podría ser el lugar sede de esta memoria, además se sugiere que esta estructura cerebral podría funcionar como un lugar “on line” durante cortos periodos de tiempo de representaciones de estímulos ausentes 4.
Por otra parte, la memoria implícita, procedimental o no declarativa es la memoria de las cosas que hacemos rutinariamente.
Se le considera automática, inconsciente y difícil de verbalizar. Su adquisición es gradual y se perfecciona con la práctica. Este tipo de memoria deriva de tipos de aprendizaje básico, como la habituación y la sensibilización, el aprendizaje perceptivo y motor o el condicionamiento clásico e instrumental5. Anatómicamente, la memoria implícita requiere de diferentes estructuras cerebrales que han sido involucradas con el aprendizaje procidemental, por ejemplo, los ganglios basales con el aprendizaje de hábitos y habilidades 6, el cerebelo con los condicionamientos de respuestas motoras 7 y la amígdala con los condicionamientos emocionales 8. Aunque el sitio principal de almacenamiento de esta memoria radica en estructuras subcorticales y en algunos casos depende directamente del neocortex 9.
La memoria explícita, también conocida como memoria declarativa, relacional o cognitiva es el almacenamiento cerebral de hechos (memoria semántica) y eventos (memoria episódica) 10, 11 ,12. Este tipo de memoria se adquiere en pocos ensayos a diferencia de la memoria implícita y se distingue por expresarse en situaciones y modos diferentes a los del aprendizaje original, por lo que es considerada como una memoria de expresión flexible. Un tipo de memoria declarativa es la memoria espacial que consiste en múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales 13, 14, 15. El hipocampo parece ser la estructura cerebral que está críticamente relacionado en este tipo de memoria declarativa 16, 17.
Sustrato anatómico de la memoria declarativa: el hipocampo
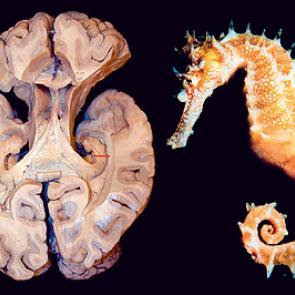
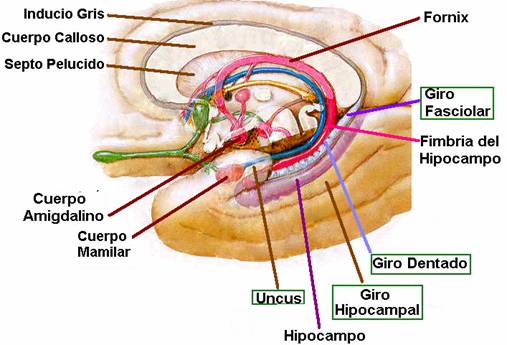
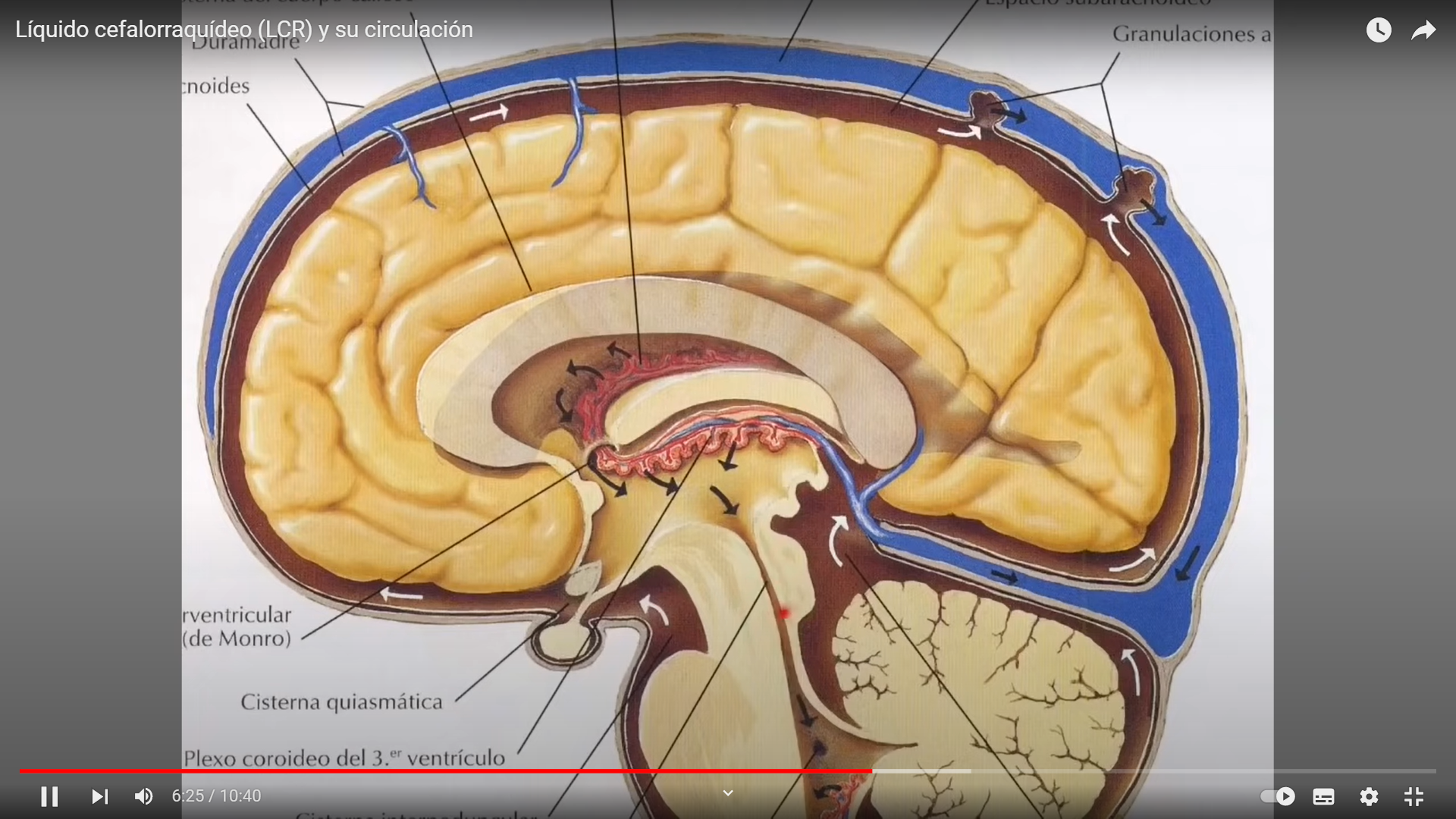
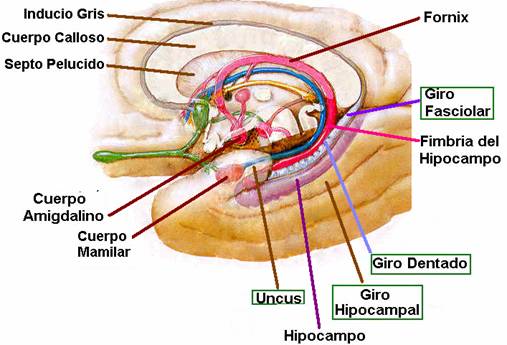
El hipocampo deriva de la región medial del telencéfalo, forma parte del sistema límbico y tiene un papel importante en la adquisición del aprendizaje espacial y la consolidación de la memoria a largo y corto plazo. Anatómicamente, está organizado en el cuerno de Amón (hipocampo propio) y el giro dentado(separados por la fisura hipocampal); el complejo subicular,22 www.uv.mx/rm formado por el presubiculum, el subiculum y el parasubiculum; y la corteza entorrinal 18, 19, 20.
El cuerno de Amón está dividido en tres áreas: CA1,CA2 y CA3 (figura 1).La mayor entrada de fibras en el hipocampo proviene de la corteza parahipocampal que es la principal vía de entrada de aferencias neocorticales de procesamiento provenientes de distintas áreas dorsales, como la corteza parietal posterior, la corteza retrosplenial, la corteza prefrontal dorsolateral o de la parte dorsal del surco temporal superior estructuras estrechamente asociadas en la codificación de la localización espacial de los estímulos 21, 22. Estas aferencias son distribuidas hacia la corteza entorrinal. Las células de las capas II y III de esta corteza envían sus axones hasta el giro dentado y el hipocampo a través de la vía perforante, atravesando la capa de células piramidales del subiculum 23, 24. Por otra parte, las neuronas piramidales de la región CA3 proyectan sus axones hacia las dendritas de las neuronas piramidales de las CA1 mediante los colaterales de Schaffer. Así mismo, los axones provenientes de la región CA3 proyectan hacía todo el hipocampo mediante proyecciones comisurales, entre hemisferios y/o asociativas, en el mismo hemisferio 25, 26, 27. Mientras que las neuronas granulares del giro dentado proyectan sus axones o fibras musgosas hacia las dendritas proximales de las neuronas piramidales de la región CA3, atravesando el hilus 28, 29. El circuito del procesamiento de la información de la memoria declarativa es el llamado circuito trisináptico 30. Este circuito inicia en la vía perforante de la corteza entorrinal. Primeramente, las neuronas de la corteza entorrinal envía sus proyecciones hacía las células granulares del giro dentado. Enseguida, estás células proyectan sus axones hacia las neuronas piramidales de la región CA3, las cuales finalmente envían sus axones hasta las neuronas piramidales de la región CA1 mediante los colaterales de Schaffer (figura 1). La información procesada mediante este circuito trisináptico permite relacionar diferentes aferencias sensoriales pertenecientes a diversos estímulos gracias a que las células piramidales del hipocampo tienen un alto grado de interconexión, facilitando las relaciones entre las diferentes entradas de información 31.
Hipocampo y memoria declarativa
Actualmente existe amplia evidencia del papel crítico que juega el hipocampo en la memoria declarativa. Las lesiones en el hipocampo y sus conexiones subcorticales en pacientes con amnesia producen déficits selectivos en la memoria declarativa, sin embargo la capacidad de distinguir nuevos objetos con base en su familiaridad permanece intacta 32, 33. Además se observó que en estos pacientes el hipocampo tiene la función de mantener la habilidad de asociar objetos en la memoria y recordar asociaciones contextuales en comparación con el recuerdo de objetos únicos con base en su familiaridad 34, 35. Otros estudios clínicos han mostrado que la corteza parahipocampal se activa durante la presentación de escenas espaciales o durante la memorización de objetos relacionados fuertemente con lugares específicos 36, 37. El hipocampo es, por tanto, unaestructura crítica para procesar y recordar información espacialy contextual.La participación del hipocampo en la memoria explícitaha sido estudiada por medio de la memoria espacial. La memoriaespacial consiste en múltiples mecanismos especializados encodificar, almacenar y recuperar información acerca de rutas,configuraciones y localizaciones espaciales 13, 14, 15. Esta memoria puede ser evaluada en humanos y en modelos animales, en los cuales la solución de la tarea depende de la información disponible. Experimentos con ratas han mostrado que las lesiones hipocampales afectan negativamente la adquisición y retención del aprendizaje espacial cuándo las ratas son entrenadas en la búsqueda de una plataforma oculta pocos centímetros por debajo del agua (laberinto acuático de Morris)38, 39, 40, 41.
De manera interesante, pacientes con lesiones en el
 Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum
Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum 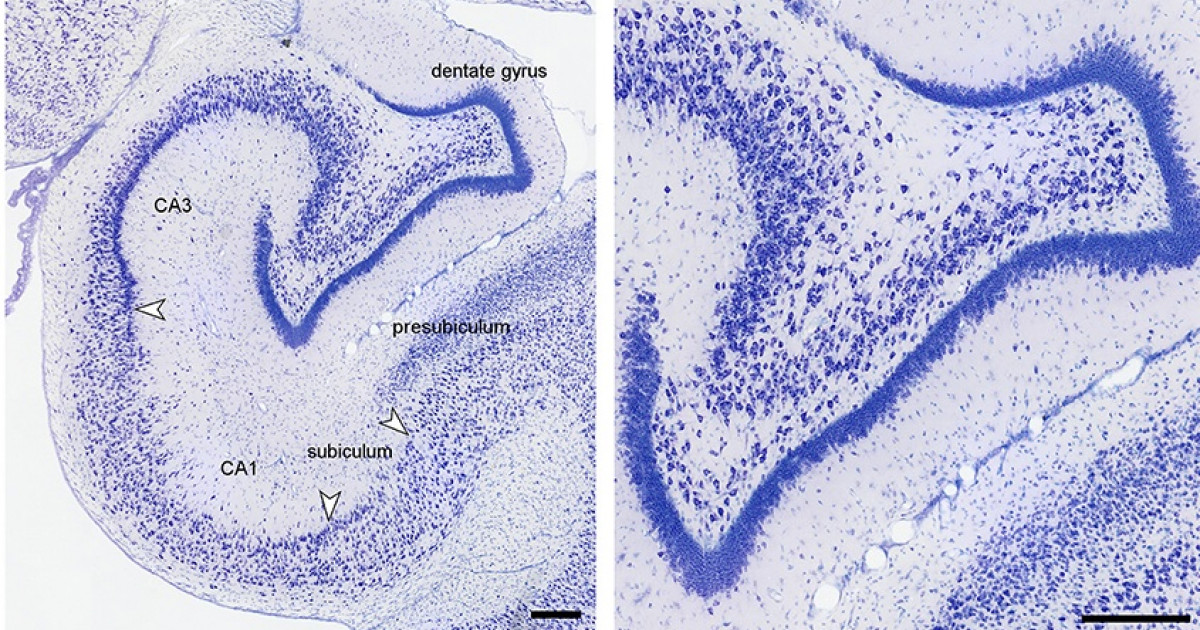 .hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína
.hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína 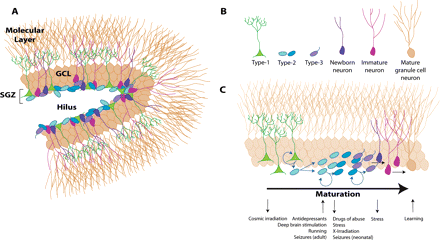
Representación de las etapas del proceso de la neurogénesis y de los marcadores celulares que identifican a cada proceso. La neurogénesis inicia con la proliferación de una célula troncal neural (célula de color azul) localizada en la zona subgranular del giro dentado, que dará origen a progenitores neurales (células de color verde) de los cuales se originarán las nuevas neuronas.
Los progenitores neuronales inician la migración hacía la capa de células granulares del giro dentado, sitio dónde alcanzarán su madurez.
Una etapa crítica de la neurogénesis es el mantenimiento de la supervivencia de las nuevas neuronas, ya que esto permitirá su integración a los circuitos neuronales del hipocampo. Durante la neurogénesis los progenitores neuronales expresan proteínas específicas a lo largo de su maduración. Estas proteínas pueden ser detectadas por técnicas de inmuno histoquímica utilizando anticuerpos específicos. Por ejemplo, una célula inmadura puede identificarse por la detección de la proteína nestina, mientras que una neurona madura por la presencia de la proteína NeuN (para detalles vea el texto). Abreviaturas: zona subgranular (ZSG),capa de células granulares (CCG), capa molecular (CM).24 doble cortina, una proteína que se une a los microtúbulos y que es un marcador de neuronas inmaduras 62, 63, entre uno y catorce días después de su generación. Estas células muestran características de células progenitoras ya que algunas de ellas co-expresan Ki-67 (un marcador de proliferación celular) y por lo tanto son capaces de dividirse 64,65. El tipo 2b expresa el marcador neuronal NeuN 72 horas después de su generación. Por otra parte, este mismo tipo puede dividirse una vez más ydar origen al tipo celular 3, el cual expresa doblecortina y NeuN.
Los tres tipos celulares expresan la proteína polisializada deNCAM (PSA-NCAM) 66.La mayoría de la progenie de las células precursoras neurales dará origen a neuronas granulosas dentadas. Durante su proceso de madurez estas células reciben estímulos gabaérgicos ocho días después de su nacimiento y estímulos glutamatérgicos por un periodo de 18 días, además tienen un bajo umbral para la inducción de la potenciación a largo plazo(LTP por sus siglas en inglés) y una mejor plasticidad sináptica 67,68, 69, 70. Estas nuevas células migran, se diferencian y se integran a la capa subgranular del giro dentado del hipocampo entre una y cuatro semanas después de su generación. Posteriormente, desarrollan un axón y generan procesos neuríticos que les permite integrarse sinápticamente entre dos y cuatro semanas
después de su nacimiento 71. Las nuevas neuronas envían susproyecciones axonales hacia CA3 y arborizaciones dendríticashacia la capa granular, lo que sugiere que hacen sinapsisantes de ser completamente maduras 72. De las nuevas célulasgeneradas, un bajo porcentaje se diferencia en astrocitos(positivos a los marcadores GFAP/S100B). Experimentos en monos, han demostrado que un alto porcentaje de las nuevas células generadas se comprometen a ser neuronas, expresando marcadores neuronales como: TuJ1, TOAD-64, NeuN, y calbindinay raramente marcadores de astrocitos (GFAP) u oligodendrocitos(CNP) 73, 74. 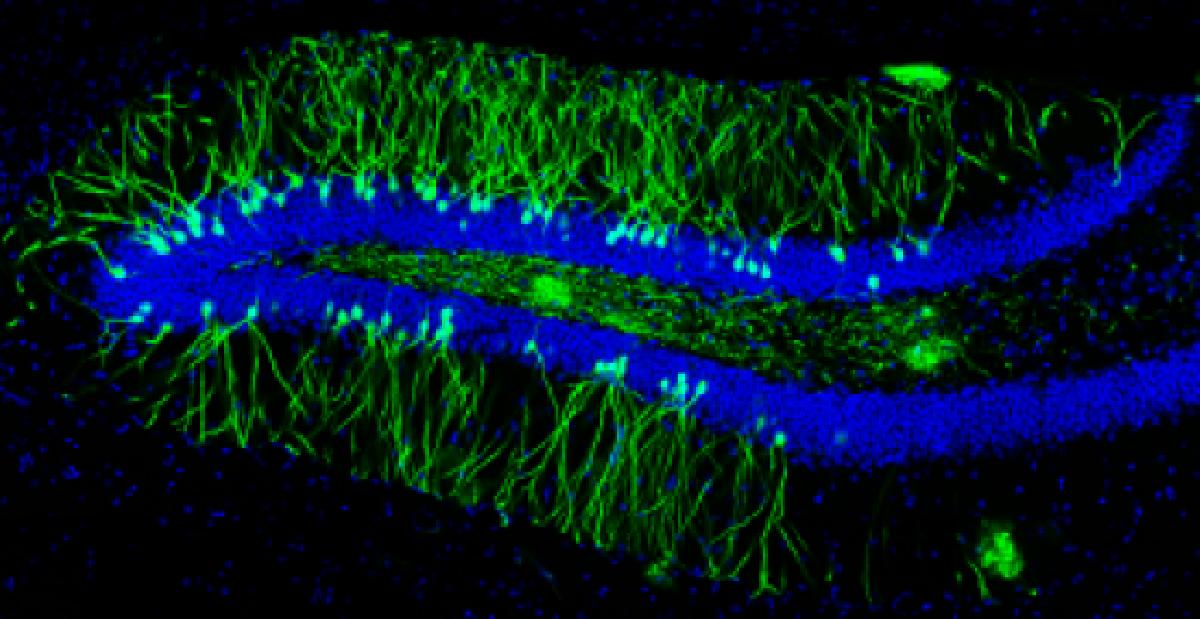
Una de las preguntas frecuentes en la investigación de la neurogénesis hipocampal es si la producción de nuevas neuronasen el giro dentado podría ser relevante en el aprendizajeespacial asociado al hipocampo. La posible implicación de laneurogénesis hipocampal en el aprendizaje espacial, podríaexplicarse considerando que la neurogénesis es estimulada porel aprendizaje y este a su vez por la neurogénesis 75, 76. Estudiosprevios han demostrado que algunas experiencias como elaprendizaje espacial, el ambiente enriquecido y el ejerciciofísico voluntario incrementan las tasas de neurogénesis en elgiro dentado 77, 78, 79, 80. De manera interesante, estas experiencias están asociadas con un aumento en el rendimiento cognitivo, probablemente a través de la incorporación de las nuevas neuronas a las redes neurales del hipocampo. El aprendizaje espacial dependiente de hipocampo es uno de los principales reguladores de la neurogénesis hipocampal. Específicamente, la neurogénesis en el giro dentado se incrementa por el aprendizaje de tareas dependientes de hipocampo como son: el condicionamiento de traza de la respuesta de parpadeo, aprendizaje espacial en el laberinto acuático de Morris y la preferencia de comida condicionada 81, 82.  Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
En resumen, el ambiente enriquecido y el ejercicio como factores inductores de neurogénesis pueden tener mediadores químicos comunes que facilitan la proliferación de nuevas neuronas y entre los que se destacan los factores de crecimiento, las hormonas y neurotransmisores (figura 3). 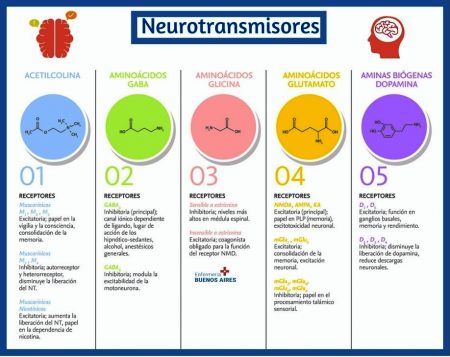
Conclusiones
La relación entre la neurogénesis hipocampal y elaprendizaje y la memoria es evidente, las nuevasneuronas generadas en el hipocampo proporcionanel substrato anatómico que procesa y codifica lanueva información adquirida, sin embargo no se sabesi dichas neuronas remplazan a las viejas por ser estás ya nofuncionales o bien si las neuronas viejas se mantienen porqueconservan información relevante aprendida enteriormente,ambos esquemas tienen que ser investigados para entender si elrecambio de neuronas en el hipocampo es un proceso continuoy si todo aquello que aprendemos es condición para inducirneurogenesis. En este sentido la inducción de neurogénesisasociada al aprendizaje depende de varios factores: i) del tipode tarea de aprendizaje, ii) de las demandas específicas querequiera la ejecución de la tarea y iii) del momento en que seejecuta la tarea. En este contexto, la neurogénesis asociada a laadquisición de tareas nuevas, que tiempo después se traducenen memoria, es un proceso complejo, multifactorial y coninterrogantes que aún deben ser resultas.
Bibliografía1.
Roediger HL, McDermott KB. Two types of event memory. Proc NatlAcad Sci 2013; 110: 20856-857.2.
Kandel, ER, Dudai Y, Mayford MR. The molecular and systems biologyof memory. Cell 2014; 157:163–186.3.
Griffin AL. Role of the thalamic nucleus reuniens in mediating interactions between the hippocampus and medial prefrontal cortexduring spatial working memory. Front Syst Neurosci 2015 10; 9:29.4.
Zanto TP, Rubens MT, Thangavel A, Gazzaley A. Causal role of theprefrontal cortex in top-down modulation of visual processing andworking memory. Nat Neurosci 2011; 14: 656-61.5. Squire LR, Dede AJ. Conscious and Unconscious Memory Systems.Cold Spring Harb Perspect Biol 2015 Mar 2;7(3)6.
Ashby FG1, Turner BO, Horvitz JC. Cortical and basal gangliacontributions to habit learning and automaticity. Trends Cogn Sci.2010; 14:208-15.7.
Timmann D, y col. The human cerebellum contributes to motor,
Figura 3. Mecanismos sugeridos que regulan la neurogénesis y su efecto sobre el aprendizaje y la memoria espacial. El ambiente enriquecido, el ejercicio físico y nuevas experiencias son factores externos que inducen la liberación de factores de crecimiento como la Neurotrofina-3 (NT3), el factor cerebral derivado del cerebro (BDNF), el factor de crecimiento endotelial vascular (VEGF), el factorde crecimiento parecido a la insulina 1 (IGF-1) o la hormona de crecimiento (GH), dichas moléculas producen efectos diferenciales sobre las distintas etapas de la neurogénesis. La estimulación en la neurogénesis favorece el aprendizaje y la memoria espacial. De forma paralela los factores de crecimiento regulan la liberación de neurotransmisores y la expresión de sus receptores, los cuales a su vez participan en la regulación de la neurogénesis.
Algunos de estos neurotransmisores facilitan la potenciación a largo plazo (LTP), fenómeno involucrado directamente con la adquisición de nueva información. En contraste, el estrés y el envejecimiento tienen un efecto negativo sobre la producción de factores de crecimiento, inhibiendo por lo tanto la respuesta en la neurogénesis y en consecuencia en el aprendizaje y la memoria. Zona sub granular (ZSG), capa de células granulares (CCG), capa molecular (CM), 5-hidroxitriptamina (5-HT), dopamina (DA), glutamato (Glu), ácido gamma-aminobutírico (GABA), N-metil-D-aspartato (NMDA), ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico (AMPA).
Bibliografia.
Emotional and cognitive associative learning. A review. Cortex. 2010;46: 845-578.
Duvarci S. Pare D. Amygdala microcircuits controlling learned fear.Neuron 2014; 482: 966–80.9. Sharon
T, Moscovitch M, Gilboa A. Rapid neocortical acquisition oflong-term arbitrary associations independent of the hippocampus. Proc Natl Acad Sci 2011; 108: 1146-51.10.
Squire LR, Wixted JT. The cognitive neuroscience of human memorysince HM. Annu Rev Neurosci 2011; 34: 259–88.11.
Eichenbaum H. The cognitive neuroscience of memory: anintroduction. Oxford University Press. 201112.
Ullman MT. Contributions of memory circuits to language: Thedeclarative/procedural model. Cognition 2004; 92: 231-70.13.
Keefe JO, Nadel L. The hippocampus as a cognitive map. Oxford:Clarendon Press. 1978.14. Burgess N, Maguire EA, O’Keefe J. The human hippocampus and spatial and episodic memory. Neuron 2002; 35:625–41.15.
Buzsáki G, Moser EI. Memory, navigation and theta rhythm in thehippocampal-entorhinal system. Nat Neurosci 2013; 16:130–38.16.
Morris RGM, y col. Memory reconsolidation: sensitivity ofspatial memory to inhibition of protein synthesis in dorsal hippocampus during encoding and retrieval. Neuron 2006; 50, 479–8917.
Quiroga RQ. Concept cells: the building blocks of declarative memory functions. Nat Rev Neurosci 2012; 13: 587-97.18.
Amaral DG, Witter MP. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neurosci 1989;31:571-91.19.
Lavenex P, Banta LP, Amaral DG: Postnatal development of the primate hippocampal formation. Dev Neurosci 2007; 29:179–19.20.
Kivisaari SL, Probst A, Taylor KI. The Perirhinal, Entorhinal, andParahippocampal Cortices and Hippocampus: An Overview ofFunctional Anatomy and Protocol for Their Segmentation in MRImages In fMRI. Springer Berlin Heidelberg 2013. p. 239-67.21.
Witter MP, Wouterlood FG, Naber PA, Van Haeften T: Anatomicalorganization of the parahippocampal-hippocampal network. Ann NYAcad Sci 2000 Jun; 911:1-24.22.
Lavenex P, Suzuki WA, Amaral DG. Perirhinal and parahipocampal cortices of the macaque monkey: Intrinsic projections andinterconnections. J Comp Neurol. 2004; 472:371-94.23.
Witter MP, Amaral DG. Entorhinal cortex of the monkey: V projectionsto the dentate gyrus, hippocampus, and subicular complex. J CompNeurol 1991; 307:437-59.24.
Khalaf-Nazzal R, Francis F. Hippocampal development – old and newfindings. Neurosci 2013; 248:225-42.25.
Laurberg S, Sorensen KE. Associational and commissural collateralsof neurons in the hippocampal formation (hilus fasciae dentate andsubfield CA3. Brain Res 1981; 212:287–00.26.
Ishizuka N, Weber J, Amaral DG. Organization of intrahippocampalprojections originating from CA3 pyramidal cells in the rat. J CompNeurol 1990; 295:580–23.27.
Frotscher M, Seress L, Schwerdtfeger WK, Buhl E. The mossy cells ofthe fascia dentate: a comparative study of their fine structure andsynaptic connections in rodents and primates. J Comp Neurol 1991;312:145–63.28.
Chicurel ME, Harris KM Three-dimensional analysis of the structure and composition of CA3 branched dendritic spines and their synapticrelationships with mossy fiber boutons in the rat hippocampus. JComp Neurol 1999; 325: 169-82.29.
Suzuki W, Amaral DG: Perirhinal and parahippocampal cortices ofthe macaque monkey: cytoarchitectonic and chemo architectonic organization. J Comp Neurol 2003; 463:67–9130.
Kim SM, Ganguli S, Frank LM. Spatial information outflow from thehippocampal circuit: distributed spatial coding and phase precessionin the subiculum. J Neurosci 2012; 32: 11539-58.31.
Zhang SJ, y col. Functional connectivity of the entorhinal–hippocampal space circuit. Philos Trans R Soc Lond B Biol Sci 2013Dec 23; 369(1635):20120516.32.
Eichenbaum H, Cohen NJ. Can we reconcile the declarative memoryand spatial navigation views on hippocampal function? Neuron 2014;83: 764-70.33.
Giovanello KS, Verfaille M, Keane MM. Disproportionate deficit inassociative recognition relative to item recognition in global amnesia.Cogn Affect Behav Neurosci 2003; 3: 186-94.34.
Addis DR, y col. Characterizing spatial and temporal features of autobiographical memory retrieval networks: a partial least squaresapproach. Neuroimage 2004; 23: 1460-71.35.
Bartsch T, Schönfeld R, Müller FJ, Alfke K, Leplow B, Aldenhoff J, KochJM. Focal lesions of human hippocampal CA1 neurons in transientglobal amnesia impair place memory. Science 2010; 328: 1412-15.36.
Churchwell JC, Morris AM, Musso ND, Kesner RP. Prefrontal andhippocampal contributions to encoding and retrieval of spatialmemory. Neurobiol Learn Mem 2010; 93: 415-21.37. Stone SS, y col. Stimulation of entorhinal cortex promotes adultneurogenesis and facilitates spatial memory. J Neurosci 2011; 31:13469-84.38.
Morris RG. Developments of a water-maze procedure for studyingspatial learning in the rat. J Neurosci Methods1984; 11: 47-60.39.
Moser E, Moser MB, Andersen P. Spatial learning impairmentparallels the magnitude of dorsal hippocampal lesions, but is hardlypresent following ventral lesions. J Neurosci 1993; 13: 3916-25.40.
Laursen B, y col. Impaired hippocampal acetylcholine release parallelsspatial memory deficits in Tg2576 mice subjected to basal forebraincholinergic degeneration. Brain Res 2014; 1543: 253-62.41.
Hales JB, Ocampo AC, Broadbent NJ, Clark RE. Hippocampal Infusion of Zeta Inhibitory Peptide Impairs Recent, but Not Remote,Recognition Memory in Rats. Neural Plasticity 2015; 501, 847136.42.
Astur RS, Taylor LB, Mamelak AN, Philpott L, Sutherland RJ.Humans with hippocampus damage display severe spatial memoryimpairments in a virtual Morris water task. Behav Brain Res 2005;132: 77-84.43.
Cornwell BR, Johnson LL, Holroyd T, Carver FW, Grillon C. Humanhippocampal and parahippocampal theta during goal-directed spatialnavigation predicts performance on a virtual Morris water maze. JNeurosci 2008; 28:5983-90.44.
Strange BA, Witter MP, Lein ES, Moser EI. Functional organization ofthe hippocampal longitudinal axis. Nature Rev Neurosci 2014; 15:655-69.45. Hales JB, y col. Medial entorhinal cortex lesions only partially disrupthippocampal place cells and hippocampus-dependent place memory.Cell Rep 2014; 9: 893-01.46.
O´Keefe JA, Dostrovski J. The hippocampus as a spatial map.Preliminary evidence from unit activity in the freely-moving rat. BrainRes 1971 34: 171-5.47.
Hartley T, Lever C, Burgess N, O’Keefe J. Space in the brain: how thehippocampal formation supports spatial cognition.
Philos Trans R SocLond B Biol Sci 2014; 369: 20120510.48. Moser MB, Rowland DC, Moser EI. Place cells, grid cells, and memory.Cold Spring Harb Perspect Med 2015; 7: a021808.49.
Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ. Learning enhancesadult neurogenesis in the hippocampal formation. Nature Neurosci1999; 2: 260–5.50.
Clemenson GD, Deng W, Gage FH. Environmental enrichment andneurogenesis: from mice to humans. Curr Opin Beh Sci 2015; 4: 56-62.51.
Cameron HA, Glover LR. Adult Neurogenesis: Beyond Learning andMemory. Annu Rev Psychol 2015; 66: 53-81.52. Cameron HA, Mckay RD. Adult neurogenesis produces a large poolEl hipocampo: neurogénesis y aprendizajeRev Med UV, Enero – Junio 2015 www.uv.mx/rmof new granule cells in the dentate gyrus. J Comp Neurol 2001; 435:406-17.53.
Fernandes C, y col. Detrimental role of prolonged sleep deprivationon adult neurogenesis. Front Cell Neurosci, 2015; 9:140.54.
Aimone JB, Deng W, Gage FH. Adult neurogenesis in the dentategyrus. In Space, Time and Memory in the Hippocampal Formation.Springer Vienna 2015; pp. 409-429.55.
Eriksson PS, y col. Neurogenesis in the adult human hippocampus.Nature Medicine 1998; 4: 1313-1317.56. Gage FH. Mammalian neural stem cells. Science 2000; 287: 1433–38.57.
Drew LJ, Fusi S, Hen R. Adult neurogenesis in the mammalianhippocampus: Why the dentate gyrus? Learn Mem 2013; 20: 710-29.58.
De La Rosa Prieto C, De Moya Pinilla M, Saiz-Sanchez D, Ubeda-banonI, Arzate DM, Flores-Cuadrado A, Martinez-Marcos A. Olfactory andcortical projections to bulbar and hippocampal adult-born neurons.Front Neuroanat. 2015; 9:4.59.
Kempermann G, Jessberger S, Steiner B, Kronenberg G. Milestones ofneuronal development in the adult hippocampus. Trends Neurosci2004; 27:447-52.60.
Duan L Peng CY, Pan L Kessler JA. Human Pluripotent Stem Cell-Derived Radial Glia Recapitulate Developmental Events and ProvideReal-Time Access to Cortical Neurons and Astrocytes. Stem CellsTransl Med. 2015 Apr 1. pii: sctm.2014-0137.61.
Kirby ED, Kuwahara AA, Messer RL, Wyss-Coray T. Adult hippocampalneural stem and progenitor cells regulate the neurogenic niche bysecreting VEGF. Proc Natl Acad Sci U S A 2015; 112: 4128-33.62.
Toriyama M, y col. Phosphorylation of doublecortin by protein kinaseA orchestrates microtubule and actin dynamics to promote neuronalprogenitor cell migration. J Biol Chem. 2012; 287:12691-702.63.
Vukovic J1, Borlikova GG, Ruitenberg MJ, Robinson GJ, Sullivan RK,Walker TL, Bartlett PF. Immature doublecortin-positive hippocampalneurons are important for learning but not for remembering. JNeurosci. 2013; 33: 6603-13.64.
Espósito MS, Piatti VC, Laplagne DA, Morgenstern NA, FerrariCC, Pitossi FJ, Schinder AF. Neuronal differentiation in the adult hippocampus recapitulates embryonic development. J Neurosci2005; 25:1007486.65.
Cimadamore F, Amador-Arjona A, Chen C, Huang CT, Terskikh AV.SOX2–LIN28/let-7 pathway regulates proliferation and neurogenesisin neural precursors. Proc Natl Acad Sci U S A 2013; 110: E3017-E26.66. Kim HS, y col. PSA-NCAM+ Neural Precursor Cells from HumanEmbryonic Stem Cells Promote Neural Tissue Integrity and BehavioralPerformance in a Rat Stroke Model. Stem Cell Rev 2014; 10: 761-771.67.
Schmidt-Hieber C, Jonas P, Bischofberger J. Enhanced synapticplasticity in newly generated granule cells of the adult hippocampus.Nature 2004; 429:184–87.68. Ge S, y col. GABA regulates synaptic integration of newly generatedneurons in the adult brain. Nature 2006; 439:589–93.69.
Lledo MP, Alononso M, Grubb MS. Adult neurogenesis and functionalplasticity in neuronal circuits. Nat Rev Neurosci 2006; 7:179-93.70.
Kim WR, Christian K, Ming GL, Song H. Time-dependent involvementof adult-born dentate granule cells in behavior. Behav Brain Res 2012;227: 470-79.71.
Benarroch EE. Adult neurogenesis in the dentate gyrus generalconcepts and potential implications. Neurology 2013; 81: 1443-52.72.
Song J, M Christian K, Ming GL, Song H. Modification of hippocampalcircuitry by adult neurogenesis. Dev Neurobiol 2012; 72: 1032-43.73.
Imayoshi I, Kageyama R. The role of Notch signaling in adultneurogenesis. Mol Neurobiol 2011; 44: 7-12.74. Mu L, y col. SoxC transcription factors are required for neuronaldifferentiation in adult hippocampal neurogenesis. J Neurosci 2012;32: 3067-80.75.
Gould E, Vail N, Wagers M, Gross CG. Adult-generated hippocampaland neocortical neurons in macaques have a transient existence.Proc Natl Acad Sci U S A 2001; 98:10910-17.76.
Fabel K, y col. Additive effects of physical exercise and environmentalenrichment on adult hippocampal neurogenesis in mice. FrontNeurosci 2009; 3:50.77.
Kempermann, G. Activity-Based Maintenance of Adult HippocampalNeurogenesis: Maintaining a Potential for Lifelong Plasticity. InNeural Stem Cells in Development, Adulthood and Disease 2015 (pp.119-123). Springer New York.78.
Zhao C, Deng W, Gage FH. Mechanisms and functional implications ofadult neurogenesis. Cell 2008;132: 645–6079. Clelland D, y col. A functional role for adult hippocampal neurogenesisin spatial pattern separation. Science 2009; 325: 210-13.80.
Speisman RB, y col. Environmental enrichment restores neurogenesisand rapid acquisition in aged rats. Neurobiol Aging 2013; 34: 263-74.81.
Merritt JR, Rhodes JS. Mouse genetic differences in voluntary wheelrunning, adult hippocampal neurogenesis and learning on the multistrain-adapted plus water maze.
Behav Brain Res 2015; 280: 62-71.82. Deng W, Gage FH. The effect of immature adult-born dentate granulecells on hyponeophagial behavior is related to their roles in learningand memory. Front Syst Neurosci 2015; 9.83.
Opendak M, Gould E. Adult neurogenesis: a substrate for experiencedependentchange. Trends Cogn Sci 2015; 19: 151-61.84. Trinchero MF, y col. Effects of spaced learning in the water mazeon development of dentate granule cells generated in adult mice.Hippocampus 2015. doi: 10.1002/hipo.22438.85. Jamal AL, y col. Transplanted dentate progenitor cells show increasedsurvival in an enriched environment, but do not exert a neurotrophiceffect on spatial memory within 2 weeks of engraftment. CellTransplan 2015. http://dx.doi.org/10.3727/096368915X68701186.
Peters M, Muñoz-López M, Morris RG. Spatial memory andhippocampal enhancement. Current Opinion in Behavioral Sciences2015. http://dx.doi.org/10.1016/j.cobeha.2015.03.00587.
Dobrossy MD, y col. Differential effects of learning on neurogenesis:Learning increases or decreases the number of newly born cellsdepending on their birth date. Mol Psychiatry 2003; 8: 974-82.88.
Leuner B, Mendolia-Loffredo S, Kozorovitskiy Y, Samburg D, GouldE, Shors TJ. Learning enhances the survival of new neurons beyondthe time when the hippocampus is required for memory. J Neurosci2004; 24: 7477-81.89.
Dupret D, y col. Spatial learning depends on both the addition andremoval of new hippocampal neurons. PLoS biology 2007; 5: e214.90. Dupret D, y col. Spatial relational memory requires hippocampaladult neurogenesis. PloS one 2008; 3: e1959.91.
Epp JR, Haack AK., Galea LA. Activation and survival of immatureneurons in the dentate gyrus with spatial memory is dependent ontime of exposure to spatial learning and age of cells at examination.Neurobiol Learn Mem 2011; 95: 316-25.92.
Lacefield CO, y col. Effects of adult‐generated granule cells oncoordinated network activity in the dentate gyrus. Hippocampus2012; 22: 106-16.93.
van Praag H, Kempermann G, Gage FH. Running increases cellproliferation and neurogenesis in the adult mouse dentate gyrus.Nature Neuroscience 1999; 2: 266-70.94.
Birch AM, McGarry NB, Kelly ÁM. Short‐term environmentalenrichment, in the absence of exercise, improves memory,and increases NGF concentration, early neuronal survival, andsynaptogenesis in the dentate gyrus in a time‐dependent manner.Hippocampus 2013; 23: 437-50.95.
Kempermann G, Kuhn HG, Gage FH. More hippocampal neuronsin adult mice living in an enriched environment. Nature 1997; 386:493–95.96.
Nilsson M, Perfilieva E, Johansson U, Orwar O, Eriksson PS. Enrichedenvironment increases neurogenesis in the adult rat dentate gyrusand improves spatial memory. J Neurobi 1999; 39: 569-78.28 www.uv.mx/rm97.
Hillman CH, Erickson KI, Kramer AF. Be smart, exercise your heart:exercise effects on brain and cognition. Nature Rev Neurosci 2008;9:58–65.98.
Erickson KI, y col. Exercise training increases size of hippocampus andimproves memory. Proc Natl Acad Sci U S A. 2011; 108: 3017-22.99.
Muotri AR, Zhao C, Marchetto MC, Gage FH. Environmental influenceon L1 retrotransposons in the adult hippocampus. Hippocampus2009; 19:1002–07.100.
Kempermann, G. New neurons for’survival of the fittest’. Nat RevNeurosci. 2012; 13:727-36.101. Liu HL, Zhao
, Cai K, Zhao HH, Shi LD. Treadmill exercise prevents
Juan David Olivares Hernández1,Enrique Juárez Aguilar2,Fabio García García2.Rev Med UV, Enero – Junio 201521
La generación de nuevas neuronas en el cerebro de los mamíferos, incluyendo el cerebro humano, es un fenómeno descrito desde hace ya varios años. Dicho fenómeno se conoce como neurogénesis y ocurre únicamente en dos regiones del cerebro adulto; la pared de los ventrículos laterales y el giro dentado del hipocampo.
La presencia de neurogénesis se ha asociado a múltiples factores entre los que destaca el aprendizaje y su respectiva consolidación denominada memoria. Un número considerable de trabajos realizados en roedores han mostrado que cuando se aprende una tarea, el número de nuevas neuronas en el giro dentado del hipocampo se incrementa de forma abundante. Lo cual sugiere que el aprendizaje es un factor que estimula la proliferación de nuevas neuronas, muchas de las cuales no sobreviven y pocas se integran al circuito cerebral para ser funcionales.
Aprendizaje y memoria
MEMORIA ALARGO PLAZO
El segundo gran bloque de la memoria individual es la memoria a largo plazo que a su vez se divide, en memoria explícita y memoria implícita.
La primera se refiere a todos los conocimientos conscientes que tenemos sobre eventos del pasado para términos de practicidad tenemos dos grandes bloques de memoria explícita la episódica y la semántica así los recuerdos que tenemos sobre experiencias personales específicas o eventos autobiográficos cómo saber quién es tu familia qué hiciste ayer cuál es tu profesión etcétera corresponde a la memoria episódica mientras que los recuerdos semánticos están relacionados a los conocimientos léxicos o conceptuales que no necesariamente están vinculados a una experiencia personal es decir tú sabes el concepto de adicción que implica agregarle un valor anterior a otro valor todos lo aprendimos en el colegio sin embargo no necesariamente recordamos el momento exacto de este aprendizaje por tanto la memoria explícita semántica corresponde a todos los conocimientos que tenemos sobre loque son las cosas, dentro de sus características se encuentra que el aspecto emocional que no juega un rol tan importante como en la memoria episódica y tiende al olvido es decir puedes la factorización que viste en tu secundaria pero si los pares craneales de tu clase de neuroanatomía y que son un conocimiento más reciente el segundo bloque de memoria a largo plazo es la memoria implícita que también es conocida como memoria procedimental esto debido a su rol de automatización de las acciones ya que no requiere de un control consciente para realizar actos aprendidos anteriormente. Para montar en bici no es necesario recordar que recordar paso por paso como pones tus pies sobre el pedal ni mucho menos controlas la forma como se da el equilibrio este. Este tipo de memoria se automatiza con la práctica. Cuando se aprende a montar en bicicleta se utiliza el consciente y después se convierte en un automatismo.
Dentro de la memoria implícita hay dos grandes bloques la implícita asociativa y la no asociativa la primera va a corresponder a todos los aprendizajes generados mediante la asociación de estímulos donde encontramos el condicionamiento clásicoy el operante y por último en la memoria explícita no asociativa tenemos la procedimental ya que es mediante la sumación de pasos que se va a generar un aprendizaje el ejemplo de la bicicleta anteriormente mencionado nos puede servir acá también ya que vamos a utilizar diferentes procedimientos motores para poder lograr montar la bicicleta como sentarnos impulsarnos mover los pedales y los brazos van a controlar la dirección ahora bien ya teniendo nuestro esquema de memoria completo vale la pena explicar cómo se da el proceso de codificación de la información para esto vamos a tener en cuenta tanto las características del estímulo como las del sujeto y que juntos interactúan para que se den los cambios neuro estructurales a nivel del hipocampo y corteza cerebral para las características del estímulo tenemos la intensidad del estímulo es decir la duración del mismo la carga emocional que le otorguemos el estímulo y la frecuencia con la que se presente así por ejemplo si un día alguien nos asalta la carga emocional y la intensidad de ese estímulo van a ser suficientes para que aprendamos a no andar por una calle específica en este caso la frecuencia de la ocurrencia del mismo no es tan necesaria como la que necesitamos para aprender a andar en bicicleta o manejar un coche ahora bien las características del individuo también van a ser importantes para la memorización como lo es el estado de activación del individuo l as estrategias que emplee y la experiencia previa con el estímulo es por esto que pese a que un tema sea fácil si nuestro estado de arousal es bajo o tenemos sueño el aprendizaje no se consolida y cuando queremos aprender un tema y tenemos estrategias como utilizar nemotecnia o mapas conceptuales
Adaptativamente, el aprendizaje y la memoria son procesos cognitivos vitales para los organismos que forman parte del reino animal. El ambiente es un entorno cambiante, por lo que animales que viven en ambientes que cambian continuamente necesitan de una plasticidad conductual.
La plasticidad es una propiedad de los sistemas biológicos que les permite adaptarse a los cambios del medio para sobrevivir, la cual depende de los cambios fisiológicos que ocurran al interior. En este sentido, el sistema nervioso posee una plasticidad altamente desarrollada y evidente en las primeras etapas del desarrollo, sobre todo en los mamíferos. A nivel neuronal los cambios plásticos pueden ser visualizados a través de un incremento del árbol dendrítico y del número de espinas dendríticas, que mejoran los contactos sinápticos y en consecuencia la comunicación entre las neuronas. Desde hace tiempo se sabe que el aprendizaje y la memoria son eventos que favorecen la plasticidad, y entre cuando más plástico es el sistema nervioso mayor es la capacidad de aprendizaje de los organismos.
El aprendizaje puede considerarse como una modificación estructural y funcional del sistema nervioso queda como resultado un cambio en la conducta relativamente permanente. 
La información aprendida es retenida o almacenada en los circuitos neuronales que forman el cerebro y constituye lo que denominamos memoria.
La memoria es la consecuencia usual del aprendizaje y difícilmente nos referimos a alguno de estos términos de manera independiente.
En los mamíferos se han descrito diferentes tipos de memoria y cada uno de estos tipos involucra la participación de áreas cerebrales y neurotransmisores específicos.
De acuerdo a las características conductuales y las estructuras cerebrales implicadas, se han caracterizado tres tipos de memoria:
la de trabajo, la implícita y la explícita 1.
La memoria de trabajo también llamada cognición ejecutiva, consiste en la representación consciente y manipulación temporal de la información necesaria para realizar operaciones cognitivas complejas, como el aprendizaje, la comprensión del lenguaje o el razonamiento 2, 3.
La corteza prefrontal podría ser el lugar sede de esta memoria, además se sugiere que esta estructura cerebral podría funcionar como un lugar “on line” durante cortos periodos de tiempo de representaciones de estímulos ausentes 4.
Por otra parte, la memoria implícita, procedimental o no declarativa es la memoria de las cosas que hacemos rutinariamente.
Se le considera automática, inconsciente y difícil de verbalizar. Su adquisición es gradual y se perfecciona con la práctica. Este tipo de memoria deriva de tipos de aprendizaje básico, como la habituación y la sensibilización, el aprendizaje perceptivo y motor o el condicionamiento clásico e instrumental5. Anatómicamente, la memoria implícita requiere de diferentes estructuras cerebrales que han sido involucradas con el aprendizaje procidemental, por ejemplo, los ganglios basales con el aprendizaje de hábitos y habilidades 6, el cerebelo con los condicionamientos de respuestas motoras 7 y la amígdala con los condicionamientos emocionales 8. Aunque el sitio principal de almacenamiento de esta memoria radica en estructuras subcorticales y en algunos casos depende directamente del neocortex 9.
La memoria explícita, también conocida como memoria declarativa, relacional o cognitiva es el almacenamiento cerebral de hechos (memoria semántica) y eventos (memoria episódica) 10, 11 ,12. Este tipo de memoria se adquiere en pocos ensayos a diferencia de la memoria implícita y se distingue por expresarse en situaciones y modos diferentes a los del aprendizaje original, por lo que es considerada como una memoria de expresión flexible. Un tipo de memoria declarativa es la memoria espacial que consiste en múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales 13, 14, 15. El hipocampo parece ser la estructura cerebral que está críticamente relacionado en este tipo de memoria declarativa 16, 17.
Sustrato anatómico de la memoria declarativa: el hipocampo
El hipocampo deriva de la región medial del telencéfalo, forma parte del sistema límbico y tiene un papel importante en la adquisición del aprendizaje espacial y la consolidación de la memoria a largo y corto plazo. Anatómicamente, está organizado en el cuerno de Amón (hipocampo propio) y el giro dentado(separados por la fisura hipocampal); el complejo subicular,22 www.uv.mx/rm formado por el presubiculum, el subiculum y el parasubiculum; y la corteza entorrinal 18, 19, 20.
El cuerno de Amón está dividido en tres áreas: CA1,CA2 y CA3 (figura 1).La mayor entrada de fibras en el hipocampo proviene de la corteza parahipocampal que es la principal vía de entrada de aferencias neocorticales de procesamiento provenientes de distintas áreas dorsales, como la corteza parietal posterior, la corteza retrosplenial, la corteza prefrontal dorsolateral o de la parte dorsal del surco temporal superior estructuras estrechamente asociadas en la codificación de la localización espacial de los estímulos 21, 22. Estas aferencias son distribuidas hacia la corteza entorrinal. Las células de las capas II y III de esta corteza envían sus axones hasta el giro dentado y el hipocampo a través de la vía perforante, atravesando la capa de células piramidales del subiculum 23, 24. Por otra parte, las neuronas piramidales de la región CA3 proyectan sus axones hacia las dendritas de las neuronas piramidales de las CA1 mediante los colaterales de Schaffer. Así mismo, los axones provenientes de la región CA3 proyectan hacía todo el hipocampo mediante proyecciones comisurales, entre hemisferios y/o asociativas, en el mismo hemisferio 25, 26, 27. Mientras que las neuronas granulares del giro dentado proyectan sus axones o fibras musgosas hacia las dendritas proximales de las neuronas piramidales de la región CA3, atravesando el hilus 28, 29. El circuito del procesamiento de la información de la memoria declarativa es el llamado circuito trisináptico 30. Este circuito inicia en la vía perforante de la corteza entorrinal. Primeramente, las neuronas de la corteza entorrinal envía sus proyecciones hacía las células granulares del giro dentado. Enseguida, estás células proyectan sus axones hacia las neuronas piramidales de la región CA3, las cuales finalmente envían sus axones hasta las neuronas piramidales de la región CA1 mediante los colaterales de Schaffer (figura 1). La información procesada mediante este circuito trisináptico permite relacionar diferentes aferencias sensoriales pertenecientes a diversos estímulos gracias a que las células piramidales del hipocampo tienen un alto grado de interconexión, facilitando las relaciones entre las diferentes entradas de información 31.
Hipocampo y memoria declarativa
Actualmente existe amplia evidencia del papel crítico que juega el hipocampo en la memoria declarativa. Las lesiones en el hipocampo y sus conexiones subcorticales en pacientes con amnesia producen déficits selectivos en la memoria declarativa, sin embargo la capacidad de distinguir nuevos objetos con base en su familiaridad permanece intacta 32, 33. Además se observó que en estos pacientes el hipocampo tiene la función de mantener la habilidad de asociar objetos en la memoria y recordar asociaciones contextuales en comparación con el recuerdo de objetos únicos con base en su familiaridad 34, 35. Otros estudios clínicos han mostrado que la corteza parahipocampal se activa durante la presentación de escenas espaciales o durante la memorización de objetos relacionados fuertemente con lugares específicos 36, 37. El hipocampo es, por tanto, unaestructura crítica para procesar y recordar información espacialy contextual.La participación del hipocampo en la memoria explícitaha sido estudiada por medio de la memoria espacial. La memoriaespacial consiste en múltiples mecanismos especializados encodificar, almacenar y recuperar información acerca de rutas,configuraciones y localizaciones espaciales 13, 14, 15. Esta memoria puede ser evaluada en humanos y en modelos animales, en los cuales la solución de la tarea depende de la información disponible. Experimentos con ratas han mostrado que las lesiones hipocampales afectan negativamente la adquisición y retención del aprendizaje espacial cuándo las ratas son entrenadas en la búsqueda de una plataforma oculta pocos centímetros por debajo del agua (laberinto acuático de Morris)38, 39, 40, 41.
De manera interesante, pacientes con lesiones en el
 Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum
Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum 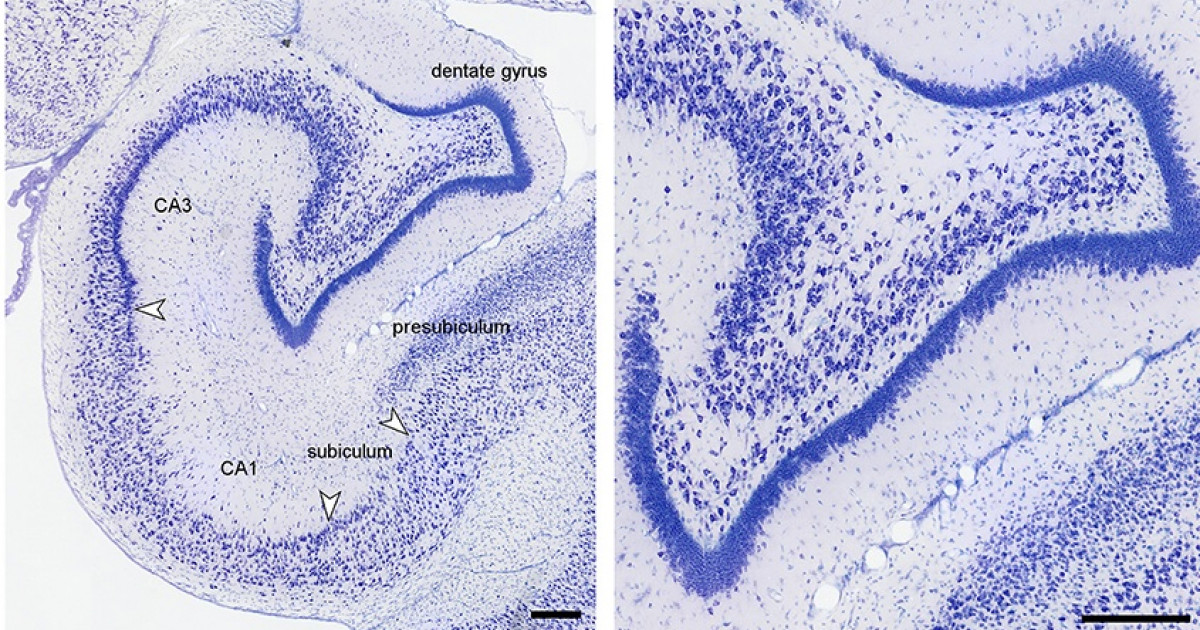 .hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína
.hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína 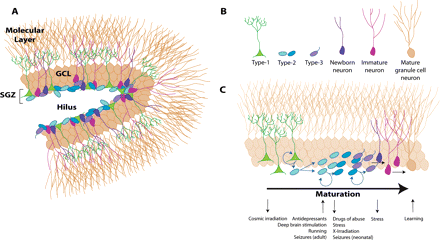
Representación de las etapas del proceso de la neurogénesis y de los marcadores celulares que identifican a cada proceso. La neurogénesis inicia con la proliferación de una célula troncal neural (célula de color azul) localizada en la zona subgranular del giro dentado, que dará origen a progenitores neurales (células de color verde) de los cuales se originarán las nuevas neuronas.
Los progenitores neuronales inician la migración hacía la capa de células granulares del giro dentado, sitio dónde alcanzarán su madurez.
Una etapa crítica de la neurogénesis es el mantenimiento de la supervivencia de las nuevas neuronas, ya que esto permitirá su integración a los circuitos neuronales del hipocampo. Durante la neurogénesis los progenitores neuronales expresan proteínas específicas a lo largo de su maduración. Estas proteínas pueden ser detectadas por técnicas de inmuno histoquímica utilizando anticuerpos específicos. Por ejemplo, una célula inmadura puede identificarse por la detección de la proteína nestina, mientras que una neurona madura por la presencia de la proteína NeuN (para detalles vea el texto). Abreviaturas: zona subgranular (ZSG),capa de células granulares (CCG), capa molecular (CM).24 doble cortina, una proteína que se une a los microtúbulos y que es un marcador de neuronas inmaduras 62, 63, entre uno y catorce días después de su generación. Estas células muestran características de células progenitoras ya que algunas de ellas co-expresan Ki-67 (un marcador de proliferación celular) y por lo tanto son capaces de dividirse 64,65. El tipo 2b expresa el marcador neuronal NeuN 72 horas después de su generación. Por otra parte, este mismo tipo puede dividirse una vez más ydar origen al tipo celular 3, el cual expresa doblecortina y NeuN.
Los tres tipos celulares expresan la proteína polisializada deNCAM (PSA-NCAM) 66.La mayoría de la progenie de las células precursoras neurales dará origen a neuronas granulosas dentadas. Durante su proceso de madurez estas células reciben estímulos gabaérgicos ocho días después de su nacimiento y estímulos glutamatérgicos por un periodo de 18 días, además tienen un bajo umbral para la inducción de la potenciación a largo plazo(LTP por sus siglas en inglés) y una mejor plasticidad sináptica 67,68, 69, 70. Estas nuevas células migran, se diferencian y se integran a la capa subgranular del giro dentado del hipocampo entre una y cuatro semanas después de su generación. Posteriormente, desarrollan un axón y generan procesos neuríticos que les permite integrarse sinápticamente entre dos y cuatro semanas
después de su nacimiento 71. Las nuevas neuronas envían susproyecciones axonales hacia CA3 y arborizaciones dendríticashacia la capa granular, lo que sugiere que hacen sinapsisantes de ser completamente maduras 72. De las nuevas célulasgeneradas, un bajo porcentaje se diferencia en astrocitos(positivos a los marcadores GFAP/S100B). Experimentos en monos, han demostrado que un alto porcentaje de las nuevas células generadas se comprometen a ser neuronas, expresando marcadores neuronales como: TuJ1, TOAD-64, NeuN, y calbindinay raramente marcadores de astrocitos (GFAP) u oligodendrocitos(CNP) 73, 74. 
Una de las preguntas frecuentes en la investigación de la neurogénesis hipocampal es si la producción de nuevas neuronasen el giro dentado podría ser relevante en el aprendizajeespacial asociado al hipocampo. La posible implicación de laneurogénesis hipocampal en el aprendizaje espacial, podríaexplicarse considerando que la neurogénesis es estimulada porel aprendizaje y este a su vez por la neurogénesis 75, 76. Estudiosprevios han demostrado que algunas experiencias como elaprendizaje espacial, el ambiente enriquecido y el ejerciciofísico voluntario incrementan las tasas de neurogénesis en elgiro dentado 77, 78, 79, 80. De manera interesante, estas experiencias están asociadas con un aumento en el rendimiento cognitivo, probablemente a través de la incorporación de las nuevas neuronas a las redes neurales del hipocampo. El aprendizaje espacial dependiente de hipocampo es uno de los principales reguladores de la neurogénesis hipocampal. Específicamente, la neurogénesis en el giro dentado se incrementa por el aprendizaje de tareas dependientes de hipocampo como son: el condicionamiento de traza de la respuesta de parpadeo, aprendizaje espacial en el laberinto acuático de Morris y la preferencia de comida condicionada 81, 82.  Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
En resumen, el ambiente enriquecido y el ejercicio como factores inductores de neurogénesis pueden tener mediadores químicos comunes que facilitan la proliferación de nuevas neuronas y entre los que se destacan los factores de crecimiento, las hormonas y neurotransmisores (figura 3). 
Conclusiones
La relación entre la neurogénesis hipocampal y elaprendizaje y la memoria es evidente, las nuevasneuronas generadas en el hipocampo proporcionanel substrato anatómico que procesa y codifica lanueva información adquirida, sin embargo no se sabesi dichas neuronas remplazan a las viejas por ser estás ya nofuncionales o bien si las neuronas viejas se mantienen porqueconservan información relevante aprendida enteriormente,ambos esquemas tienen que ser investigados para entender si elrecambio de neuronas en el hipocampo es un proceso continuoy si todo aquello que aprendemos es condición para inducirneurogenesis. En este sentido la inducción de neurogénesisasociada al aprendizaje depende de varios factores: i) del tipode tarea de aprendizaje, ii) de las demandas específicas querequiera la ejecución de la tarea y iii) del momento en que seejecuta la tarea. En este contexto, la neurogénesis asociada a laadquisición de tareas nuevas, que tiempo después se traducenen memoria, es un proceso complejo, multifactorial y coninterrogantes que aún deben ser resultas.
Bibliografía1.
Roediger HL, McDermott KB. Two types of event memory. Proc NatlAcad Sci 2013; 110: 20856-857.2.
Kandel, ER, Dudai Y, Mayford MR. The molecular and systems biologyof memory. Cell 2014; 157:163–186.3.
Griffin AL. Role of the thalamic nucleus reuniens in mediating interactions between the hippocampus and medial prefrontal cortexduring spatial working memory. Front Syst Neurosci 2015 10; 9:29.4.
Zanto TP, Rubens MT, Thangavel A, Gazzaley A. Causal role of theprefrontal cortex in top-down modulation of visual processing andworking memory. Nat Neurosci 2011; 14: 656-61.5. Squire LR, Dede AJ. Conscious and Unconscious Memory Systems.Cold Spring Harb Perspect Biol 2015 Mar 2;7(3)6.
Ashby FG1, Turner BO, Horvitz JC. Cortical and basal gangliacontributions to habit learning and automaticity. Trends Cogn Sci.2010; 14:208-15.7.
Timmann D, y col. The human cerebellum contributes to motor,
Figura 3. Mecanismos sugeridos que regulan la neurogénesis y su efecto sobre el aprendizaje y la memoria espacial. El ambiente enriquecido, el ejercicio físico y nuevas experiencias son factores externos que inducen la liberación de factores de crecimiento como la Neurotrofina-3 (NT3), el factor cerebral derivado del cerebro (BDNF), el factor de crecimiento endotelial vascular (VEGF), el factorde crecimiento parecido a la insulina 1 (IGF-1) o la hormona de crecimiento (GH), dichas moléculas producen efectos diferenciales sobre las distintas etapas de la neurogénesis. La estimulación en la neurogénesis favorece el aprendizaje y la memoria espacial. De forma paralela los factores de crecimiento regulan la liberación de neurotransmisores y la expresión de sus receptores, los cuales a su vez participan en la regulación de la neurogénesis.
Algunos de estos neurotransmisores facilitan la potenciación a largo plazo (LTP), fenómeno involucrado directamente con la adquisición de nueva información. En contraste, el estrés y el envejecimiento tienen un efecto negativo sobre la producción de factores de crecimiento, inhibiendo por lo tanto la respuesta en la neurogénesis y en consecuencia en el aprendizaje y la memoria. Zona sub granular (ZSG), capa de células granulares (CCG), capa molecular (CM), 5-hidroxitriptamina (5-HT), dopamina (DA), glutamato (Glu), ácido gamma-aminobutírico (GABA), N-metil-D-aspartato (NMDA), ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico (AMPA).
Bibliografia.
Emotional and cognitive associative learning. A review. Cortex. 2010;46: 845-578.
Duvarci S. Pare D. Amygdala microcircuits controlling learned fear.Neuron 2014; 482: 966–80.9. Sharon
T, Moscovitch M, Gilboa A. Rapid neocortical acquisition oflong-term arbitrary associations independent of the hippocampus. Proc Natl Acad Sci 2011; 108: 1146-51.10.
Squire LR, Wixted JT. The cognitive neuroscience of human memorysince HM. Annu Rev Neurosci 2011; 34: 259–88.11.
Eichenbaum H. The cognitive neuroscience of memory: anintroduction. Oxford University Press. 201112.
Ullman MT. Contributions of memory circuits to language: Thedeclarative/procedural model. Cognition 2004; 92: 231-70.13.
Keefe JO, Nadel L. The hippocampus as a cognitive map. Oxford:Clarendon Press. 1978.14. Burgess N, Maguire EA, O’Keefe J. The human hippocampus and spatial and episodic memory. Neuron 2002; 35:625–41.15.
Buzsáki G, Moser EI. Memory, navigation and theta rhythm in thehippocampal-entorhinal system. Nat Neurosci 2013; 16:130–38.16.
Morris RGM, y col. Memory reconsolidation: sensitivity ofspatial memory to inhibition of protein synthesis in dorsal hippocampus during encoding and retrieval. Neuron 2006; 50, 479–8917.
Quiroga RQ. Concept cells: the building blocks of declarative memory functions. Nat Rev Neurosci 2012; 13: 587-97.18.
Amaral DG, Witter MP. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neurosci 1989;31:571-91.19.
Lavenex P, Banta LP, Amaral DG: Postnatal development of the primate hippocampal formation. Dev Neurosci 2007; 29:179–19.20.
Kivisaari SL, Probst A, Taylor KI. The Perirhinal, Entorhinal, andParahippocampal Cortices and Hippocampus: An Overview ofFunctional Anatomy and Protocol for Their Segmentation in MRImages In fMRI. Springer Berlin Heidelberg 2013. p. 239-67.21.
Witter MP, Wouterlood FG, Naber PA, Van Haeften T: Anatomicalorganization of the parahippocampal-hippocampal network. Ann NYAcad Sci 2000 Jun; 911:1-24.22.
Lavenex P, Suzuki WA, Amaral DG. Perirhinal and parahipocampal cortices of the macaque monkey: Intrinsic projections andinterconnections. J Comp Neurol. 2004; 472:371-94.23.
Witter MP, Amaral DG. Entorhinal cortex of the monkey: V projectionsto the dentate gyrus, hippocampus, and subicular complex. J CompNeurol 1991; 307:437-59.24.
Khalaf-Nazzal R, Francis F. Hippocampal development – old and newfindings. Neurosci 2013; 248:225-42.25.
Laurberg S, Sorensen KE. Associational and commissural collateralsof neurons in the hippocampal formation (hilus fasciae dentate andsubfield CA3. Brain Res 1981; 212:287–00.26.
Ishizuka N, Weber J, Amaral DG. Organization of intrahippocampalprojections originating from CA3 pyramidal cells in the rat. J CompNeurol 1990; 295:580–23.27.
Frotscher M, Seress L, Schwerdtfeger WK, Buhl E. The mossy cells ofthe fascia dentate: a comparative study of their fine structure andsynaptic connections in rodents and primates. J Comp Neurol 1991;312:145–63.28.
Chicurel ME, Harris KM Three-dimensional analysis of the structure and composition of CA3 branched dendritic spines and their synapticrelationships with mossy fiber boutons in the rat hippocampus. JComp Neurol 1999; 325: 169-82.29.
Suzuki W, Amaral DG: Perirhinal and parahippocampal cortices ofthe macaque monkey: cytoarchitectonic and chemo architectonic organization. J Comp Neurol 2003; 463:67–9130.
Kim SM, Ganguli S, Frank LM. Spatial information outflow from thehippocampal circuit: distributed spatial coding and phase precessionin the subiculum. J Neurosci 2012; 32: 11539-58.31.
Zhang SJ, y col. Functional connectivity of the entorhinal–hippocampal space circuit. Philos Trans R Soc Lond B Biol Sci 2013Dec 23; 369(1635):20120516.32.
Eichenbaum H, Cohen NJ. Can we reconcile the declarative memoryand spatial navigation views on hippocampal function? Neuron 2014;83: 764-70.33.
Giovanello KS, Verfaille M, Keane MM. Disproportionate deficit inassociative recognition relative to item recognition in global amnesia.Cogn Affect Behav Neurosci 2003; 3: 186-94.34.
Addis DR, y col. Characterizing spatial and temporal features of autobiographical memory retrieval networks: a partial least squaresapproach. Neuroimage 2004; 23: 1460-71.35.
Bartsch T, Schönfeld R, Müller FJ, Alfke K, Leplow B, Aldenhoff J, KochJM. Focal lesions of human hippocampal CA1 neurons in transientglobal amnesia impair place memory. Science 2010; 328: 1412-15.36.
Churchwell JC, Morris AM, Musso ND, Kesner RP. Prefrontal andhippocampal contributions to encoding and retrieval of spatialmemory. Neurobiol Learn Mem 2010; 93: 415-21.37. Stone SS, y col. Stimulation of entorhinal cortex promotes adultneurogenesis and facilitates spatial memory. J Neurosci 2011; 31:13469-84.38.
Morris RG. Developments of a water-maze procedure for studyingspatial learning in the rat. J Neurosci Methods1984; 11: 47-60.39.
Moser E, Moser MB, Andersen P. Spatial learning impairmentparallels the magnitude of dorsal hippocampal lesions, but is hardlypresent following ventral lesions. J Neurosci 1993; 13: 3916-25.40.
Laursen B, y col. Impaired hippocampal acetylcholine release parallelsspatial memory deficits in Tg2576 mice subjected to basal forebraincholinergic degeneration. Brain Res 2014; 1543: 253-62.41.
Hales JB, Ocampo AC, Broadbent NJ, Clark RE. Hippocampal Infusion of Zeta Inhibitory Peptide Impairs Recent, but Not Remote,Recognition Memory in Rats. Neural Plasticity 2015; 501, 847136.42.
Astur RS, Taylor LB, Mamelak AN, Philpott L, Sutherland RJ.Humans with hippocampus damage display severe spatial memoryimpairments in a virtual Morris water task. Behav Brain Res 2005;132: 77-84.43.
Cornwell BR, Johnson LL, Holroyd T, Carver FW, Grillon C. Humanhippocampal and parahippocampal theta during goal-directed spatialnavigation predicts performance on a virtual Morris water maze. JNeurosci 2008; 28:5983-90.44.
Strange BA, Witter MP, Lein ES, Moser EI. Functional organization ofthe hippocampal longitudinal axis. Nature Rev Neurosci 2014; 15:655-69.45. Hales JB, y col. Medial entorhinal cortex lesions only partially disrupthippocampal place cells and hippocampus-dependent place memory.Cell Rep 2014; 9: 893-01.46.
O´Keefe JA, Dostrovski J. The hippocampus as a spatial map.Preliminary evidence from unit activity in the freely-moving rat. BrainRes 1971 34: 171-5.47.
Hartley T, Lever C, Burgess N, O’Keefe J. Space in the brain: how thehippocampal formation supports spatial cognition.
Philos Trans R SocLond B Biol Sci 2014; 369: 20120510.48. Moser MB, Rowland DC, Moser EI. Place cells, grid cells, and memory.Cold Spring Harb Perspect Med 2015; 7: a021808.49.
Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ. Learning enhancesadult neurogenesis in the hippocampal formation. Nature Neurosci1999; 2: 260–5.50.
Clemenson GD, Deng W, Gage FH. Environmental enrichment andneurogenesis: from mice to humans. Curr Opin Beh Sci 2015; 4: 56-62.51.
Cameron HA, Glover LR. Adult Neurogenesis: Beyond Learning andMemory. Annu Rev Psychol 2015; 66: 53-81.52. Cameron HA, Mckay RD. Adult neurogenesis produces a large poolEl hipocampo: neurogénesis y aprendizajeRev Med UV, Enero – Junio 2015 www.uv.mx/rmof new granule cells in the dentate gyrus. J Comp Neurol 2001; 435:406-17.53.
Fernandes C, y col. Detrimental role of prolonged sleep deprivationon adult neurogenesis. Front Cell Neurosci, 2015; 9:140.54.
Aimone JB, Deng W, Gage FH. Adult neurogenesis in the dentategyrus. In Space, Time and Memory in the Hippocampal Formation.Springer Vienna 2015; pp. 409-429.55.
Eriksson PS, y col. Neurogenesis in the adult human hippocampus.Nature Medicine 1998; 4: 1313-1317.56. Gage FH. Mammalian neural stem cells. Science 2000; 287: 1433–38.57.
Drew LJ, Fusi S, Hen R. Adult neurogenesis in the mammalianhippocampus: Why the dentate gyrus? Learn Mem 2013; 20: 710-29.58.
De La Rosa Prieto C, De Moya Pinilla M, Saiz-Sanchez D, Ubeda-banonI, Arzate DM, Flores-Cuadrado A, Martinez-Marcos A. Olfactory andcortical projections to bulbar and hippocampal adult-born neurons.Front Neuroanat. 2015; 9:4.59.
Kempermann G, Jessberger S, Steiner B, Kronenberg G. Milestones ofneuronal development in the adult hippocampus. Trends Neurosci2004; 27:447-52.60.
Duan L Peng CY, Pan L Kessler JA. Human Pluripotent Stem Cell-Derived Radial Glia Recapitulate Developmental Events and ProvideReal-Time Access to Cortical Neurons and Astrocytes. Stem CellsTransl Med. 2015 Apr 1. pii: sctm.2014-0137.61.
Kirby ED, Kuwahara AA, Messer RL, Wyss-Coray T. Adult hippocampalneural stem and progenitor cells regulate the neurogenic niche bysecreting VEGF. Proc Natl Acad Sci U S A 2015; 112: 4128-33.62.
Toriyama M, y col. Phosphorylation of doublecortin by protein kinaseA orchestrates microtubule and actin dynamics to promote neuronalprogenitor cell migration. J Biol Chem. 2012; 287:12691-702.63.
Vukovic J1, Borlikova GG, Ruitenberg MJ, Robinson GJ, Sullivan RK,Walker TL, Bartlett PF. Immature doublecortin-positive hippocampalneurons are important for learning but not for remembering. JNeurosci. 2013; 33: 6603-13.64.
Espósito MS, Piatti VC, Laplagne DA, Morgenstern NA, FerrariCC, Pitossi FJ, Schinder AF. Neuronal differentiation in the adult hippocampus recapitulates embryonic development. J Neurosci2005; 25:1007486.65.
Cimadamore F, Amador-Arjona A, Chen C, Huang CT, Terskikh AV.SOX2–LIN28/let-7 pathway regulates proliferation and neurogenesisin neural precursors. Proc Natl Acad Sci U S A 2013; 110: E3017-E26.66. Kim HS, y col. PSA-NCAM+ Neural Precursor Cells from HumanEmbryonic Stem Cells Promote Neural Tissue Integrity and BehavioralPerformance in a Rat Stroke Model. Stem Cell Rev 2014; 10: 761-771.67.
Schmidt-Hieber C, Jonas P, Bischofberger J. Enhanced synapticplasticity in newly generated granule cells of the adult hippocampus.Nature 2004; 429:184–87.68. Ge S, y col. GABA regulates synaptic integration of newly generatedneurons in the adult brain. Nature 2006; 439:589–93.69.
Lledo MP, Alononso M, Grubb MS. Adult neurogenesis and functionalplasticity in neuronal circuits. Nat Rev Neurosci 2006; 7:179-93.70.
Kim WR, Christian K, Ming GL, Song H. Time-dependent involvementof adult-born dentate granule cells in behavior. Behav Brain Res 2012;227: 470-79.71.
Benarroch EE. Adult neurogenesis in the dentate gyrus generalconcepts and potential implications. Neurology 2013; 81: 1443-52.72.
Song J, M Christian K, Ming GL, Song H. Modification of hippocampalcircuitry by adult neurogenesis. Dev Neurobiol 2012; 72: 1032-43.73.
Imayoshi I, Kageyama R. The role of Notch signaling in adultneurogenesis. Mol Neurobiol 2011; 44: 7-12.74. Mu L, y col. SoxC transcription factors are required for neuronaldifferentiation in adult hippocampal neurogenesis. J Neurosci 2012;32: 3067-80.75.
Gould E, Vail N, Wagers M, Gross CG. Adult-generated hippocampaland neocortical neurons in macaques have a transient existence.Proc Natl Acad Sci U S A 2001; 98:10910-17.76.
Fabel K, y col. Additive effects of physical exercise and environmentalenrichment on adult hippocampal neurogenesis in mice. FrontNeurosci 2009; 3:50.77.
Kempermann, G. Activity-Based Maintenance of Adult HippocampalNeurogenesis: Maintaining a Potential for Lifelong Plasticity. InNeural Stem Cells in Development, Adulthood and Disease 2015 (pp.119-123). Springer New York.78.
Zhao C, Deng W, Gage FH. Mechanisms and functional implications ofadult neurogenesis. Cell 2008;132: 645–6079. Clelland D, y col. A functional role for adult hippocampal neurogenesisin spatial pattern separation. Science 2009; 325: 210-13.80.
Speisman RB, y col. Environmental enrichment restores neurogenesisand rapid acquisition in aged rats. Neurobiol Aging 2013; 34: 263-74.81.
Merritt JR, Rhodes JS. Mouse genetic differences in voluntary wheelrunning, adult hippocampal neurogenesis and learning on the multistrain-adapted plus water maze.
Behav Brain Res 2015; 280: 62-71.82. Deng W, Gage FH. The effect of immature adult-born dentate granulecells on hyponeophagial behavior is related to their roles in learningand memory. Front Syst Neurosci 2015; 9.83.
Opendak M, Gould E. Adult neurogenesis: a substrate for experiencedependentchange. Trends Cogn Sci 2015; 19: 151-61.84. Trinchero MF, y col. Effects of spaced learning in the water mazeon development of dentate granule cells generated in adult mice.Hippocampus 2015. doi: 10.1002/hipo.22438.85. Jamal AL, y col. Transplanted dentate progenitor cells show increasedsurvival in an enriched environment, but do not exert a neurotrophiceffect on spatial memory within 2 weeks of engraftment. CellTransplan 2015. http://dx.doi.org/10.3727/096368915X68701186.
Peters M, Muñoz-López M, Morris RG. Spatial memory andhippocampal enhancement. Current Opinion in Behavioral Sciences2015. http://dx.doi.org/10.1016/j.cobeha.2015.03.00587.
Dobrossy MD, y col. Differential effects of learning on neurogenesis:Learning increases or decreases the number of newly born cellsdepending on their birth date. Mol Psychiatry 2003; 8: 974-82.88.
Leuner B, Mendolia-Loffredo S, Kozorovitskiy Y, Samburg D, GouldE, Shors TJ. Learning enhances the survival of new neurons beyondthe time when the hippocampus is required for memory. J Neurosci2004; 24: 7477-81.89.
Dupret D, y col. Spatial learning depends on both the addition andremoval of new hippocampal neurons. PLoS biology 2007; 5: e214.90. Dupret D, y col. Spatial relational memory requires hippocampaladult neurogenesis. PloS one 2008; 3: e1959.91.
Epp JR, Haack AK., Galea LA. Activation and survival of immatureneurons in the dentate gyrus with spatial memory is dependent ontime of exposure to spatial learning and age of cells at examination.Neurobiol Learn Mem 2011; 95: 316-25.92.
Lacefield CO, y col. Effects of adult‐generated granule cells oncoordinated network activity in the dentate gyrus. Hippocampus2012; 22: 106-16.93.
van Praag H, Kempermann G, Gage FH. Running increases cellproliferation and neurogenesis in the adult mouse dentate gyrus.Nature Neuroscience 1999; 2: 266-70.94.
Birch AM, McGarry NB, Kelly ÁM. Short‐term environmentalenrichment, in the absence of exercise, improves memory,and increases NGF concentration, early neuronal survival, andsynaptogenesis in the dentate gyrus in a time‐dependent manner.Hippocampus 2013; 23: 437-50.95.
Kempermann G, Kuhn HG, Gage FH. More hippocampal neuronsin adult mice living in an enriched environment. Nature 1997; 386:493–95.96.
Nilsson M, Perfilieva E, Johansson U, Orwar O, Eriksson PS. Enrichedenvironment increases neurogenesis in the adult rat dentate gyrusand improves spatial memory. J Neurobi 1999; 39: 569-78.28 www.uv.mx/rm97.
Hillman CH, Erickson KI, Kramer AF. Be smart, exercise your heart:exercise effects on brain and cognition. Nature Rev Neurosci 2008;9:58–65.98.
Erickson KI, y col. Exercise training increases size of hippocampus andimproves memory. Proc Natl Acad Sci U S A. 2011; 108: 3017-22.99.
Muotri AR, Zhao C, Marchetto MC, Gage FH. Environmental influenceon L1 retrotransposons in the adult hippocampus. Hippocampus2009; 19:1002–07.100.
Kempermann, G. New neurons for’survival of the fittest’. Nat RevNeurosci. 2012; 13:727-36.101. Liu HL, Zhao
, Cai K, Zhao HH, Shi LD. Treadmill exercise prevents
Juan David Olivares Hernández1,Enrique Juárez Aguilar2,Fabio García García2.Rev Med UV, Enero – Junio 201521
 Imagen microscópica con microglia verde envuelve placas amiloide azul
Imagen microscópica con microglia verde envuelve placas amiloide azul




 Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum
Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum  .hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína
.hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína 

 Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.



 Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum
Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica(Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flechaazul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecharoja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE)proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral(VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas.Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a travésde los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentrode la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa IIde la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de lacapa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyeccionesexcitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: cortezaentorrinal; GD: giro dentado; Sub:subiculum  .hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína
.hipocampo tienen graves dificultades en un testvirtual semejante al laberinto acuático de Morris 42,43. Las afectaciones en el aprendizaje espacial sonproporcionales con el volumen de tejido dañado ydependen de la región anatómica del hipocampolesionado, ya que las lesiones en el hipocampo dorsalproducen un mayor deterioro en el aprendizaje quelas lesiones en el hipocampo ventral 44. Las lesioneshipocampales parecen deteriorar específicamenteel aprendizaje y la memoria espacial, ya que las ratascon el hipocampo dañado muestran dificultadespara aprender tareas espaciales como la localizaciónde una plataforma escondida pero no para adquiriruna tarea de discriminación no espacial 44, 45.Entonces, parece claro que el hipocampo juega unpapel crítico para procesar y recordar informaciónespacial.Por otro lado, registros de actividadunitaria (registro de potenciales de acción) hanreportado la presencia de neuronas denominadasde “lugar” en el hipocampo de la rata, estás célulasse denominan así porque disparan sus potencialesde acción cuando la rata reconoce un lugar en el quepreviamente se le había colocado 46, 47. En conjuntoestás evidencias sugieren que el hipocampo esuna estructura cerebral implicada en aspectoscognitivos que involucran el reconocimiento dela ubicación espacial, para lo cual los sujetos seayudan de la estimación de la distancia entre unobjeto y los estímulos relacionados que lo llevaron a encontrarlo48. Aunque, es claro que el hipocampo juega un papel crítico enel aprendizaje espacial, el mecanismo es complejo y requierede la acción coordinada del hipocampo con otras estructurascerebrales.Hipocampo y neurogénesisEl giro dentado del hipocampo junto con la zona subventricularde los ventrículos laterales del cerebro de mamífero son los dossitios de generación de nuevas neuronas durante la etapa adulta,y se sabe que dichas neuronas tienen un papel importanteen varias funciones del sistema nervioso central 49, 50, 51. Elfenómeno de producción de nuevas células es conocido con eltérmino de neurogénesis y generalmente se refiere al procesode proliferación, migración, supervivencia y diferenciaciónde nuevas células 52, 53, 54 (figura 2). La neurogénesis ocurrecontinuamente en el giro dentado del hipocampo adulto ycomparte algunas características con la neurogénesis que tienelugar durante el desarrollo embrionario. Durante el procesode neurogénesis concurren células troncales y progenitoresneurales, en conjunto conocidos como precursores neurales,originados a partir de la división asimétrica de las primeras, lascuales darán lugar a los tres tipos principales de células en elsistema nervioso central: neuronas, glia y oligodendrocitos 55,56, 57.La neurogénesis en el giro dentado del hipocampose demostró hace cuarenta años en autoradiografías tomadasde una zona, la cual en contraste con la zona subventricular,no se localiza cerca de las paredes de los ventrículos laterales;sino que se encuentra localizada por debajo del borde medialdel hipocampo y en su profundidad. Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2by 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína 

 Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta deparpadeo y la evitación activa no favorecen la neurogénesisen el giro dentado. Se ha reportado que el aprendizaje per se,y no el entrenamiento, es el factor que induce la activación yla regulación de la neurogénesis hipocampal 83. Por ejemplo, elaprendizaje espacial en el laberinto acuático de Morris produceefectos diferenciales sobre el desarrollo de los precursoresneurales del giro dentado 84, 85. En este sentido, se ha reportadoque el aprendizaje induce apoptósis de las nuevas células durantela fase inicial del aprendizaje, aquellas células nacidas tres díasantes de iniciar el entrenamiento, y la supervivencia de aquellasneuronas maduras, nacidas siete días antes de comenzar elentrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por elaprendizaje es específica para la zona subgranular del girodentado, ya que no se observó en CA1 y CA3 En contraste, lainhibición de la apoptosis en ratas que comienzan a aprenderuna tarea muestra un deterioro del recuerdo de la posición de laplataforma oculta, así como una disminución de la proliferacióncelular, característica de la fase inicial del aprendizaje. Enconjunto, estas evidencias sugieren que el aprendizaje espacialactiva un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activade algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño delos roedores en pruebas de aprendizaje y memoria espacial dependientes de hipocampo 96.Por otra parte, existe reportes de que el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado93. El ejercicio además favorece la eficacia sinápticaen neuronas del giro dentado y mejora el aprendizajeespacial de los roedores en el laberinto acuático deMorris 101,102. Estos resultados sugieren que la mejoraen el aprendizaje debido al ejercicio se debe en partea la inducción de neurogénesis en el hipocampo.El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevasneuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro BDNF se incrementa en el hipocampo del ratón después de ejercicio 103.
 Neuronas humanas derivadas de células madre y mantenidas ‘in vitro’ o trasplantadas en el córtex del cerebro de rata.
Neuronas humanas derivadas de células madre y mantenidas ‘in vitro’ o trasplantadas en el córtex del cerebro de rata.
 Los flavonoides de la soja pueden contrarrestar efectos antioxidantes en el organismo. Foto: DM.
Los flavonoides de la soja pueden contrarrestar efectos antioxidantes en el organismo. Foto: DM.



 Punto de incisión normalizado para lobotomía pre-frontal / leucotomía desarrollada por Freeman y Watts.Este procedimiento se refiere comúnmente a toda clase de cirugías en los lóbulos frontales del cerebro, prefrontal —también llamada leucotomía—, frontal, temporal y parietal; sin embargo, debe llamarse propiamente lobotomía a la destrucción de las
Punto de incisión normalizado para lobotomía pre-frontal / leucotomía desarrollada por Freeman y Watts.Este procedimiento se refiere comúnmente a toda clase de cirugías en los lóbulos frontales del cerebro, prefrontal —también llamada leucotomía—, frontal, temporal y parietal; sin embargo, debe llamarse propiamente lobotomía a la destrucción de las