LA NEUROGLIA EN LA RESPUESTA INMUNE DEL SISTEMA NERVIOSO CENTRAL
Neuroglia del sistema nervioso
La neuroglia es entre otras capacidades la respuesta inmune local en base al estudio de diversas patologías infecciosas y auto-inmunes del sistema nervioso central, tanto en humanos como en modelos murinos.
Es muy posible que la neuroglia sea fundamentalmente una inflamación contra particulas de varias extirpes entre ella microbianas, pero además tenga otras propiedades como la reparadora del sistema nervioso.
La neuroglia secreta y es blanco de diferentes citocinas y quimocinas que participan en la respuesta inflamatoria del sistema nervioso ante agresiones de diversos tipos tanto biológicas como físicas. Se ha demostrado la presencia in vivo de moléculas de clase I del complejo mayor de histocompatibilidad en la microglia, los astrocitos y los oligodendrocitos pero sólo durante procesos inflamatorios, la presencia de moléculas de clase II se ha comprobado únicamente en la microglia y su identificación en los astrositos es motivo de controversia. La presencia de algunos marcadores inmunológicos en la neuroglia y los estudios funcionales ha permitido identificar mecanismos como la fagocitosis y la presentación de antígenos a los linfocitos TCD4+ por parte de la microglia, la secreción de citocinas por los astrocitos y la presencia en oligodendrocitos de receptores para estos factores solubles. Todos estos avances han permitido la comprensión de algunos mecanismos fisio-patogénicos y la posible aplicación de novedosas medidas terapéuticas en el sistema nervioso central. central, neuroinmunología (Acta Neurol Colomb 2007;23:25-30). .
El sistema nervioso central (SNC) se ha considerado como un sistema inmuno-privilegiado. Esta definición se basa en diferentes características locales como la presencia de una barrera hematoencefálica y la ausencia de drenaje linfático convencional. Además, en condiciones normales el SNC no exhibe moléculas del complejo mayor de histocompatibilidad (CMH) ni se detectan células profesionales presentadoras de antígeno.
La ruptura de la barrera hematoencefálica durante procesos patológicos como las enfermedades infecciosas o auto-inmunes permite la entrada de células sanguíneas, disparando una serie de eventos inmunes donde no sólo participan diversos componentes del sistema de defensa sino también elementos locales como la neuroglia (1). La neuroglia comprende un grupo heterogéneo de células, que sirven de soporte al tejido nervioso y facilitan diversas funciones en el cerebro y la médula espinal. Incluidos en la neuroglia se encuentran los astrocitos, la microglia y los oligodendrocitos.
El conocimiento del papel de la neuroglia en la inmunidad del SNC se basa principalmente en los datos obtenidos de pacientes con esclerosis múltiple (EM), enfermedad autoinmune que ataca el SNC (2), y en el modelo murino denominado encefalomielitis autoinmune experimental (EAE) (3). En humanos las extrapolaciones fisiopatológicas se basan en mediciones realizadas en el líquido cefalorraquídeo (LCR) y en los especímenes de autopsias del SNC.
Otras contribuciones al entendimiento de la respuesta inmune en el SNC provienen de modelos de enfermedades virales en ratones, como la infección intracerebral con coronavirus, principalmente la variante neuropatógena del virus de la hepatitis de ratón (JHMV) y el picornavirus productor de la encefalomielitis viral murina de Theiler (TMEV) (4, 5).
Las dificultades para el estudio de las células neurogliales radica en la falta de marcadores de superficie para su identificación plena, además de la existencia de una compleja red de comunicaciones establecida entre la neuroglia misma y las neuronas.
En su mayoría, los estudios in vitro con neuroglia se realizan utilizando células fetales o neonatales humanas o de ratones que, si bien, no representan los estadios maduros ni ejemplifican la red de comunicación celular permiten la definición de mecanismos específicos. En este artículo se revisan temas relacionados con los eventos inmunes en los cuales participa la neuroglia durante la defensa del SNC. En la actualidad, se reconoce a la neuroglia como una parte activa de la defensa del sistema nervioso contra las agresiones microbianas, físicas y químicas.
La microglia se considera como los macrófagos del SNC. Las células microgliales comparten con los macrófagos la función y la presencia de varios marcadores y su origen en la medula ósea (6,7).
Los macrófagos y la microglia presentan marcadores de superficie como los receptores para la fracción cristalizable (FC) de los anticuerpos como CD16, CD32, moléculas de adhesión como CD11b y CD54 (ICAM-1) y F4/80, éste último presente sólo en ratones (8).
Esta paridad en la presencia de marcadores complica la diferenciación entre microglia y macrófagos en los tejidos, sin embargo, en manos expertas pueden distinguirse por su morfología (9). Existen marcadores en humanos como CD163, el cual permite diferenciar los macrófagos perivasculares de la microglia (10). De otra parte, las células del SNC separadas por medio de digestión enzimática (ej. tripsina, colagenasa etc.) pueden diferenciarse de acuerdo con la presencia del marcador CD45, que identifica células originadas en la médula ósea (11). En condiciones normales las células con alto contenido de CD45 (CD45 alto) no se encuentran en el SNC, pero ganan acceso al romperse la barrera hematoencefálica. Las células CD45 con bajo nivel (CD45bajo) representan principalmente la microglia y las poblaciones CD45 negativas (CD45neg) que contiene principalmente oligodendrocitos, astrocitos, células endoteliales y otras poblaciones aún no identificadas
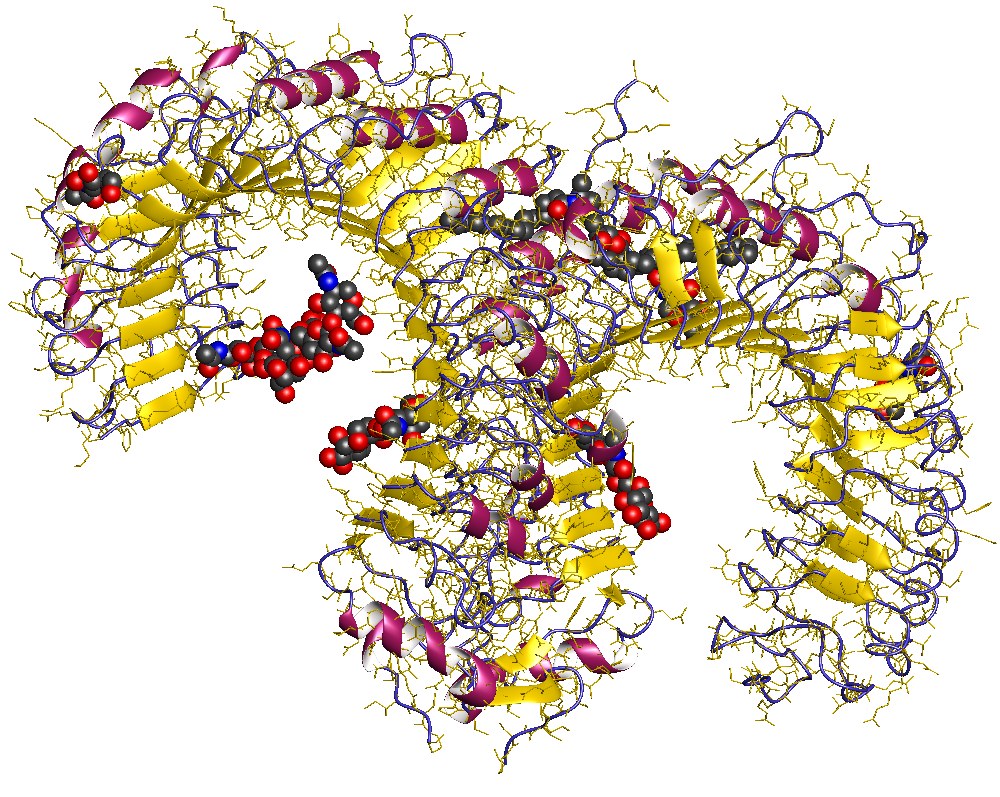 Los receptores tipo Toll (o Toll-like receptor TLRs) constituyen una familia de proteínas que forman parte del sistema inmunitario innato. Estos receptores son transmembranosos y reconocen patrones moleculares expresados por un amplio espectro de agentes infecciosos, y estimulan una variedad de respuestas inflamatorias. Además, la señalización mediada por los TLRs en las células presentadoras de antígeno (CPAs) representa una parte importante en el vínculo entre la respuesta inmune innata y la adaptativa. Proteínas de esta familia se encuentran en plantas, invertebrados, y vertebrados, ya que desempeñan un papel clave en unas vías de señalización bien conservadas.1 Después de las defensinas, pueden ser el componente del sistema inmune más antiguo. Existen 11 TLRs en el ser humano, cada TLRs está codificado por un gen diferente.
Los receptores tipo Toll (o Toll-like receptor TLRs) constituyen una familia de proteínas que forman parte del sistema inmunitario innato. Estos receptores son transmembranosos y reconocen patrones moleculares expresados por un amplio espectro de agentes infecciosos, y estimulan una variedad de respuestas inflamatorias. Además, la señalización mediada por los TLRs en las células presentadoras de antígeno (CPAs) representa una parte importante en el vínculo entre la respuesta inmune innata y la adaptativa. Proteínas de esta familia se encuentran en plantas, invertebrados, y vertebrados, ya que desempeñan un papel clave en unas vías de señalización bien conservadas.1 Después de las defensinas, pueden ser el componente del sistema inmune más antiguo. Existen 11 TLRs en el ser humano, cada TLRs está codificado por un gen diferente.
La microglia participa en la respuesta innata en el SNC, ejemplo de ello es la expresión de receptores tipo “toll” (TLR) incluyendo el TLR4 que une el lipopolisacárido (LPS) o el TLR2 que une peptidoglicanos, ambos componentes derivados de las paredes bacterianas, inductoras Acta Neurol Colomb Vol. 23 No. 1 Marzo 2007 de la producción de citoquinas como interferones (IFN) tipo I, interleucina 1 (IL-1), IL-6, IL-12 y del factor de necrosis tumoral (TNF-α) (12), además de derivados del óxido nítrico (NO) (13), todos ellos elementos importantes de la respuesta inflamatoria. Igualmente, la expresión de múltiples receptores de quimiocinas y citocinas por parte de la microglia indica su rápida capacidad de respuesta y migración a los sitios de inflamación (14).
Como los macrófagos, la microglia presenta el marcador CD36 y otros receptores tipo “scanvengers” (SR) que median la fagocitosis (15,16), función que aumenta in vitro en presencia de glucocorticoides (17).
La microglia también participa en la respuesta inmune específica del SNC mediante la expresión de moléculas del CMH, ambas moléculas reguladas por la presencia de IFN-γ (9). La presencia en la microglia de moléculas de clase II y moléculas co-estimuladoras como CD54, CD80 y CD86 entre otras, detectadas durante procesos inflamatorios sugieren una posible función en la presentación antigénica a los linfocitos T CD4+ (18,19). Diversos estudios implican estas células en la presentación de antígenos propios de la mielina en la patogénesis de la EM.
La microglia también posee funciones inmunoreguladoras como la producción de citocinas antiinflamatorias como el factor transformador de crecimiento (TGF-ß1) y la IL-10 cuya secreción se aumenta in vitro, luego de la fagocitosis de cuerpos apoptóticos (20,21). Actualmente, la microglia es blanco activo en la búsqueda de nuevas terapias como las estatinas, para el tratamiento de la EM (22).
La formación y mantenimiento de la barrera hematoencefálica en el SNC es una de las principales funciones de los astrocitos, además, estas células secretan factores de crecimiento neural y participan en la remoción de compuestos neurotóxicos (23). No se han descrito marcadores de superficie para la identificación de los astrocitos, no obstante, existen marcadores intracelulares como la proteína ácida gliofibrilar (GFAP), el más específico de ellos, y la proteína ácida de unión a calcio o S-100 (24), que se encuentran no solamente en los astrocitos sino también en algunas neuronas. Una de las limitaciones del estudio in vitro de los astrocitos radica en la baja cantidad de células obtenidas, luego de la digestión enzimática de tejido nervioso, probablemente debido a la pérdida de sus prolongaciones citoplasmáticas. Sin embargo, los cultivos primarios de astrocitos fetales y neonatales de ratones o humanos, y los estudios in vivo con astrocitos de ratones trasgénicos han permitido la disección de sus funciones inmunes. El papel de los astrocitos en la defensa del SNC se basa en dos aspectos fundamentales: la secreción de factores solubles como (citocinas y quimocinas) y la presentación de antígenos en el contexto de las moléculas de clase II del CMH (25). Los astrocitos en condiciones normales producen IL-6, IL-10 y CXCL12 (SDF-1α/β) producción que aumenta en respuesta a estímulos/ inflamatorios (14,26,27).
La quimocina CXCL12
Marín ha detallado las potenciales aplicaciones del hallazgo: «Conocer cómo se distribuyen las interneuronas por la corteza cerebral y cuándo no logran hacerlo de manera adecuada puede servir para desarrollar nuevos métodos de diagnóstico precoz de enfermedades relacionadas con la pérdida de equilibrio en la corteza y, eventualmente, para su tratamiento».
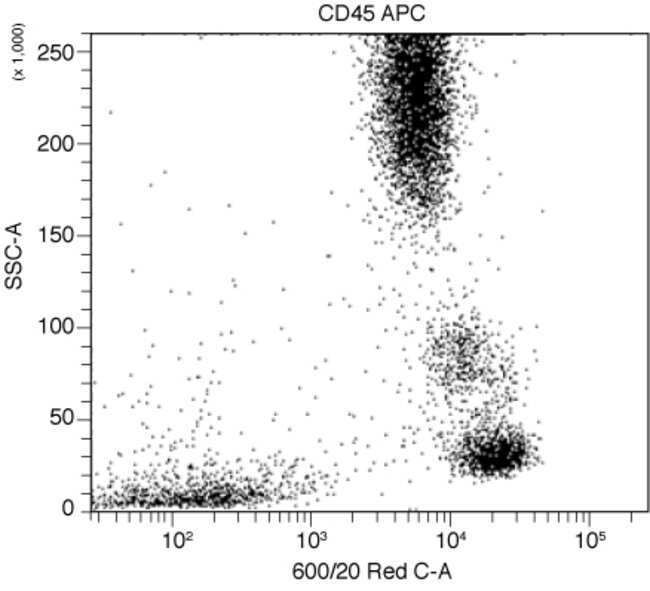
Gráfico de puntos obtenido por citometría de flujo usando células derivadas de cerebro de ratón, durante el curso de una infección viral. el tejido digerido con enzimas es separado por gradiente de densidad y las células obtenidas son marcadas con el anticuerpo anti-cd45. nótese la separación en tres poblaciones de acuerdo con la expresión de cd45, cd45alta que corresponde a las células derivadas de medula ósea que infiltran el cerebro, cd45baja corresponde a la microglia y las cd45neg corresponden a oligodendrocitos, astrocitos y otras células sin identificarS 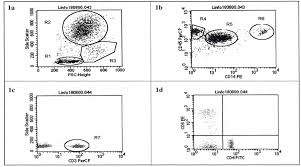
La neuroglia en la respuesta inmune del sistema nervioso central se ha implicado en el proceso de diferenciación de los linfocitos B en el SNC, importante para la producción de anticuerpos in situ (28). Junto con la microglia, los astrocitos producen quimocinas atrayentes de macrófagos como CCL2 (MCP-1), CCL3 (MIP-1α) y CCL-8 (MCP-2) o atrayentes de linfocitos como CCL5 (RANTES) y CXCL10 (IP-10), todos ellas necesarias durante la respuesta inmune del SNC a noxas infecciosas (14,29). La función de los astrocitos como célula presentadora de antígeno a linfocitos TCD4+ es un tema controversial (30). La presencia de moléculas de clase II se detecta en astrocitos cultivados (31) y sólo en pocos estudios se ha demostrado la presencia de clase II, como por ejemplo, en lesiones de pacientes con EM (32). La expresión de moléculas de clase II de los astrocitos in vitro es regulada por el FNTα o el IFNγ permitiendo así la presentación de antígenos derivados de la mielina a clones de linfocitos T, sin embargo, el reconocimiento de los péptidos cortos derivados de la mielina es mejor que el reconocimiento de las proteínas completas (33). Estos hallazgos podrían implicar por que los astrocitos no poseen toda la maquinaria completa para realizar el procesamiento y la presentación antigénica en el contexto de las moléculas de clase II del CMH (34).
OLIGODENDROCITOS COMO BLANCO DE CITOCINAS TIPO TH2
Los oligodendrocitos cumplen un papel preponderante en la síntesis y mantenimiento de la capa de mielina. Los oligodendrocitos son células altamente especializadas en el trasporte y producción de lípidos y demás proteínas componentes de la mielina (35). Como otras células del SNC poseen poca capacidad de renovación y se encuentran en estado quiescente. Sin embargo, los precursores de oligodendrocitos (OPC) inducen remielinización luego de la pérdida de mielina, como consecuencia de agresiones inmunes o microbianas (36). Existen diferentes moléculas que permiten la identificación de los oligodendrocitos dependiendo de su estado de maduración. Los marcadores como la 3´-fosfodiesterasa 2´,3´- cíclica de nucleótidos (CNP) y el antígeno O4 identifican los oligodendrocitos en todos los estadios; mientras que el marcador A2B5 identifica a los OPC y las proteínas componentes de la mielina como la proteína básica de mielina (MBP), la glicoproteína de mielina del oligodendrocito (MOG), la glicoproteína asociada a la mielina (MAG) y la proteína proteolipídica (PLP) permiten la identificación de las células maduras (35). Los oligodendrocitos en condiciones normales no poseen moléculas del CMH, pero la expresión de clase I se ha observado a continuación de infecciones virales o por exposición al IFN-γ (37,38). El mecanismo efector de respuesta de los linfocitos T CD8+ en reconocimiento a las moléculas de clase I no se ha determinado in vivo, sin embargo, se ha demostrado en cultivos celulares el efecto citotóxico de los linfocitos T CD8+ sobre los oligodendrocitos (39). Aunque no se ha detectado la producción de citoquinas Astrocitos Microglia Oligodendrocitos Origen Neuroectodermo Mesenquimal Neuroectodermo ¿Mesenquimal? Función neurológica Formación de la barrera Vigilancia y defensa Formación y mantenimiento hematoencefálica Reparación tisular de la capa de mielina Soporte metabólico Principal función Secreción de citoquinas Fagocitosis Blanco de citoquinas inmune y quimoquinas Secreción quimoquinas y quimoquinas ¿Presentación a linfocitos CD4+? Presentación a linfocitos T CD4+ Principales GFAP CD45bajo/CD11b+ CD45negativo/O4+ marcadores TABLA 1. CARACTERÍSTICAS DE LA NEUROGLIA. Acta Neurol Colomb Vol. 23 No. 1 Marzo 2007 por parte de los oligodendrocitos en el SNC de individuos normales, estos sí poseen receptores para algunas de ellas como receptor para IL-4, IL-6 e IL-10 (27). Todos estos receptores unen citocinas pertenecientes al tipo Th2, las cuales podrían tener efecto protector en el sistema nervioso. Los oligodendrocitos de individuos normales igualmente también presentan el receptor para IL-12 y se han observado los receptores para IFN-γ e IL-18 durante procesos inflamatorios del SNC (27, 40, 41). Finalmente, los oligodendrocitos humanos expresan los receptores de quimocinas CXCR1, CXCR2 y CXCR3 y de este último receptor su ligando CXC1L0 (IP-10) (41). La determinación del efecto de las citoquinas sobre los oligodendrocitos permitirá conocer aspectos importantes en el sistema nervioso central sobre la supervivencia o muerte de estas células, la pérdida de mielina o la remielinización.
La neuroglia no sólo participa en los procesos clásicos como soporte y reparación del SNC es además parte activa de los procesos locales de defensa de forma directa y a través de la interacción con el sistema inmune, involucrado durante los procesos patológicos.
REFERENCIAS
1. Pachter JS, de Vries HE, Fabry Z. The blood-brain barrier and its role in immune privilege in the central nervous system. J Neuropathol Exp Neurol 2003;62:593-604. 2. Kornek B, Lassmann H. Neuropathology of multiple sclerosis-new concepts. Brain Res Bull 2003;61:321-6. 3. Skundric DS. Experimental models of relapsingremitting multiple sclerosis: current concepts and perspective. Curr Neurovasc Res 2005;2:349-62. 4. Stohlman SA, Weiner LP. Chronic central nervous system demyelination in mice after JHM virus infection. Neurology 1981;31:38-44. 5. Rodriguez M, Leibowitz JL, Lampert PW. Persistent infection of oligodendrocytes in Theiler’s virus-induced encephalomyelitis. Ann Neurol 1983;13:426-33. 6. Hickey WF, Kimura H. Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo. Science 1988;239:290-2. 7. Eglitis MA, Mezey E. Hematopoietic cells differentiate into both microglia and macroglia in the brains of adult mice. Proc Natl Acad Sci U S A 1997;94:4080-5. 8. Rempel JD, Murray SJ, Meisner J, Buchmeier MJ. Differential regulation of innate and adaptive immune responses in viral encephalitis. Virology 2004;318:381-92. 9. Streit WJ, Conde JR, Fendrick SE, Flanary BE, Mariani CL. Role of microglia in the central nervous system’s immune response. Neurol Res 2005;27:685-91. 10. Fabriek BO, Van Haastert ES, Galea I, Poliet MM, Dopp ED, Van Den Heuvel MM et al. CD163-positive perivascular macrophages in the human CNS express molecules for antigen recognition and presentation Glia. 2005;51:297-305. 11. Sedgwick JD, Schwender S, Imrich H, Dorries R, Butcher GW, ter Meulen V. Isolation and direct characterization of resident microglial cells from the normal and inflamed central nervous system. Proc Natl Acad Sci U S A 1991;88:7438-42. 12. Olson JK, Miller SD. Microglia initiate central nervous system innate and adaptive immune responses through multiple TLRs. J Immunol 2004;173:3916-24. 13. Pawate S, Shen Q, Fan F, Bhat NR. Redox regulation of glial inflammatory response to lipopolysaccharide and interferon gamma. J Neurosci Res 2004;77:540-51. 14. Cartier L, Hartley O, Dubois-Dauphin M, Krause KH. Chemokine receptors in the central nervous system: role in brain inflammation and neurodegenerative diseases. Brain Res Rev 2005;48:16-42. 15. Husemann J, Loike JD, Kodama T, Silverstein SC. Scavenger receptor class B type I (SR-BI) mediates adhesion of neonatal murine microglia to fibrillar beta-amyloid. J Neuroimmunol 2001;114:142-50. 16. Chan A, Magnus T, Gold R. Phagocytosis of apoptotic inflammatory cells by microglia and modulation by different cytokines: mechanism for removal of apoptotic cells in the inflamed nervous system. Glia 2001;33:87-95. 17. Pender MP, Rist MJ. Apoptosis of inflammatory cells in immune control of the nervous system: role of glia. Glia 2001;36:137-44. 18. Wong GH, Bartlett PF, Clark-Lewis I, Battye F, Schrader JW. Inducible expression of H-2 and Ia antigens on brain cells. Nature 1984;310:688-91. La neuroglia en la respuesta inmune del sistema nervioso central 19. Woodroofe MN, Bellamy AS, Feldmann M, Davison AN, Cuzner ML. Immunocytochemical characterisation of the immune reaction in the central nervous system in multiple sclerosis. Possible role for microglia in lesion growth. J Neurol Sci 1986;74:135-52. 20. Jack CS, Arbour N, Manusow J, Montgrain V, Blain M, McCrea E, et al. TLR signaling tailors innate immune responses in human microglia and astrocytes. J Immunol 2005;175:4320-30. 21. Magnus T, Chan A, Grauer O, Toyka KV, Gold R. Microglial phagocytosis of apoptotic inflammatory T cells leads to down-regulation of microglial immune activation. J Immunol 2001;167:5004-10. 22. Youssef S, Stuve O, Patarroyo JC, Ruiz PJ, Radosevich JL, Hur EM, et al. The HMG-CoA reductase inhibitor, atorvastatin, promotes a Th2 bias and reverses paralysis in central nervous system autoimmune disease. Nature 2002;420:78-84. 23. Rubin LL, Staddon JM. The cell biology of the blood-brain barrier. Annu Rev Neurosci 1999;22:11-28. 24. Dittmann L, Axelsen NH, Norgaard-Pedersen B, Bock E. Antigens in human glioblastomas and meningiomas: Search for tumour and onco-foetal antigens. Estimation of S-100 and GFA protein. Br J Cancer 1977;35:135-41. 25. Dong Y, Benveniste EN. Immune function of astrocytes. Glia 2001;36:180-90. 26. Croitoru-Lamoury J, Guillemin GJ, Boussin FD, Mognetti B, Gigout LI, Cheret A, et al. Expression of chemokines and their receptors in human and simian astrocytes: evidence for a central role of TNF alpha and IFN gamma in CXCR4 and CCR5 modulation. Glia 2003;41:354-70. 27. Cannella B, Raine CS. Multiple sclerosis: cytokine receptors on oligodendrocytes predict innate regulation. Ann Neurol 2004 ;55:46-57. 28. Pashenkov M, Soderstrom M, Link H. Secondary lymphoid organ chemokines are elevated in the cerebrospinal fluid during central nervous system inflammation. J Neuroimmunol 2003;135:154-60. 29. Lane TE, Asensio VC, Yu N, Paoletti AD, Campbell IL, Buchmeier MJ. Dynamic regulation of alpha- and beta-chemokine expression in the central nervous system during mouse hepatitis virus-induced demyelinating disease. J Immunol 1998;160:970-8. 30. Fontana A, Fierz W, Wekerle H. Astrocytes present myelin basic protein to encephalitogenic T-cell lines. Nature 1984;307:273-6. 31. Fierz W, Endler B, Reske K, Wekerle H, Fontana A. Astrocytes as antigen-presenting cells. I. Induction of Ia antigen expression on astrocytes by T cells via immune interferon and its effect on antigen presentation. J Immunol 1985;134:3785-93. 32. Traugott U, Scheinberg LC, Raine CS. On the presence of Ia-positive endothelial cells and astrocytes in multiple sclerosis lesions and its relevance to antigen presentation. J Neuroimmunol 1985;8:1-14. 33. Soos JM, Morrow J, Ashley TA, Szente BE, Bikoff EK, Zamvil SS. Astrocytes express elements of the class II endocytic pathway and process central nervous system autoantigen for presentation to encephalitogenic T cells. J Immunol 1998;161:5959-66. 34. Gresser O, Weber E, Hellwig A, Riese S, RegnierVigouroux A. Immunocompetent astrocytes and microglia display major differences in the processing of the invariant chain and in the expression of active cathepsin L and cathepsin S. Eur J Immunol 2001;31:1813-24. 35. Baumann N, Pham-Dinh D. Biology of oligodendrocyte and myelin in the mammalian central nervous system. Physiol Rev 2001;81:871-927. 36. Casaccia-Bonnel P, Liu A. Relationship between cell cycle molecules and onset of oligodendrocyte differentiation. J Neurosci Res 2003;72:1-11. 37. Suzumura A, Silberberg DH, Lisak RP. The expression of MHC antigens on oligodendrocytes: induction of polymorphic H-2 expression by lymphokines. J Neuroimmunol 1986;11:179-90. 38. Hirayama M, Yokochi T, Shimokata K, Lida M, Fujiki N. Induction of human leukocyte antigen-A,B,C and -DR on cultured human oligodendrocytes and astrocytes by human gamma-interferon. Neurosci Lett 1986;72:369-74. 39. Ruijs TC, Freedman MS, Grenier YG, Olivier A, Antel JP. Human oligodendrocytes are susceptible to cytolysis by major histocompatibility complex class I-restricted lymphocytes. J Neuroimmunol 1990;27:89-97. 40. Gonzalez JM, Bergmann CC, Fuss B, Hinton DR, Kangas C, Macklin WB, et al. Expression of a dominant negative IFN-gamma receptor on mouse oligodendrocytes. Glia 2005;51:22-34. 41. Omari KM, John GR, Sealfon SC, Raine CS. CXC chemokine receptors on human oligodendrocytes: implications for multiple sclerosis. Brain 2005; 128:
John M. González, Jaime Toro Recibido The neuroglia in the immune response of the nervous central system: 05/10/06. Revisado: 20/10/06.