EL EJE MICROBIOTA-INTESTINO-CEREBRO
Se denomina microbiota al conjunto de microorganismos que conviven de manera simbiótica en nuestro organismo. Este conjunto bacteriano, que se localiza principalmente en el tracto digestivo, se distribuye a lo largo de los diferentes órganos en función de las propiedades químicas. Los factores que influyen en su composición son múltiples (dieta, hábitos individuales, fármacos). La microbiota colabora en varias funciones, como pueden ser el metabolismo o la inmunidad.
Pero junto a estos germenes, el deposito de metales pesados productos de la polucion, tienen un papel en la microbiota fundamental.
Los germenes alteran la reabsorcion de los metales y los metales alteran el metabolismo de los germenes
Gérmenes en el cerebro procedentes del intestino 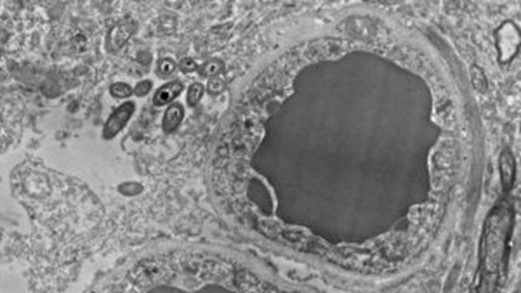
En los últimos años se ha puesto de relieve el papel bidireccional de la microbiota del tracto digestivo y del sistema nervioso central, es el denominado eje intestino-cerebro. En lo que a este eje se refiere, se cree que la comunicación se produce a través de tres vías: el nervio vago, la vía sistémica (mediante la liberación de hormonas, metabolitos y neurotransmisores) y el sistema inmune (por la acción de las citocinas).
Aunque aún quedan muchas incógnitas por esclarecer, este eje se postula como una posible base patógena para numerosos trastornos neurológicos de gran impacto sanitario, como la enfermedad de Alzheimer, la enfermedad de Parkinson o la esclerosis múltiple. En el momento actual se están llevando a cabo estudios que intentan evaluar el impacto de los probióticos sobre algunas de estas enfermedades neurológicas.
Se denomina microbiota al conjunto de millones de microorganismos que conviven en simbiosis, principalmente en nuestro tracto digestivo [1]. Su importancia recae en las funciones que desempeñan, algunas vitales, y muchas, aún desconocidas. Una de ellas es el papel que desempeña en la relación entre el intestino y el cerebro (eje intestino-cerebro). Esta conexión, bidireccional y cada vez más estudiada, se está postulando como una posible explicación a algunos de los más frecuentes trastornos neurológicos de nuestro entorno, como la enfermedad de Alzheimer, la enfermedad de Parkinson o la esclerosis múltiple. El mayor conocimiento sobre la microbiota puede ayudar, por un lado, a abrir nuevas líneas de investigación que ayuden a mejorar su patogenia y, por otra, a establecer futuras estrategias terapéuticas.
Se calcula que el número total de microorganismos que componen la microbiota es de 10 × 1014 [2], lo que supone una cantidad diez veces mayor que el número total de nuestras células. La composición de la microbiota no es estática y debe adaptarse al lugar donde reside y a las funciones que desarrolla [3]. Además, esta composición se verá afectada por la dieta, los estilos de vida o el consumo de antibióticos, entre otros factores.
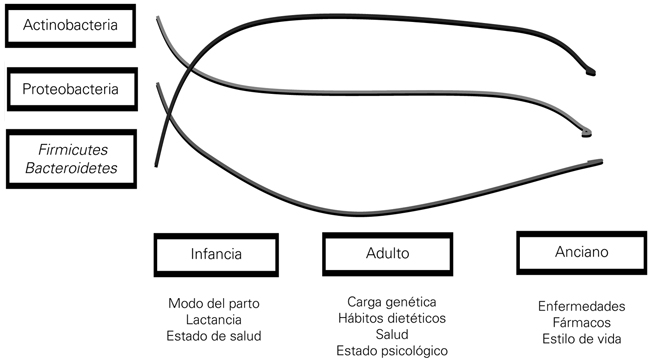
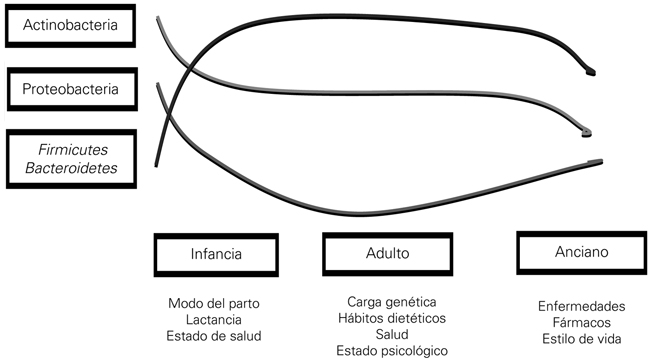
La microbiota de un individuo varía a lo largo de su vida. Así, en los primeros años, la microbiota se ve condicionada por el tipo de parto o de lactancia (artificial o materna) (Fig. 1). En este momento predominan las bacterias del filo Actinobacterias (género Bifidobacterias). Ya en la edad adulta, los estilos de vida, los hábitos dietéticos, etc., contribuyen a su sustitución por bacterias del filo Bacteroidetes y Firmicutes.
Resumen de la evolución de la microbiota a lo largo de la vida (modificado de [3]).
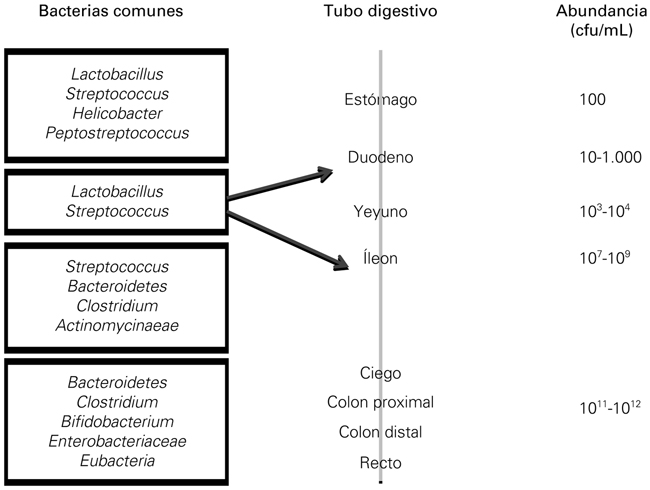
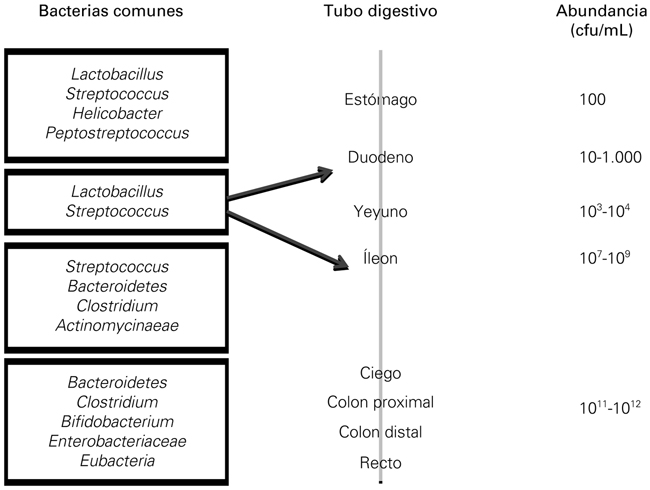
La composición de la microbiota se modifica además según el órgano donde se encuentra. A ello contribuyen las variaciones en función de las condiciones del pH gástrico, lo que hace que en esta región haya apenas unos cientos de microorganismos en comparación con la diversidad del recto (de 1011 a 1012) [4] (Fig. 2).
Figura 2. Evolución de la cantidad y de la variedad de la microbiota a lo largo del tracto digestivo (modificado de [4]).
En el momento actual son muchos los aspectos que se desconocen sobre el funcionamiento de la microbiota. Sin embargo, está establecido su papel crucial en el sistema inmunitario, metabólico y hormonal, así como en la relación eje intestino-cerebro [5]. Precisamente en este eje es donde vamos a centrarnos.
Eje intestino-cerebro
Este eje está formado por la microbiota, el sistema nervioso entérico, el sistema nervioso autónomo, el sistema neuroendocrino, el sistema neuroinmune y el sistema nervioso central [6]. El sistema nervioso entérico se encarga del funcionamiento básico gastrointestinal (motilidad, secreción mucosa, flujo sanguíneo), y el control central de las funciones del intestino se lleva a cabo gracias al nervio vago [7]. Este complejo eje conforma un sistema de comunicación neurohumoral bidireccional conocido desde hace tiempo. Son muchos los trabajos que apoyan su existencia. Así, existe una correlación entre las alteraciones de la microbiota y la encefalopatía hepática, la ansiedad, el autismo o el colon irritable [8]. En estas enfermedades existe una disbiosis (cambios en la composición normal de la microbiota) que genera cambios en la motilidad gastrointestinal, afecta a las secreciones y produce una hipersensibilidad visceral. En estas circunstancias se ven alteradas las células neuroendocrinas y las del sistema inmune, modificando la liberación de neurotransmisores, lo que se podría traducir en las diferentes manifestaciones psiquiátricas. A su vez, estudios en modelos animales expuestos a diferentes situaciones de estrés han evidenciado variaciones en la composición de la microbiota [9]. De esta manera se puede postular la comunicación bidireccional en este eje; la microbiota afecta al comportamiento humano y, a su vez, alteraciones en él producen cambios en la microbiota [10].
Vías del eje intestino-cerebro
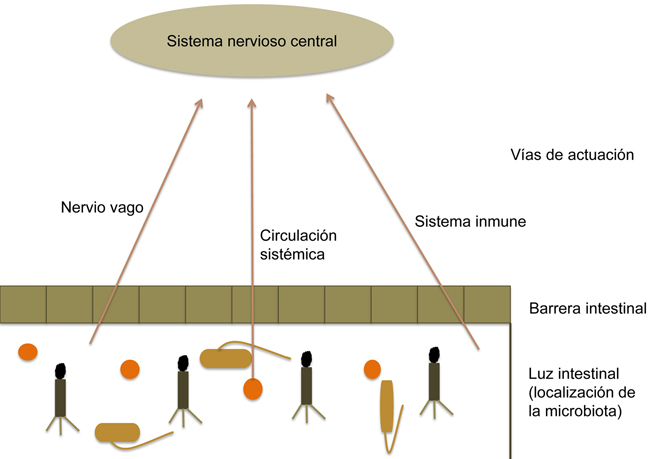
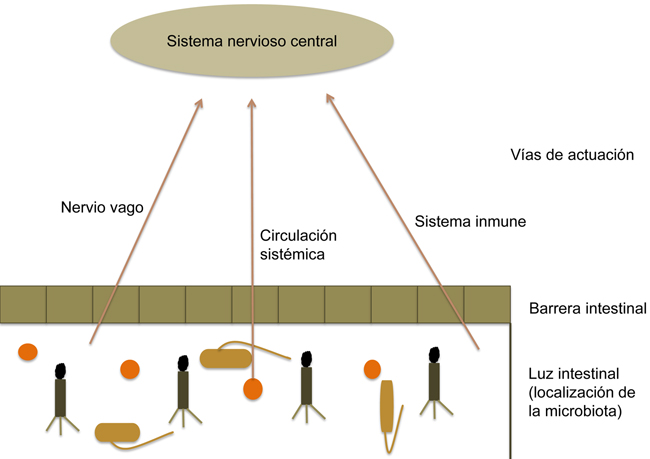
La relación entre ambas partes del eje parece que se ejerce a través de diversas vías de comunicación (Fig. 3), como el nervio vago, el sistema circulatorio y el sistema inmune.
Figura 3. Las señales que llegan al sistema nervioso central procedentes de la microbiota pueden ser: a través de la estimulación directa del vago desde el sistema nervioso entérico; gracias a la producción de metabolitos, como pueden ser neurotransmisores, hormonas o metabolitos como los ácidos grasos de cadena corta; o a través del sistema inmune, que se activa por la microbiota y libera citocinas que pueden actuar sobre el sistema nervioso central.
Nervio vago
El nervio vago constituye una de las principales vías para transmitir la información desde la microbiota al sistema nervioso central. En este sentido, la administración a ratones de Lactobacillus rhamnosus favorecía la transcripción de ácido γ-aminobutírico (GABA), lo que se tradujo en una modificación de su comportamiento dependiendo de la integridad vagal [11], ya que, al realizar ese mismo estudio en ratones vagotomizados, no se lograron estos resultados, identificando así el nervio vago como la principal vía de comunicación constitutiva moduladora entre la microbiota y el cerebro [12].
Sistema circulatorio [13]
Neurohormonas
Las neurohormonas (serotonina, catecolaminas, dopamina…) se liberan desde las células neuroendocrinas del intestino y actúan, directa e indirectamente, en la modulación del comportamiento. La serotonina (5-HT), producida en un 90% en el intestino, se ve regulada por la microbiota [14]. Si bien la relación con la microbiota puede parecer dudosa, ya que la 5-HT generada por las células intestinales no atraviesa la barrera hematoencefálica (BHE), esta interconexión también existe, aunque de manera indirecta. Esto se debe a que la microbiota actúa sobre los niveles de los precursores serotoninérgicos y del transportador de 5-HT, que participan en la activación y la modulación de la serotonina central [15]. Del mismo modo, el triptófano [16], que es un precursor de la síntesis de 5-HT central, también interviene en esta interconexión indirecta. En este caso su producción se ve regulada por enzimas metabolizadas por la microbiota intestinal, y es capaz de atravesar la BHE para formar parte de la síntesis de serotonina central [17].
La dopamina también se ve favorecida por la acción de la microbiota [13]. En un modelo de ratón carente de microbiota, los denominados germ free, se ha detectado menor cantidad de dopamina, lo que ha abierto interesantes líneas de investigación en la búsqueda de la patogenia de la enfermedad de Parkinson [18].
La microbiota interviene en la liberación de GABA. Esta liberación se produce gracias a las propiedades de algunas bacterias que contienen la enzima glutamato descarboxilasa y que degradan el glutamato presente en ciertos alimentos facilitando su transformación en GABA. Este neurotransmisor es fundamental en la modulación del comportamiento. Tanto es así que ya hay estudios que demuestran que la administración de probióticos y, por tanto, un aumento de la disponibilidad de GABA, mejora el control de la ansiedad [7,19].
La mayoría de autores están de acuerdo en que de manera directa ni el GABA ni la serotonina atraviesan la BHE, sino que su acción es indirecta, gracias a la acción sobre el sistema nervioso entérico [20]. En contra de esta única acción indirecta, otros autores demostraron la existencia de un transportador de GABA en la BHE [21]. Estos resultados explicarían cómo el GABA puede penetrar en el sistema nervioso central y la modulación de la microbiota sobre la función del GABA en el cerebro [22].
Ácidos grasos de cadena corta
La microbiota también participa en la hidrólisis de los distintos polisacáridos en ácidos grasos de cadena corta, como el propionato, el butirato y el acetato [23]. Estos ácidos grasos de cadena corta producidos en el intestino sí atraviesan la BHE y llegan al hipotálamo, donde regulan los niveles de GABA, glutamato o glutamina, además de aumentar la expresión de péptidos anorexígenos [24]; a su vez, contribuyen a mantener la integridad de la BHE, lo que supone otro nexo entre la microbiota y el sistema nervioso central [25,26].
Eje hipotálamo-pituitario-adrenal [26]
Las acciones de la microbiota también afectan al eje hipotálamo-pituitario-adrenal, regulando la liberación de cortisol. En los ratones libres de gérmenes se han observado respuestas exageradas de citocinas inflamatorias ante situaciones de estrés. En esta línea, existen estudios que demuestran que niveles altos de Lactobacillus rhamnosus se correlacionan con menores niveles de corticosterona, mejor control del estrés, menor depresión y menor liberación de citocinas inflamatorias [11]. Y, viceversa, otros estudios demuestran que pequeñas exposiciones a estrés pueden impactar en el perfil de la microbiota, la respuesta al estrés y la activación del eje hipotálamo-pituitario-adrenal [27].
Sistema inmune
Los patrones moleculares asociados a diferentes patógenos son la forma de presentación de la microbiota frente al sistema inmune. Uno de ellos son los lipopolisacáridos. Estos lipopolisacáridos activan las células del sistema inmune, particularmente las del sistema innato (macrófagos, neutrófilos y células dendríticas). Una vez activadas, producen citocinas inflamatorias (interleucina-1a, interleucina-1b, factor de necrosis tumoral alfa e interleucina-6) que atraviesan la BHE. En el cerebro, estas citocinas actúan sobre los receptores expresados en las neuronas y las células gliales, concretamente en la microglía, alterando su estado de activación y función. A su vez, las citocinas son capaces de actuar sobre los receptores de diferentes nervios aferentes promoviendo alteraciones de las señales desde el tubo digestivo hasta el sistema nervioso central [28]. Del mismo modo, la microbiota también es capaz de facilitar la liberación de citocinas no inflamatorias, como pueden ser las producidas por el factor estimulante de colonias de granulocitos, que son capaces de atravesar la BHE y de estimular la neurogenia en el cerebro [29], lo que se ha visto como un factor protector tras una lesión isquémica.
Microbiota: posible patogenia y solución de enfermedades neurodegenerativas
Conforme se ahonda en el entendimiento del eje intestino-cerebro empiezan a establecerse ciertos postulados que hacen creer que existe una relación entre la microbiota y las enfermedades neurodegenerativas [30]. Estudios en ratones germ free demuestran que la microbiota es fundamental para un desarrollo cognitivo normal [31,32]. En esta línea, un estudio español realizado con ratones in vivo [33] relaciona la ingesta de un oligosacárido de la leche materna (2-fucosil-lactosa) con una mejora cognitiva. Los autores demuestran que la ingestión de este oligosacárido, a través de la leche materna, tiene una acción sobre el hipocampo que mejora los patrones de memoria, las habilidades de aprendizaje y los diferentes marcadores de plasticidad sináptica cerebral. Esto estaría en relación con la acción del oligosacárido sobre el eje microbiota-intestino-cerebro y su medicación por el nervio vago. Asimismo, la microbiota también participa en la generación de GABA, del factor neurotrófico derivado del cerebro, de la serotonina y de otras moléculas necesarias para el correcto funcionamiento del sistema nervioso central [34]. Cuando se produce una disbiosis, pueden verse alteradas las concentraciones de estas moléculas, lo que podría justificar en parte la aparición de diferentes enfermedades, como pueden ser trastornos del comportamiento, ansiedad [35], enfermedad de Alzheimer [36] o autismo [37]. Además, la microbiota interviene en la síntesis de péptidos que servirán como moléculas de adhesión para las células del huésped [38]. A veces estas moléculas serán las que generen autorreactividad y creen una reacción que dañe las propias estructuras nerviosas [25].
Estas razones llevan a pensar que la microbiota puede llegar a postularse como una de las causas responsables de diferentes enfermedades neurológicas, como la esclerosis múltiple [39], el trastorno por déficit de atención/hiperactividad [40], la enfermedad de Parkinson [41,42] o incluso la enfermedad de Alzheimer, y a que los probióticos se conviertan en una herramienta terapéutica, pero aún queda mucho por aclarar; por ejemplo, el hecho de que la mayoría de los estudios citados estén realizados en animales, con una composición de la microbiota diferente a la humana. Por ello, una de las principales dudas que surge es si estos resultados serán similares en los humanos. Para esclarecer esta hipótesis se han revisado varios estudios realizados con pacientes que presentaban patología neurológica en los cuales la administración de probióticos ha producido mejoras objetivas. Así, recientemente se ha publicado un estudio de pacientes con enfermedad de Alzheimer que, tras haber sido tratados con probióticos durante tres meses, presentaron una mejora cognitiva [43]. Nosotros hemos tenido la oportunidad de llevar a cabo un estudio piloto en el que, tras la administración de probióticos a pacientes con epilepsia farmacorresistente, se observó una efectividad (reducción del 50% o más de sus crisis) del 28,9% [44]. Estos resultados apoyan la idea de que los probióticos podrían ser en un futuro otro tratamiento para enfermedades neurológicas [45]. En la tabla se definen los conceptos de probióticos [46], prebióticos [47] o simbióticos [48], y se resumen los ensayos clínicos registrados con su uso en patología neurológica en la actualidad. Sin embargo, también hay publicado otro estudio en el que la administración de probióticos en voluntarios sanos no produce cambios en el rendimiento cognitivo [49].
| Tabla. Registro de ensayos clínicos en los que se utilicen prebióticos, probióticos o simbióticos en enfermedades neurológicas. | |||||
| Producto utilizado | Tiempo de administración | Enfermedad | Estado del estudio |
Objetivo principal | |
| NCT02342262 | B. bifidum W23, B. lactis W52, L. acidophilus W37, L. brevis W63, L. casei W56, L. salivarius W24, L. lactis W19, L. lactis W58 | 12 semanas | Migraña | Desconocido | Efecto en la frecuencia e intensidad de los ataques de migraña y la permeabilidad intestinal |
| NCT03259971 | Lactobacillus plantarum PS128 | 4 meses | Síndrome de Rett | Reclutamiento | Efecto en la mejora de los movimientos, comportamiento y situación cognitiva |
| NCT03324399 | Probiótico (no especificado) | 24 semanas | Esclerosis lateral amiotrófica | En marcha |
Mejora de la fuerza, espasticidad y calidad de vida |
| NCT01110447 | Lactobacillus (L. paracasei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacteria (B. longum, B. infantis, B. breve), una cepa de Streptococcus thermophilus | 24 semanas | Profilaxis secundaria de encefalopatía hepática | Finalizado | Valoración de recurrencia y necesidad de hospitalización por encefalopatía hepática |
| NCT02459717 | 125 mg de leche fermentada con múltiples probióticos (no especificados) y fibra prebiótica | 4 semanas | Estreñimiento en Parkinson |
Finalizado |
Cambio en el número de deposiciones espontáneas completas |
| NCT01008293 | Lactobacillus (L. casei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacterium (B. longum, B. breve, B. infantis) y una cepa de Streptococcus salivarius subsp. thermophilus | 2 meses | Encefalopatía hepática leve |
Finalizado | Comparar el efecto de la lactulosa frente a los probióticos en el tratamiento de la encefalopatía hepática y valorar la mejora en la calidad de vida |
| NCT00992290 | Lactobacillus GG | 8 semanas | Encefalopatía hepática |
Finalizado |
Valorar la seguridad del probiótico en estos pacientes |
| NCT01798329 | Lactobacillus (L. casei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacterium (B. longum, B. breve, B. infantis) y una cepa de Streptococcus salivarius subsp. thermophilus | 15 semanas | Encefalopatía hepática |
Desconocido | Mejora neurocognitiva y neuropsicológica |
| NCT02723344 | Lactobacillus reuteri | 8 semanas | TCE leve y síndrome de estrés postraumático | Reclutando |
Disminución de la inflamación encontrada en los TCE |
| NCT01413243 | Trichuris suis ova | 12 meses | Esclerosis múltiple y SCA |
Finalizado | Número de lesiones hiperintensas en T2 tras un año de tratamiento |
| NCT03117322 | Agave inulina, Lactobacillus reuteri DSM 17938 | 4 semanas | Estreñimiento en niños con parálisis cerebral |
Reclutando | Cambio en las heces, en la composición de la microbiota, en el pH fecal y cambio en la frecuencia de las deposiciones |
| NCT03403907 |
Streptococcus thermophilus, Lactobacillus acidophilus, L. plantarum, L. paracasei, L. delbrueckii subsp. bulgaricus, Bifidobacterium breve, B. longus, B. infantis y CD2 |
4 meses | Epilepsia farmacorresistente | Completado | Reducir el número de crisis, mejorar la calidad de vida de los pacientes, valorar la evolución antiinflamatoria de las citocinas, seguridad de los probióticos |
| Prebiótico: sustrato utilizado selectivamente por los microorganismos del huésped y que confiere un beneficio para la salud. Probiótico: microorganismos vivos que, cuando se ingieren en las cantidades adecuadas, pueden aportar beneficios para la salud de quien los consume. Simbiótico: compuesto que combina prebiótico y probiótico en el que el prebiótico favorece selectivamente al probiótico. SCA: síndrome clínico aislado; TCE: traumatismo craneoencefálico. | |||||
Las investigaciones son alentadoras, pero todavía queda mucho por aclarar: ¿cuál es el mecanismo por el cual los probióticos realmente funcionan?, ¿se debe sólo a una cepa o a la simbiosis de ellas?, ¿qué dosis usamos?, ¿durante cuánto tiempo? Hay muchas preguntas sin respuesta, pero lo que está claro es que se abre un campo de investigación con muchas posibilidades.
Metal pesado

Cristales de osmio, un metal
pesado casi el doble de denso
que el plomo.1
Un metal pesado es un miembro de un grupo de elementos químicos no muy bien definido que exhibe propiedades metálicas. Se incluyen principalmente metales de transición, algunos semimetales, lantánidos y actínidos.
Muchas definiciones diferentes han propuesto basarse en la densidad, otras en el número atómico o peso atómico, y algunas en sus propiedades químicas o de toxicidad.2 De esta forma, la definición de metal pesado referida al peso atómico, un metal pesado es un elemento químico comprendido entre 63.55 (Cu) y 200.59 (Hg); otra manera se refiere a los metales de densidad entre 4 g/cm³ hasta 7 g/cm³ y también hay otra clasificación referida al número atómico.
El término metal pesado es considerado como una «mala denominación» en un informe técnico de la IUPAC debido a su definición contradictoria y su falta de «bases de coherencia científica».2 Existe un término alternativo metal tóxico, para el cual tampoco existe consenso de su exacta definición.
Como se discute luego, dependiendo del contexto, los metales pesados pueden incluir elementos livianos como el carbono y pueden excluir algunos de los metales más pesados. Los metales pesados se encuentran libres y de forma natural en algunos ecosistemas y pueden variar en su concentración.
Sin embargo hay una serie de elementos que en alguna de sus formas pueden representar un serio problema medioambiental y es común referirse a ellos con el término genérico de «metales pesados». En la actualidad, existen fuentes antropogénicas de metales pesados, por ejemplo la contaminación, que los ha introducido en los ecosistemas. Por ejemplo los combustibles derivados de la basura (no orgánica) generalmente aportan estos metales, así que se debe considerar los metales pesados cuando se utilizan los residuos como combustible.
Los metales pesados tóxicos más conocidos son el mercurio, el plomo, el cadmio y el arsénico, y en raras ocasiones, algún no metal como el selenio. A veces también se habla de contaminación por metales pesados incluyendo otros elementos tóxicos más ligeros, como el berilio o el aluminio.
Relación con los organismos vivos y alimentos
Los organismos vivos requieren diferentes cantidades de metales pesados. Los humanos requieren pequeñas cantidades de hierro, cobalto, cobre, manganeso, molibdeno, y zinc. Cantidades excesivas de ellos pueden dañar nuestro organismo. Otros metales pesados como mercurio, plutonio, y plomo son metales tóxicos que no tienen un efecto vital o beneficioso para el organismo, y su acumulación en el tiempo y en el cuerpo de los animales puede causar serias enfermedades, como por ejemplo saturnismo o envenenamiento por mercurio.
Algunos elementos que son normalmente tóxicos, para algunos organismos, bajo algunas condiciones pueden ser beneficiosos. Por ejemplo, el vanadio, el wolframio, incluso el cadmio.3
Metales pesados en el medio ambiente y en la salud
Otros causan corrosión, como zinc o plomo, o son malos por otros medios (por ejemplo el arsénico puede contaminar los catalizadores).
En la Unión Europea los once elementos más importantes son arsénico, cadmio, cobalto, cromo, cobre, mercurio, manganeso, níquel, plomo, estaño y talio, de los cuales sus emisiones en incineradores están reguladas. Algunos de ellos son necesarios para los humanos en pequeñas proporciones tales como cobalto, cobre, cromo, manganeso y níquel, mientras otros son carcinogénicos o tóxicos, afectando, entre otros, al sistema nervioso central (manganeso, mercurio, plomo, arsénico), los riñones o el hígado (mercurio, plomo, cadmio, cobre) o la piel, los huesos, o dientes (níquel, cadmio, cobre, cromo).5
La contaminación con metales pesados puede surgir de muchas fuentes, pero más comúnmente de la purificación de metales, por ejemplo, el smelting (proceso de extracción del metal de la piedra) extrae el metal de la piedra y del cobre para la preparación de combustible nuclear. La electro-deposición es la primera fuente de cromo y cadmio. Mediante la precipitación de estos compuestos o el intercambio de iones hacia los suelos y barros, los metales pesados se pueden localizar y quedar depositados. A diferencia de los contaminantes orgánicos, los metales pesados no decaen y presentan otros desafíos para remediarlos. Actualmente, se utilizan plantas (fitorremediación) y microorganismos para remover metales pesados, como el mercurio. Ciertas plantas que exhiben hiperacumulación pueden usarse para remover de los suelos estos metales por la concentración en biomateria.6 En algunos diques de cola se utiliza vegetación que luego es incinerada para recobrar los metales pesados.
Uno de los mayores problemas asociados a la aparición de metales pesados es el potencial de bioacumulación y biomagnificación causando mayor exposición de estos metales a un organismo de la que podría encontrarse sola en el medio ambiente. Peces de alta mar (como el Tetractenos glaber) y aves marinas (como la Fratercula arctica) son controlados por la presencia de estos contaminantes. Los principales lugares en los que se encuentra bioacumulación son los estuarios o lugares con agua salobre, debido a que los contaminantes son arrastrados a lo largo del trayecto de los ríos y depositada en los lechos lacustres, siendo reportados niveles elevados de metales pesados en el fondo, en algas, ostras y peces de consumo humano, tal como sucede en muchas lagunas de agua salobre en México, Nigeria, Egipto, en donde se han realizado estudios del suelo, plantas, agua y tejidos animales, encontrando niveles elevados para metales pesados por encima de lo permitido por sus sistemas de salud y control ambiental en cada una de las naciones.789101112
Medicina
En el uso médico, los metales pesados están pobremente definidos2 e incluyen a todos los metales tóxicos indistintamente de su peso atómico: los «envenenamientos por metales pesados» pueden incluir excesiva cantidad de hierro, manganeso, aluminio, mercurio, cadmio, o berilio (el cuarto elemento más liviano) o algunos como el semimetal arsénico. Esta definición puede incluir al bismuto como metal pesado, el más denso de los elementos estables, pese a su baja toxicidad.
La enfermedad de Minamata se da como resultado del envenenamiento por mercurio, la enfermedad itai-itai por envenenamiento con cadmio, y el saturnismo como envenenamiento con plomo.
Mercancías peligrosas
Los metales pesados en mercancías peligrosas son clasificados en su mayoría como «Clase 9: Materias y objetos que presentan peligros diversos» en el modelo de la ONU de clases de peligro, pero algunas veces mientras son transportados se los etiqueta como «Clase 6.1: Materias tóxicas».
Tecnología nuclear
El Burnup (combustible utilizable) del combustible nuclear, es expresado en gigavatio día por tonelada métrica de metales pesados, donde metales pesados significa actínidos como el torio, uranio, plutonio, etc., incluyendo material fisible y material fértil . Y no incluye elementos como el oxígeno agregado al material combustible, o material de revestimiento como el circonio, que puede ser considerado un metal pesado por otros estándares.
Conclusiones
Polucion, metales y gérmenes, forman un conglomerado que mutila los organisms y son responsables de la mayoría sino todas las enfermedade degenerativas.
Referencias
↑ Emsley, 2011, pp. 288; 374
↑ Saltar a:a b c John H. Duffus «»Heavy metals» a meaningless term? (IUPAC Technical Report)» Pure and Applied Chemistry, 2002, Vol. 74, pp. 793–807. doi 10.1351/pac200274050793
↑ Lane TW, Morel FM. A biological function for cadmium in marine diatoms.
↑ C.Michael Hogan. 2010. Heavy metal. Encyclopedia of Earth. National Council for Science and the Environment. eds. E. Monosson & C. Cleveland. Washington, D.C.
↑ Ron Zevenhoven, Pia Kilpinen: Control of Pollutants in Flue Gases and Fuel Gases. TKK, Espoo 2001.
↑ Pablo Higueras & Roberto Oyarzun. «10.- Restauración y remediación III: Suelos y Aguas subterráneas». Curso de Minería y Medio Ambiente. Archivado desde el original el 21 de febrero de 2012. Consultado el 6 de marzo de 2012.
↑ Rosas, BAez, Belmont: Oyster (Crassostrea virginica) as indicator of heavy metal pollution in some lagoons of the Gulf of Mexico. Water, Air, and Soil Pollution Volume 20, Issue 2 , pp 127-135
↑ Vazquez, Sharma, Alexander: Metals in some Lagoons of Mexico. Environmental Health Perspectives 103(Suppl 1):33-34 (1995)
↑ Rashed: CADMIUMAND LEAD LEVELS IN FISH (TILAPIA NILOTICA) TISSUES AS BIOLOGICAL INDICATOR FOR LAKEWATER POLLUTION. Environmental Monitoring and Assessment 68: 75–89, 2001.
↑ Ünlü, Topçuoğlu: Heavy metal pollution in surface sediment and mussel samples in the Gulf of Gemlik. Environ Monit Assess (2008) 144:169–178
↑ Guzmán-García, Botello: Effects of heavy metals on the oyster (Crassostrea virginica) at Mandinga Lagoon, Veracruz, Mexico. Rev. Biol. Trop. (Int. J. Trop. Biol. ISSN 0034-7744) Vol. 57 (4): 955-962 (diciembre de 2009)
↑ Vazquez, Aguirre: Cadmium, Lead and Zinc Concentrations in Water, Sediment and Oyster (Crassostrea virginica) of San Andres Lagoon, Mexico. Bull Environ Contam Toxicol (2011) 86:410–414
↵ 1. Lynch SV, Pedersen O. The human intestinal microbiome in health and disease. N Engl J Med 2016; 375: 2369-79.
↵ 2. Blanco JR, Oteo JA. Gut microbiota: so much to explore! Expert Rev Anti Infect Ther 2013; 11: 759-61.
↵ 3. Tojo R, Suárez A, Clemente MG, De los Reyes-Gavilán CG, Margolles A, Gueimonde M, et al. Intestinal microbiota in health and disease: role of bifidobacteria in gut homeostasis. World J Gasrtroenterol 2014; 20: 15163-76.
↵ 4. Korecka A, Arulampalam V. The gut microbiome: scourge, sentinel or spectator? J Oral Microbiol 2012; 4. doi: 10.3402/jom.v4i0.9367.
↵ 5. Collins SM, Bercik P. The relationship between intestinal microbiota and the central nervous system in normal gastro-intestinal function and disease. Gastroenterology 2009; 136: 2003-14.
↵ 6. Felice VD, Quigley EM, Sullivan AM, O’Keeffe GW, O’Mahony SM. Microbiota-gut-brain signalling in Parkinson’s disease: implications for non-motor symptoms. Parkinsonism Relat Disord 2016; 27: 1-8.
↵ 7. Foster JA, Rinaman L, Cryan JF. Stress and the gut-brain axis: regulation by the microbiome. Neurobiol Stress 2017; 7: 124-36.
↵ 8. Wang Y, Kasper LH. The role of microbiome in central nervous system disorders. Brain Behav Immun 2014; 38: 1-12.
↵ 9. Yoshikawa K, Kurihara C, Furuhashi H, Takajo T, Maruta K, Yasutake Y, et al. Psychological stress exacerbates NSAID-induced small bowel injury by inducing changes in intestinal microbiota and permeability via glucocorticoid receptor signaling. J Gastroenterol 2017; 52: 61-71.
↵ 10. Bienenstock J, Kunze W, Forsythe P. The microbiome-gut-brain axis and the consequences of infection and dysbiosis. Am J Gastroenterol Suppl 2016; 3: 33-40.
↵ 11. Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 2011; 108: 16050-5.
↵ 12. Carabotti M, Scirocco A, Maselli MA, Severi C. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Ann Gastroenterol 2015; 28: 203-9.
↵ 13. Neuman H, Debelius JW, Knight R, Koren O. Microbial endocrinology: the interplay between the microbiota and the endocrine system. FEMS Microbiol Rev 2015; 39: 509-21.
↵ 14. Hata T, Asano Y, Yoshihara K, Kimura-Todani T, Miyata N, Zhang XT, et al. Regulation of gut luminal serotonin by commensal microbiota in mice. PLoS One 2017; 12: e0180745.
↵ 15. Sharon G, Garg N, Debelius J, Knight R, Dorrestein PC, Mazmanian SK. Specialized metabolites from the microbiome in health and disease. Cell Metab 2014; 20: 719-30.
↵ 16. Cerdó T, Ruiz A, Suárez A, Campoy C. Probiotic, prebiotic, and brain development. Nutrients 2017; 9. pii: E1247.
↵ 17. Jenkins TA, Nguyen JC, Polglaze KE, Bertrand PP. Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients 2016; 8. pii: E56.
↵ 18. Malkki H. Parkinson disease: could gut microbiota influence severity of Parkinson disease? Nat Rev Neurol 2017; 13: 66-7.
↵ 19. Dinan TG, Stanton C, Cryan JF. Psychobiotics: a novel class of psychotropic. Biol Psychiatry 2013; 74: 720-6.
↵ 20. Dinan TG, Cryan JF. The microbiome-gut-brain axis in health and disease. Gastroenterol Clin North Am 2017; 46: 77-89.
↵ 21. Takanaga H, Ohtsuki S, Hosoya KI, Terasaki T. GAT2/BGT-1 as a system responsible for the transport of gamma-aminobutyric acid at the mouse blood-brain barrier. J Cereb Blood Flow Metab 2001; 21: 1232-9.
↵ 22. Sherwin E, Sandhu KV, Dinan TG, Cryan JF. May the force be with you: the light and dark sides of the microbiota-gut-brain axis in neuropsychiatry. CNS Drugs 2016; 30: 1019-41.
↵ 23. Raoult D. Obesity pandemics and the modification of digestive bacterial flora. Eur J Clin Microbiol Infect Dis 2008; 27: 631-4.
↵ 24. Frost G, Sleeth ML, Sahuri-Arisoylu M, Lizarbe B, Cerdan S, Brody L, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun 2014; 5: 3611.
↵ 25. Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med 2014; 6: 263ra158.
↵ 26. Michel L, Prat A. One more role for the gut: microbiota and blood brain barrier. Ann Transl Med 2016; 4: 15.
↵ 27. Galley JD, Nelson MC, Yu Z, Dowd SE, Walter J, Kumar PS, et al. Exposure to a social stressor disrupts the community structure of the colonic mucosa-associated microbiota. BMC Microbiol 2014; 14: 189.
↵ 28. Sampson TR, Mazmanian SK. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 2015; 17: 565-76.
↵ 29. Zhang D, Chen G, Manwani D, Mortha A, Xu C, Faith JJ, et al. Neutrophil ageing is regulated by the microbiome. Nature 2015; 525: 528-32.
↵ 30. Hill JM, Bhattacharjee S, Pogue AI, Lukiw WJ. The gastro-intestinal tract microbiome and potential link to Alzheimer’s disease. Front Neurol 2014; 5: 43.
↵ 31. Luczynski P, McVey Neufeld KA, Oriach CS, Clarke G, Dinan TG, Cryan JF. Growing up in a bubble: using germ-free animals to assess the influence of the gut microbiota on brain and behavior. Int J Neuropsychopharmacol 2016; 19. pii: pyw020.
↵ 32. Díaz-Heijtz R, Wang S, Anuar F, Qian Y, Björkholm B, Samuelsson A, et al. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A 2011; 108: 3047-52.
↵ 33. Vázquez E, Barranco A, Ramírez M, Gruart A, Delgado-García JM, Jiménez ML, et al. Dietary 2’-fucosyllactose enhances operant conditioning and long-term potentiation via gut-brain communication through the vagus nerve in rodents. PLoS One 2016; 11: e0166070.
↵ 34. Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
↵ 35. Morris G, Berk M, Carvalho A, Caso JR, Sanz Y, Walder K, et al. The role of the microbial metabolites including tryptophan catabolites and short chain fatty acids in the pathophysiology of immune-inflammatory and neuroimmune disease. Mol Neurobiol 2017; 54: 4432-51.
↵ 36. Bhattacharjee S, Lukiw WJ. Alzheimer’s disease and the microbiome. Front Cell Neurosci 2013; 7: 153.
↵ 37. De Angelis M, Francavilla R, Piccolo M, De Giacomo A, Gobbetti M. Autism spectrum disorders and intestinal microbiota. Gut Microbes 2015; 6: 207-13.
↵ 38. Grenham S, Clarke G, Cryan JF, Dinan TG. Brain-gut-microbe communication in health and disease. Front Physiol 2011; 2: 94.
↵ 39. Mielcarz DW, Kasper LH. The gut microbiome in multiple sclerosis. Curr Treat Options Neurol 2015; 17: 344.
↵ 40. Richarte V, Rosales K, Corrales M, Bellina M, Fadeuilhe C, Calvo E, et al. El eje intestino-cerebro en el trastorno por déficit de atención/hiperactividad: papel de la microbiota. Rev Neurol 2018; 66 (Supl 1): S109-14.
↵ 41. Cassani E, Barichella M, Cancello R, Cavanna F, Iorio L, Cereda E, et al. Increased urinary indoxyl sulfate (indican): new insights into gut dysbiosis in Parkinson’s disease. Parkinsonism Relat Disord 2015; 21: 389-93.
↵ 42. Dinan TG, Cryan JF. Gut feelings on Parkinson’s and depression. Cerebrum 2017; 2017. pii: cer-04-17.
↵ 43. Akbari E, Asemi Z, Daneshvar Kakhaki R, Bahmani F, Kouchaki E, Tamtaji OR, et al. Effect of probiotic supplementation on cognitive function and metabolic status in Alzheimer’s disease: a randomized, double-blind and controlled trial. Front Aging Neurosci 2016; 8: 256.
↵ 44. Gómez-Eguílaz M, Ramón-Trapero JL, Pérez-Martínez L, Blanco JR. The beneficial effect of probiotics as a supplementary treatment in drug-resistant epilepsy: a pilot study. Benef Microbes 2018; Sep 10. [Epub ahead of print].
↵ 45. Umbrello G, Esposito S. Microbiota and neurologic diseases: potential effects of probiotics. J Transl Med 2016; 14: 298.
↵ 46. World Health Organization & Food and Agriculture Organization of the United Nations. Probiotics in food. Health and nutritional properties and guidelines for evaluation. Rome: WHO/FAO; 2006. URL: http: //www.fao.org/3/a-a0512e.pdf. [30.01.2015].
↵ 47. Gibson GR, Hutkins RW, Sanders ME, Prescott SL, Reimer RA, Salminen SJ, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol 2017; 14: 491-502.
↵ 48. Firmansyah A, Dwipoerwantoro PG, Kadim M, Alatas S, Conus N, Lestarina L, et al. Improved growth of toddlers fed a milk containing synbiotics. Asia Pac J Clin Nutr 2011; 20: 69-76.
↵ 49. Kelly JR, Allen AP, Temko A, Hutch W, Kennedy PJ, Farid N, et al. Lost in translation? The potential psychobiotic Lacto-bacillus rhamnosus (JB-1) fails to modulate stress or cognitive performance in healthy male subjects. Brain Behav Immun 2017; 61: 50-9.
M. Gómez-Eguílaz, J.L. Ramón-Trapero, L. Pérez-Martínez, J.R. Blanco[REV NEUROL 2019;68:111-117]PMID: 30687918DOI: https://doi.org/10.33588/rn.6803.2018223 ![]() OPEN ACCESS
OPEN ACCESS
Volumen 68 | Número 03 | Nº de lecturas del artículo 201.171 | Nº de descargas del PDF 3.036 | Fecha de publicación del artículo 01/02/2019
2019 Revista de Neurología
EL EJE MICROBIOTA-INTESTINO-CEREBRO
Se denomina microbiota al conjunto de microorganismos que conviven de manera simbiótica en nuestro organismo. Este conjunto bacteriano, que se localiza principalmente en el tracto digestivo, se distribuye a lo largo de los diferentes órganos en función de las propiedades químicas. Los factores que influyen en su composición son múltiples (dieta, hábitos individuales, fármacos). La microbiota colabora en varias funciones, como pueden ser el metabolismo o la inmunidad.
Pero junto a estos germenes, el deposito de metales pesados productos de la polucion, tienen un papel en la microbiota fundamental.
Los germenes alteran la reabsorcion de los metales y los metales alteran el metabolismo de los germenes
Gérmenes en el cerebro procedentes del intestino 
En los últimos años se ha puesto de relieve el papel bidireccional de la microbiota del tracto digestivo y del sistema nervioso central, es el denominado eje intestino-cerebro. En lo que a este eje se refiere, se cree que la comunicación se produce a través de tres vías: el nervio vago, la vía sistémica (mediante la liberación de hormonas, metabolitos y neurotransmisores) y el sistema inmune (por la acción de las citocinas).
Aunque aún quedan muchas incógnitas por esclarecer, este eje se postula como una posible base patógena para numerosos trastornos neurológicos de gran impacto sanitario, como la enfermedad de Alzheimer, la enfermedad de Parkinson o la esclerosis múltiple. En el momento actual se están llevando a cabo estudios que intentan evaluar el impacto de los probióticos sobre algunas de estas enfermedades neurológicas.
Se denomina microbiota al conjunto de millones de microorganismos que conviven en simbiosis, principalmente en nuestro tracto digestivo [1]. Su importancia recae en las funciones que desempeñan, algunas vitales, y muchas, aún desconocidas. Una de ellas es el papel que desempeña en la relación entre el intestino y el cerebro (eje intestino-cerebro). Esta conexión, bidireccional y cada vez más estudiada, se está postulando como una posible explicación a algunos de los más frecuentes trastornos neurológicos de nuestro entorno, como la enfermedad de Alzheimer, la enfermedad de Parkinson o la esclerosis múltiple. El mayor conocimiento sobre la microbiota puede ayudar, por un lado, a abrir nuevas líneas de investigación que ayuden a mejorar su patogenia y, por otra, a establecer futuras estrategias terapéuticas.
Se calcula que el número total de microorganismos que componen la microbiota es de 10 × 1014 [2], lo que supone una cantidad diez veces mayor que el número total de nuestras células. La composición de la microbiota no es estática y debe adaptarse al lugar donde reside y a las funciones que desarrolla [3]. Además, esta composición se verá afectada por la dieta, los estilos de vida o el consumo de antibióticos, entre otros factores.
La microbiota de un individuo varía a lo largo de su vida. Así, en los primeros años, la microbiota se ve condicionada por el tipo de parto o de lactancia (artificial o materna) (Fig. 1). En este momento predominan las bacterias del filo Actinobacterias (género Bifidobacterias). Ya en la edad adulta, los estilos de vida, los hábitos dietéticos, etc., contribuyen a su sustitución por bacterias del filo Bacteroidetes y Firmicutes.
Resumen de la evolución de la microbiota a lo largo de la vida (modificado de [3]).
La composición de la microbiota se modifica además según el órgano donde se encuentra. A ello contribuyen las variaciones en función de las condiciones del pH gástrico, lo que hace que en esta región haya apenas unos cientos de microorganismos en comparación con la diversidad del recto (de 1011 a 1012) [4] (Fig. 2).
Figura 2. Evolución de la cantidad y de la variedad de la microbiota a lo largo del tracto digestivo (modificado de [4]).
En el momento actual son muchos los aspectos que se desconocen sobre el funcionamiento de la microbiota. Sin embargo, está establecido su papel crucial en el sistema inmunitario, metabólico y hormonal, así como en la relación eje intestino-cerebro [5]. Precisamente en este eje es donde vamos a centrarnos.
Eje intestino-cerebro
Este eje está formado por la microbiota, el sistema nervioso entérico, el sistema nervioso autónomo, el sistema neuroendocrino, el sistema neuroinmune y el sistema nervioso central [6]. El sistema nervioso entérico se encarga del funcionamiento básico gastrointestinal (motilidad, secreción mucosa, flujo sanguíneo), y el control central de las funciones del intestino se lleva a cabo gracias al nervio vago [7]. Este complejo eje conforma un sistema de comunicación neurohumoral bidireccional conocido desde hace tiempo. Son muchos los trabajos que apoyan su existencia. Así, existe una correlación entre las alteraciones de la microbiota y la encefalopatía hepática, la ansiedad, el autismo o el colon irritable [8]. En estas enfermedades existe una disbiosis (cambios en la composición normal de la microbiota) que genera cambios en la motilidad gastrointestinal, afecta a las secreciones y produce una hipersensibilidad visceral. En estas circunstancias se ven alteradas las células neuroendocrinas y las del sistema inmune, modificando la liberación de neurotransmisores, lo que se podría traducir en las diferentes manifestaciones psiquiátricas. A su vez, estudios en modelos animales expuestos a diferentes situaciones de estrés han evidenciado variaciones en la composición de la microbiota [9]. De esta manera se puede postular la comunicación bidireccional en este eje; la microbiota afecta al comportamiento humano y, a su vez, alteraciones en él producen cambios en la microbiota [10].
Vías del eje intestino-cerebro
La relación entre ambas partes del eje parece que se ejerce a través de diversas vías de comunicación (Fig. 3), como el nervio vago, el sistema circulatorio y el sistema inmune.
Figura 3. Las señales que llegan al sistema nervioso central procedentes de la microbiota pueden ser: a través de la estimulación directa del vago desde el sistema nervioso entérico; gracias a la producción de metabolitos, como pueden ser neurotransmisores, hormonas o metabolitos como los ácidos grasos de cadena corta; o a través del sistema inmune, que se activa por la microbiota y libera citocinas que pueden actuar sobre el sistema nervioso central.
Nervio vago
El nervio vago constituye una de las principales vías para transmitir la información desde la microbiota al sistema nervioso central. En este sentido, la administración a ratones de Lactobacillus rhamnosus favorecía la transcripción de ácido γ-aminobutírico (GABA), lo que se tradujo en una modificación de su comportamiento dependiendo de la integridad vagal [11], ya que, al realizar ese mismo estudio en ratones vagotomizados, no se lograron estos resultados, identificando así el nervio vago como la principal vía de comunicación constitutiva moduladora entre la microbiota y el cerebro [12].
Sistema circulatorio [13]
Neurohormonas
Las neurohormonas (serotonina, catecolaminas, dopamina…) se liberan desde las células neuroendocrinas del intestino y actúan, directa e indirectamente, en la modulación del comportamiento. La serotonina (5-HT), producida en un 90% en el intestino, se ve regulada por la microbiota [14]. Si bien la relación con la microbiota puede parecer dudosa, ya que la 5-HT generada por las células intestinales no atraviesa la barrera hematoencefálica (BHE), esta interconexión también existe, aunque de manera indirecta. Esto se debe a que la microbiota actúa sobre los niveles de los precursores serotoninérgicos y del transportador de 5-HT, que participan en la activación y la modulación de la serotonina central [15]. Del mismo modo, el triptófano [16], que es un precursor de la síntesis de 5-HT central, también interviene en esta interconexión indirecta. En este caso su producción se ve regulada por enzimas metabolizadas por la microbiota intestinal, y es capaz de atravesar la BHE para formar parte de la síntesis de serotonina central [17].
La dopamina también se ve favorecida por la acción de la microbiota [13]. En un modelo de ratón carente de microbiota, los denominados germ free, se ha detectado menor cantidad de dopamina, lo que ha abierto interesantes líneas de investigación en la búsqueda de la patogenia de la enfermedad de Parkinson [18].
La microbiota interviene en la liberación de GABA. Esta liberación se produce gracias a las propiedades de algunas bacterias que contienen la enzima glutamato descarboxilasa y que degradan el glutamato presente en ciertos alimentos facilitando su transformación en GABA. Este neurotransmisor es fundamental en la modulación del comportamiento. Tanto es así que ya hay estudios que demuestran que la administración de probióticos y, por tanto, un aumento de la disponibilidad de GABA, mejora el control de la ansiedad [7,19].
La mayoría de autores están de acuerdo en que de manera directa ni el GABA ni la serotonina atraviesan la BHE, sino que su acción es indirecta, gracias a la acción sobre el sistema nervioso entérico [20]. En contra de esta única acción indirecta, otros autores demostraron la existencia de un transportador de GABA en la BHE [21]. Estos resultados explicarían cómo el GABA puede penetrar en el sistema nervioso central y la modulación de la microbiota sobre la función del GABA en el cerebro [22].
Ácidos grasos de cadena corta
La microbiota también participa en la hidrólisis de los distintos polisacáridos en ácidos grasos de cadena corta, como el propionato, el butirato y el acetato [23]. Estos ácidos grasos de cadena corta producidos en el intestino sí atraviesan la BHE y llegan al hipotálamo, donde regulan los niveles de GABA, glutamato o glutamina, además de aumentar la expresión de péptidos anorexígenos [24]; a su vez, contribuyen a mantener la integridad de la BHE, lo que supone otro nexo entre la microbiota y el sistema nervioso central [25,26].
Eje hipotálamo-pituitario-adrenal [26]
Las acciones de la microbiota también afectan al eje hipotálamo-pituitario-adrenal, regulando la liberación de cortisol. En los ratones libres de gérmenes se han observado respuestas exageradas de citocinas inflamatorias ante situaciones de estrés. En esta línea, existen estudios que demuestran que niveles altos de Lactobacillus rhamnosus se correlacionan con menores niveles de corticosterona, mejor control del estrés, menor depresión y menor liberación de citocinas inflamatorias [11]. Y, viceversa, otros estudios demuestran que pequeñas exposiciones a estrés pueden impactar en el perfil de la microbiota, la respuesta al estrés y la activación del eje hipotálamo-pituitario-adrenal [27].
Sistema inmune
Los patrones moleculares asociados a diferentes patógenos son la forma de presentación de la microbiota frente al sistema inmune. Uno de ellos son los lipopolisacáridos. Estos lipopolisacáridos activan las células del sistema inmune, particularmente las del sistema innato (macrófagos, neutrófilos y células dendríticas). Una vez activadas, producen citocinas inflamatorias (interleucina-1a, interleucina-1b, factor de necrosis tumoral alfa e interleucina-6) que atraviesan la BHE. En el cerebro, estas citocinas actúan sobre los receptores expresados en las neuronas y las células gliales, concretamente en la microglía, alterando su estado de activación y función. A su vez, las citocinas son capaces de actuar sobre los receptores de diferentes nervios aferentes promoviendo alteraciones de las señales desde el tubo digestivo hasta el sistema nervioso central [28]. Del mismo modo, la microbiota también es capaz de facilitar la liberación de citocinas no inflamatorias, como pueden ser las producidas por el factor estimulante de colonias de granulocitos, que son capaces de atravesar la BHE y de estimular la neurogenia en el cerebro [29], lo que se ha visto como un factor protector tras una lesión isquémica.
Microbiota: posible patogenia y solución de enfermedades neurodegenerativas
Conforme se ahonda en el entendimiento del eje intestino-cerebro empiezan a establecerse ciertos postulados que hacen creer que existe una relación entre la microbiota y las enfermedades neurodegenerativas [30]. Estudios en ratones germ free demuestran que la microbiota es fundamental para un desarrollo cognitivo normal [31,32]. En esta línea, un estudio español realizado con ratones in vivo [33] relaciona la ingesta de un oligosacárido de la leche materna (2-fucosil-lactosa) con una mejora cognitiva. Los autores demuestran que la ingestión de este oligosacárido, a través de la leche materna, tiene una acción sobre el hipocampo que mejora los patrones de memoria, las habilidades de aprendizaje y los diferentes marcadores de plasticidad sináptica cerebral. Esto estaría en relación con la acción del oligosacárido sobre el eje microbiota-intestino-cerebro y su medicación por el nervio vago. Asimismo, la microbiota también participa en la generación de GABA, del factor neurotrófico derivado del cerebro, de la serotonina y de otras moléculas necesarias para el correcto funcionamiento del sistema nervioso central [34]. Cuando se produce una disbiosis, pueden verse alteradas las concentraciones de estas moléculas, lo que podría justificar en parte la aparición de diferentes enfermedades, como pueden ser trastornos del comportamiento, ansiedad [35], enfermedad de Alzheimer [36] o autismo [37]. Además, la microbiota interviene en la síntesis de péptidos que servirán como moléculas de adhesión para las células del huésped [38]. A veces estas moléculas serán las que generen autorreactividad y creen una reacción que dañe las propias estructuras nerviosas [25].
Estas razones llevan a pensar que la microbiota puede llegar a postularse como una de las causas responsables de diferentes enfermedades neurológicas, como la esclerosis múltiple [39], el trastorno por déficit de atención/hiperactividad [40], la enfermedad de Parkinson [41,42] o incluso la enfermedad de Alzheimer, y a que los probióticos se conviertan en una herramienta terapéutica, pero aún queda mucho por aclarar; por ejemplo, el hecho de que la mayoría de los estudios citados estén realizados en animales, con una composición de la microbiota diferente a la humana. Por ello, una de las principales dudas que surge es si estos resultados serán similares en los humanos. Para esclarecer esta hipótesis se han revisado varios estudios realizados con pacientes que presentaban patología neurológica en los cuales la administración de probióticos ha producido mejoras objetivas. Así, recientemente se ha publicado un estudio de pacientes con enfermedad de Alzheimer que, tras haber sido tratados con probióticos durante tres meses, presentaron una mejora cognitiva [43]. Nosotros hemos tenido la oportunidad de llevar a cabo un estudio piloto en el que, tras la administración de probióticos a pacientes con epilepsia farmacorresistente, se observó una efectividad (reducción del 50% o más de sus crisis) del 28,9% [44]. Estos resultados apoyan la idea de que los probióticos podrían ser en un futuro otro tratamiento para enfermedades neurológicas [45]. En la tabla se definen los conceptos de probióticos [46], prebióticos [47] o simbióticos [48], y se resumen los ensayos clínicos registrados con su uso en patología neurológica en la actualidad. Sin embargo, también hay publicado otro estudio en el que la administración de probióticos en voluntarios sanos no produce cambios en el rendimiento cognitivo [49].
| Tabla. Registro de ensayos clínicos en los que se utilicen prebióticos, probióticos o simbióticos en enfermedades neurológicas. | |||||
| Producto utilizado | Tiempo de administración | Enfermedad | Estado del estudio |
Objetivo principal | |
| NCT02342262 | B. bifidum W23, B. lactis W52, L. acidophilus W37, L. brevis W63, L. casei W56, L. salivarius W24, L. lactis W19, L. lactis W58 | 12 semanas | Migraña | Desconocido | Efecto en la frecuencia e intensidad de los ataques de migraña y la permeabilidad intestinal |
| NCT03259971 | Lactobacillus plantarum PS128 | 4 meses | Síndrome de Rett | Reclutamiento | Efecto en la mejora de los movimientos, comportamiento y situación cognitiva |
| NCT03324399 | Probiótico (no especificado) | 24 semanas | Esclerosis lateral amiotrófica | En marcha |
Mejora de la fuerza, espasticidad y calidad de vida |
| NCT01110447 | Lactobacillus (L. paracasei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacteria (B. longum, B. infantis, B. breve), una cepa de Streptococcus thermophilus | 24 semanas | Profilaxis secundaria de encefalopatía hepática | Finalizado | Valoración de recurrencia y necesidad de hospitalización por encefalopatía hepática |
| NCT02459717 | 125 mg de leche fermentada con múltiples probióticos (no especificados) y fibra prebiótica | 4 semanas | Estreñimiento en Parkinson |
Finalizado |
Cambio en el número de deposiciones espontáneas completas |
| NCT01008293 | Lactobacillus (L. casei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacterium (B. longum, B. breve, B. infantis) y una cepa de Streptococcus salivarius subsp. thermophilus | 2 meses | Encefalopatía hepática leve |
Finalizado | Comparar el efecto de la lactulosa frente a los probióticos en el tratamiento de la encefalopatía hepática y valorar la mejora en la calidad de vida |
| NCT00992290 | Lactobacillus GG | 8 semanas | Encefalopatía hepática |
Finalizado |
Valorar la seguridad del probiótico en estos pacientes |
| NCT01798329 | Lactobacillus (L. casei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus), tres cepas de Bifidobacterium (B. longum, B. breve, B. infantis) y una cepa de Streptococcus salivarius subsp. thermophilus | 15 semanas | Encefalopatía hepática |
Desconocido | Mejora neurocognitiva y neuropsicológica |
| NCT02723344 | Lactobacillus reuteri | 8 semanas | TCE leve y síndrome de estrés postraumático | Reclutando |
Disminución de la inflamación encontrada en los TCE |
| NCT01413243 | Trichuris suis ova | 12 meses | Esclerosis múltiple y SCA |
Finalizado | Número de lesiones hiperintensas en T2 tras un año de tratamiento |
| NCT03117322 | Agave inulina, Lactobacillus reuteri DSM 17938 | 4 semanas | Estreñimiento en niños con parálisis cerebral |
Reclutando | Cambio en las heces, en la composición de la microbiota, en el pH fecal y cambio en la frecuencia de las deposiciones |
| NCT03403907 |
Streptococcus thermophilus, Lactobacillus acidophilus, L. plantarum, L. paracasei, L. delbrueckii subsp. bulgaricus, Bifidobacterium breve, B. longus, B. infantis y CD2 |
4 meses | Epilepsia farmacorresistente | Completado | Reducir el número de crisis, mejorar la calidad de vida de los pacientes, valorar la evolución antiinflamatoria de las citocinas, seguridad de los probióticos |
| Prebiótico: sustrato utilizado selectivamente por los microorganismos del huésped y que confiere un beneficio para la salud. Probiótico: microorganismos vivos que, cuando se ingieren en las cantidades adecuadas, pueden aportar beneficios para la salud de quien los consume. Simbiótico: compuesto que combina prebiótico y probiótico en el que el prebiótico favorece selectivamente al probiótico. SCA: síndrome clínico aislado; TCE: traumatismo craneoencefálico. | |||||
Las investigaciones son alentadoras, pero todavía queda mucho por aclarar: ¿cuál es el mecanismo por el cual los probióticos realmente funcionan?, ¿se debe sólo a una cepa o a la simbiosis de ellas?, ¿qué dosis usamos?, ¿durante cuánto tiempo? Hay muchas preguntas sin respuesta, pero lo que está claro es que se abre un campo de investigación con muchas posibilidades.
Metal pesado

Cristales de osmio, un metal
pesado casi el doble de denso
que el plomo.1
Un metal pesado es un miembro de un grupo de elementos químicos no muy bien definido que exhibe propiedades metálicas. Se incluyen principalmente metales de transición, algunos semimetales, lantánidos y actínidos.
Muchas definiciones diferentes han propuesto basarse en la densidad, otras en el número atómico o peso atómico, y algunas en sus propiedades químicas o de toxicidad.2 De esta forma, la definición de metal pesado referida al peso atómico, un metal pesado es un elemento químico comprendido entre 63.55 (Cu) y 200.59 (Hg); otra manera se refiere a los metales de densidad entre 4 g/cm³ hasta 7 g/cm³ y también hay otra clasificación referida al número atómico.
El término metal pesado es considerado como una «mala denominación» en un informe técnico de la IUPAC debido a su definición contradictoria y su falta de «bases de coherencia científica».2 Existe un término alternativo metal tóxico, para el cual tampoco existe consenso de su exacta definición.
Como se discute luego, dependiendo del contexto, los metales pesados pueden incluir elementos livianos como el carbono y pueden excluir algunos de los metales más pesados. Los metales pesados se encuentran libres y de forma natural en algunos ecosistemas y pueden variar en su concentración.
Sin embargo hay una serie de elementos que en alguna de sus formas pueden representar un serio problema medioambiental y es común referirse a ellos con el término genérico de «metales pesados». En la actualidad, existen fuentes antropogénicas de metales pesados, por ejemplo la contaminación, que los ha introducido en los ecosistemas. Por ejemplo los combustibles derivados de la basura (no orgánica) generalmente aportan estos metales, así que se debe considerar los metales pesados cuando se utilizan los residuos como combustible.
Los metales pesados tóxicos más conocidos son el mercurio, el plomo, el cadmio y el arsénico, y en raras ocasiones, algún no metal como el selenio. A veces también se habla de contaminación por metales pesados incluyendo otros elementos tóxicos más ligeros, como el berilio o el aluminio.
Relación con los organismos vivos y alimentos
Los organismos vivos requieren diferentes cantidades de metales pesados. Los humanos requieren pequeñas cantidades de hierro, cobalto, cobre, manganeso, molibdeno, y zinc. Cantidades excesivas de ellos pueden dañar nuestro organismo. Otros metales pesados como mercurio, plutonio, y plomo son metales tóxicos que no tienen un efecto vital o beneficioso para el organismo, y su acumulación en el tiempo y en el cuerpo de los animales puede causar serias enfermedades, como por ejemplo saturnismo o envenenamiento por mercurio.
Algunos elementos que son normalmente tóxicos, para algunos organismos, bajo algunas condiciones pueden ser beneficiosos. Por ejemplo, el vanadio, el wolframio, incluso el cadmio.3
Metales pesados en el medio ambiente y en la salud
Otros causan corrosión, como zinc o plomo, o son malos por otros medios (por ejemplo el arsénico puede contaminar los catalizadores).
En la Unión Europea los once elementos más importantes son arsénico, cadmio, cobalto, cromo, cobre, mercurio, manganeso, níquel, plomo, estaño y talio, de los cuales sus emisiones en incineradores están reguladas. Algunos de ellos son necesarios para los humanos en pequeñas proporciones tales como cobalto, cobre, cromo, manganeso y níquel, mientras otros son carcinogénicos o tóxicos, afectando, entre otros, al sistema nervioso central (manganeso, mercurio, plomo, arsénico), los riñones o el hígado (mercurio, plomo, cadmio, cobre) o la piel, los huesos, o dientes (níquel, cadmio, cobre, cromo).5
La contaminación con metales pesados puede surgir de muchas fuentes, pero más comúnmente de la purificación de metales, por ejemplo, el smelting (proceso de extracción del metal de la piedra) extrae el metal de la piedra y del cobre para la preparación de combustible nuclear. La electro-deposición es la primera fuente de cromo y cadmio. Mediante la precipitación de estos compuestos o el intercambio de iones hacia los suelos y barros, los metales pesados se pueden localizar y quedar depositados. A diferencia de los contaminantes orgánicos, los metales pesados no decaen y presentan otros desafíos para remediarlos. Actualmente, se utilizan plantas (fitorremediación) y microorganismos para remover metales pesados, como el mercurio. Ciertas plantas que exhiben hiperacumulación pueden usarse para remover de los suelos estos metales por la concentración en biomateria.6 En algunos diques de cola se utiliza vegetación que luego es incinerada para recobrar los metales pesados.
Uno de los mayores problemas asociados a la aparición de metales pesados es el potencial de bioacumulación y biomagnificación causando mayor exposición de estos metales a un organismo de la que podría encontrarse sola en el medio ambiente. Peces de alta mar (como el Tetractenos glaber) y aves marinas (como la Fratercula arctica) son controlados por la presencia de estos contaminantes. Los principales lugares en los que se encuentra bioacumulación son los estuarios o lugares con agua salobre, debido a que los contaminantes son arrastrados a lo largo del trayecto de los ríos y depositada en los lechos lacustres, siendo reportados niveles elevados de metales pesados en el fondo, en algas, ostras y peces de consumo humano, tal como sucede en muchas lagunas de agua salobre en México, Nigeria, Egipto, en donde se han realizado estudios del suelo, plantas, agua y tejidos animales, encontrando niveles elevados para metales pesados por encima de lo permitido por sus sistemas de salud y control ambiental en cada una de las naciones.789101112
Medicina
En el uso médico, los metales pesados están pobremente definidos2 e incluyen a todos los metales tóxicos indistintamente de su peso atómico: los «envenenamientos por metales pesados» pueden incluir excesiva cantidad de hierro, manganeso, aluminio, mercurio, cadmio, o berilio (el cuarto elemento más liviano) o algunos como el semimetal arsénico. Esta definición puede incluir al bismuto como metal pesado, el más denso de los elementos estables, pese a su baja toxicidad.
La enfermedad de Minamata se da como resultado del envenenamiento por mercurio, la enfermedad itai-itai por envenenamiento con cadmio, y el saturnismo como envenenamiento con plomo.
Mercancías peligrosas
Los metales pesados en mercancías peligrosas son clasificados en su mayoría como «Clase 9: Materias y objetos que presentan peligros diversos» en el modelo de la ONU de clases de peligro, pero algunas veces mientras son transportados se los etiqueta como «Clase 6.1: Materias tóxicas».
Tecnología nuclear
El Burnup (combustible utilizable) del combustible nuclear, es expresado en gigavatio día por tonelada métrica de metales pesados, donde metales pesados significa actínidos como el torio, uranio, plutonio, etc., incluyendo material fisible y material fértil . Y no incluye elementos como el oxígeno agregado al material combustible, o material de revestimiento como el circonio, que puede ser considerado un metal pesado por otros estándares.
Conclusiones
Polucion, metales y gérmenes, forman un conglomerado que mutila los organisms y son responsables de la mayoría sino todas las enfermedade degenerativas.
Referencias
↑ Emsley, 2011, pp. 288; 374
↑ Saltar a:a b c John H. Duffus «»Heavy metals» a meaningless term? (IUPAC Technical Report)» Pure and Applied Chemistry, 2002, Vol. 74, pp. 793–807. doi 10.1351/pac200274050793
↑ Lane TW, Morel FM. A biological function for cadmium in marine diatoms.
↑ C.Michael Hogan. 2010. Heavy metal. Encyclopedia of Earth. National Council for Science and the Environment. eds. E. Monosson & C. Cleveland. Washington, D.C.
↑ Ron Zevenhoven, Pia Kilpinen: Control of Pollutants in Flue Gases and Fuel Gases. TKK, Espoo 2001.
↑ Pablo Higueras & Roberto Oyarzun. «10.- Restauración y remediación III: Suelos y Aguas subterráneas». Curso de Minería y Medio Ambiente. Archivado desde el original el 21 de febrero de 2012. Consultado el 6 de marzo de 2012.
↑ Rosas, BAez, Belmont: Oyster (Crassostrea virginica) as indicator of heavy metal pollution in some lagoons of the Gulf of Mexico. Water, Air, and Soil Pollution Volume 20, Issue 2 , pp 127-135
↑ Vazquez, Sharma, Alexander: Metals in some Lagoons of Mexico. Environmental Health Perspectives 103(Suppl 1):33-34 (1995)
↑ Rashed: CADMIUMAND LEAD LEVELS IN FISH (TILAPIA NILOTICA) TISSUES AS BIOLOGICAL INDICATOR FOR LAKEWATER POLLUTION. Environmental Monitoring and Assessment 68: 75–89, 2001.
↑ Ünlü, Topçuoğlu: Heavy metal pollution in surface sediment and mussel samples in the Gulf of Gemlik. Environ Monit Assess (2008) 144:169–178
↑ Guzmán-García, Botello: Effects of heavy metals on the oyster (Crassostrea virginica) at Mandinga Lagoon, Veracruz, Mexico. Rev. Biol. Trop. (Int. J. Trop. Biol. ISSN 0034-7744) Vol. 57 (4): 955-962 (diciembre de 2009)
↑ Vazquez, Aguirre: Cadmium, Lead and Zinc Concentrations in Water, Sediment and Oyster (Crassostrea virginica) of San Andres Lagoon, Mexico. Bull Environ Contam Toxicol (2011) 86:410–414
↵ 1. Lynch SV, Pedersen O. The human intestinal microbiome in health and disease. N Engl J Med 2016; 375: 2369-79.
↵ 2. Blanco JR, Oteo JA. Gut microbiota: so much to explore! Expert Rev Anti Infect Ther 2013; 11: 759-61.
↵ 3. Tojo R, Suárez A, Clemente MG, De los Reyes-Gavilán CG, Margolles A, Gueimonde M, et al. Intestinal microbiota in health and disease: role of bifidobacteria in gut homeostasis. World J Gasrtroenterol 2014; 20: 15163-76.
↵ 4. Korecka A, Arulampalam V. The gut microbiome: scourge, sentinel or spectator? J Oral Microbiol 2012; 4. doi: 10.3402/jom.v4i0.9367.
↵ 5. Collins SM, Bercik P. The relationship between intestinal microbiota and the central nervous system in normal gastro-intestinal function and disease. Gastroenterology 2009; 136: 2003-14.
↵ 6. Felice VD, Quigley EM, Sullivan AM, O’Keeffe GW, O’Mahony SM. Microbiota-gut-brain signalling in Parkinson’s disease: implications for non-motor symptoms. Parkinsonism Relat Disord 2016; 27: 1-8.
↵ 7. Foster JA, Rinaman L, Cryan JF. Stress and the gut-brain axis: regulation by the microbiome. Neurobiol Stress 2017; 7: 124-36.
↵ 8. Wang Y, Kasper LH. The role of microbiome in central nervous system disorders. Brain Behav Immun 2014; 38: 1-12.
↵ 9. Yoshikawa K, Kurihara C, Furuhashi H, Takajo T, Maruta K, Yasutake Y, et al. Psychological stress exacerbates NSAID-induced small bowel injury by inducing changes in intestinal microbiota and permeability via glucocorticoid receptor signaling. J Gastroenterol 2017; 52: 61-71.
↵ 10. Bienenstock J, Kunze W, Forsythe P. The microbiome-gut-brain axis and the consequences of infection and dysbiosis. Am J Gastroenterol Suppl 2016; 3: 33-40.
↵ 11. Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 2011; 108: 16050-5.
↵ 12. Carabotti M, Scirocco A, Maselli MA, Severi C. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Ann Gastroenterol 2015; 28: 203-9.
↵ 13. Neuman H, Debelius JW, Knight R, Koren O. Microbial endocrinology: the interplay between the microbiota and the endocrine system. FEMS Microbiol Rev 2015; 39: 509-21.
↵ 14. Hata T, Asano Y, Yoshihara K, Kimura-Todani T, Miyata N, Zhang XT, et al. Regulation of gut luminal serotonin by commensal microbiota in mice. PLoS One 2017; 12: e0180745.
↵ 15. Sharon G, Garg N, Debelius J, Knight R, Dorrestein PC, Mazmanian SK. Specialized metabolites from the microbiome in health and disease. Cell Metab 2014; 20: 719-30.
↵ 16. Cerdó T, Ruiz A, Suárez A, Campoy C. Probiotic, prebiotic, and brain development. Nutrients 2017; 9. pii: E1247.
↵ 17. Jenkins TA, Nguyen JC, Polglaze KE, Bertrand PP. Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients 2016; 8. pii: E56.
↵ 18. Malkki H. Parkinson disease: could gut microbiota influence severity of Parkinson disease? Nat Rev Neurol 2017; 13: 66-7.
↵ 19. Dinan TG, Stanton C, Cryan JF. Psychobiotics: a novel class of psychotropic. Biol Psychiatry 2013; 74: 720-6.
↵ 20. Dinan TG, Cryan JF. The microbiome-gut-brain axis in health and disease. Gastroenterol Clin North Am 2017; 46: 77-89.
↵ 21. Takanaga H, Ohtsuki S, Hosoya KI, Terasaki T. GAT2/BGT-1 as a system responsible for the transport of gamma-aminobutyric acid at the mouse blood-brain barrier. J Cereb Blood Flow Metab 2001; 21: 1232-9.
↵ 22. Sherwin E, Sandhu KV, Dinan TG, Cryan JF. May the force be with you: the light and dark sides of the microbiota-gut-brain axis in neuropsychiatry. CNS Drugs 2016; 30: 1019-41.
↵ 23. Raoult D. Obesity pandemics and the modification of digestive bacterial flora. Eur J Clin Microbiol Infect Dis 2008; 27: 631-4.
↵ 24. Frost G, Sleeth ML, Sahuri-Arisoylu M, Lizarbe B, Cerdan S, Brody L, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun 2014; 5: 3611.
↵ 25. Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med 2014; 6: 263ra158.
↵ 26. Michel L, Prat A. One more role for the gut: microbiota and blood brain barrier. Ann Transl Med 2016; 4: 15.
↵ 27. Galley JD, Nelson MC, Yu Z, Dowd SE, Walter J, Kumar PS, et al. Exposure to a social stressor disrupts the community structure of the colonic mucosa-associated microbiota. BMC Microbiol 2014; 14: 189.
↵ 28. Sampson TR, Mazmanian SK. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 2015; 17: 565-76.
↵ 29. Zhang D, Chen G, Manwani D, Mortha A, Xu C, Faith JJ, et al. Neutrophil ageing is regulated by the microbiome. Nature 2015; 525: 528-32.
↵ 30. Hill JM, Bhattacharjee S, Pogue AI, Lukiw WJ. The gastro-intestinal tract microbiome and potential link to Alzheimer’s disease. Front Neurol 2014; 5: 43.
↵ 31. Luczynski P, McVey Neufeld KA, Oriach CS, Clarke G, Dinan TG, Cryan JF. Growing up in a bubble: using germ-free animals to assess the influence of the gut microbiota on brain and behavior. Int J Neuropsychopharmacol 2016; 19. pii: pyw020.
↵ 32. Díaz-Heijtz R, Wang S, Anuar F, Qian Y, Björkholm B, Samuelsson A, et al. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A 2011; 108: 3047-52.
↵ 33. Vázquez E, Barranco A, Ramírez M, Gruart A, Delgado-García JM, Jiménez ML, et al. Dietary 2’-fucosyllactose enhances operant conditioning and long-term potentiation via gut-brain communication through the vagus nerve in rodents. PLoS One 2016; 11: e0166070.
↵ 34. Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
↵ 35. Morris G, Berk M, Carvalho A, Caso JR, Sanz Y, Walder K, et al. The role of the microbial metabolites including tryptophan catabolites and short chain fatty acids in the pathophysiology of immune-inflammatory and neuroimmune disease. Mol Neurobiol 2017; 54: 4432-51.
↵ 36. Bhattacharjee S, Lukiw WJ. Alzheimer’s disease and the microbiome. Front Cell Neurosci 2013; 7: 153.
↵ 37. De Angelis M, Francavilla R, Piccolo M, De Giacomo A, Gobbetti M. Autism spectrum disorders and intestinal microbiota. Gut Microbes 2015; 6: 207-13.
↵ 38. Grenham S, Clarke G, Cryan JF, Dinan TG. Brain-gut-microbe communication in health and disease. Front Physiol 2011; 2: 94.
↵ 39. Mielcarz DW, Kasper LH. The gut microbiome in multiple sclerosis. Curr Treat Options Neurol 2015; 17: 344.
↵ 40. Richarte V, Rosales K, Corrales M, Bellina M, Fadeuilhe C, Calvo E, et al. El eje intestino-cerebro en el trastorno por déficit de atención/hiperactividad: papel de la microbiota. Rev Neurol 2018; 66 (Supl 1): S109-14.
↵ 41. Cassani E, Barichella M, Cancello R, Cavanna F, Iorio L, Cereda E, et al. Increased urinary indoxyl sulfate (indican): new insights into gut dysbiosis in Parkinson’s disease. Parkinsonism Relat Disord 2015; 21: 389-93.
↵ 42. Dinan TG, Cryan JF. Gut feelings on Parkinson’s and depression. Cerebrum 2017; 2017. pii: cer-04-17.
↵ 43. Akbari E, Asemi Z, Daneshvar Kakhaki R, Bahmani F, Kouchaki E, Tamtaji OR, et al. Effect of probiotic supplementation on cognitive function and metabolic status in Alzheimer’s disease: a randomized, double-blind and controlled trial. Front Aging Neurosci 2016; 8: 256.
↵ 44. Gómez-Eguílaz M, Ramón-Trapero JL, Pérez-Martínez L, Blanco JR. The beneficial effect of probiotics as a supplementary treatment in drug-resistant epilepsy: a pilot study. Benef Microbes 2018; Sep 10. [Epub ahead of print].
↵ 45. Umbrello G, Esposito S. Microbiota and neurologic diseases: potential effects of probiotics. J Transl Med 2016; 14: 298.
↵ 46. World Health Organization & Food and Agriculture Organization of the United Nations. Probiotics in food. Health and nutritional properties and guidelines for evaluation. Rome: WHO/FAO; 2006. URL: http: //www.fao.org/3/a-a0512e.pdf. [30.01.2015].
↵ 47. Gibson GR, Hutkins RW, Sanders ME, Prescott SL, Reimer RA, Salminen SJ, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol 2017; 14: 491-502.
↵ 48. Firmansyah A, Dwipoerwantoro PG, Kadim M, Alatas S, Conus N, Lestarina L, et al. Improved growth of toddlers fed a milk containing synbiotics. Asia Pac J Clin Nutr 2011; 20: 69-76.
↵ 49. Kelly JR, Allen AP, Temko A, Hutch W, Kennedy PJ, Farid N, et al. Lost in translation? The potential psychobiotic Lacto-bacillus rhamnosus (JB-1) fails to modulate stress or cognitive performance in healthy male subjects. Brain Behav Immun 2017; 61: 50-9.
M. Gómez-Eguílaz, J.L. Ramón-Trapero, L. Pérez-Martínez, J.R. Blanco[REV NEUROL 2019;68:111-117]PMID: 30687918DOI: https://doi.org/10.33588/rn.6803.2018223 ![]() OPEN ACCESS
OPEN ACCESS
Volumen 68 | Número 03 | Nº de lecturas del artículo 201.171 | Nº de descargas del PDF 3.036 | Fecha de publicación del artículo 01/02/2019
2019 Revista de Neurología