VACUNAS DE ARNm Y CÁNCER
Podríamos preguntarnos de una manera un poco grosera cómo va lo del cáncer. Yo personalmente estoy muy contento con internet me parece un regalo puedo leer resumido pero actualizado cantidad de cosas que de otra forma serían muy dificultosas de encontrarlas y se tendrían que revisar muchas revistas muchos libros y la verdad que simplificar es la norma
En la actualidad puedo disfrutar de actualizaciones muy resumidas inherentes a múltiples procesos fácilmente.
La epidemia de coronavirus retrasó la búsqueda y aplicación del ARNm.
En 2020, las vacunas basadas en ARN mensajero (ARNm) ya protagonizaban diversos ensayos y publicaciones, orientadas a emplear esa tecnología en la lucha contra el cáncer. Los resultados preliminares mostraban que había sitio para ambas entidades, vacunas y cáncer con el uso de una tecnología completamente nueva.
La pandemia del coronavirus retraso la búsqueda y aplicación del ARNm, y todo pasó aparentemente a un segundo plano. El cáncer seguía siendo una de las grandes amenazas, pero la saturación del sistema sanitario y lo excepcional de la situación provocaron retrasos en los diagnósticos y en los tratamientos.
El estudio del ARNm en el cáncer sirvió, gracias a la visión de algunos investigadores como Katerin Karico y otros , que se les ocurrió aplicar sus estudios en el cáncer para fabricar su vacuna ARNm contra el Corona-CoV-2.
Sin los años previos dedicados a la investigación de las vacunas de ARNm no habría sido posible desarrollar una versión contra la infección por SARS-CoV-2 en tan poco tiempo.
Hasta no hace mucho se tardaba entre 10 y 15 años en desarrollar una vacuna, pero Pfizer y Moderna consiguieron probar la eficacia y seguridad de su propuesta para la Covid-19 en menos de un año. El desarrollo y su aplicación masiva fueron de una utilidad magnifica.
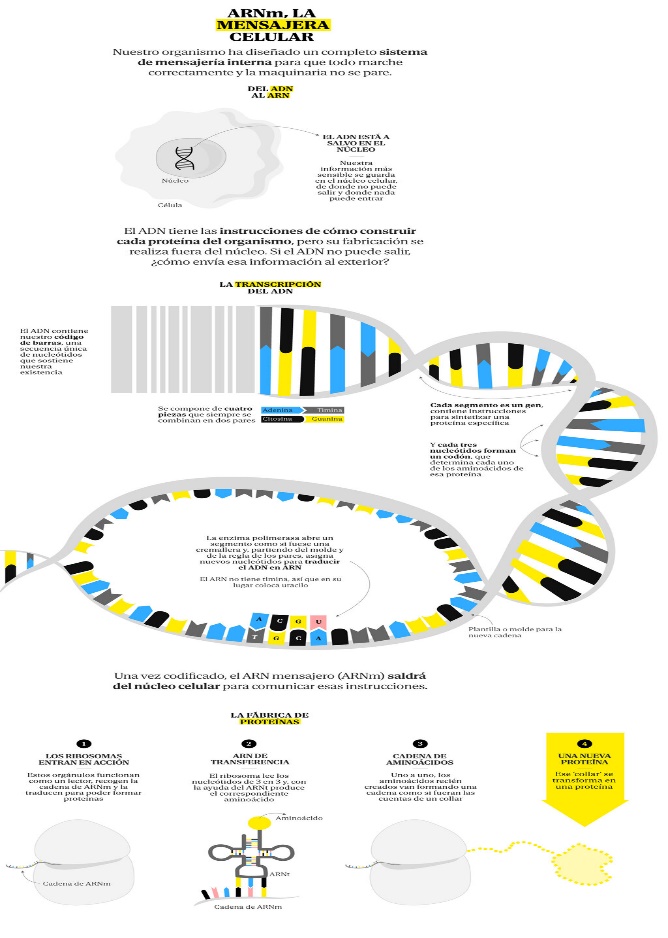
En las enfermedades contagiosas una de sus principales ventajas es que no se basan en inocular un virus o parte de él, lo que conlleva un cultivo previo del mismo en laboratorio y un proceso de purificación.
Las vacunas de ARNm usan la maquinaria celular para que nuestras células produzcan proteínas idénticas a las que portan los virus en su superficie, y aprendan a reconocerlas y destruirlas.
La via que se utiliza es:
Secuenciar el ARN viral y localizar la parte en la que se explica cómo producir esa proteína en cuestión, copiarla e inocularla en el cuerpo para que las células hagan el trabajo sin que suponga un riesgo para el individuo. El ARN se degrada muy rápidamente y en ningún caso afecta a nuestro ADN, que permanece protegido en el núcleo de las células. Y puesto que tampoco se inocula un virus, son una opción más segura
En el cáncer el enfoque es distinto. En primer lugar, y al contrario de lo que ocurre con los Coronavirus, se trata de vacunas terapéuticas, no preventivas. Si bien las vacunas de la hepatitis B y el virus del papiloma humano previenen una infección que podría derivar en un tumor, no son un ejemplo del abordaje necesario en otros casos.
Por otra parte, el enemigo a batir es más escurridizo y estas vacunas necesitan un objetivo claro y definido para ser eficaces. «Estas vacunas se diseñan para que nuestro sistema inmune reconozca algunas proteínas como una amenaza y las ataque»,1.- «pero en el caso de las células tumorales, que son células de nuestro propio cuerpo que mutan, esas células al final comparten proteínas muy similares a las de las células sanas vecinas».
La similitud entre las células enfermas y las sanas no solo resta eficacia, también supone un riesgo. «Podría pasar que nuestro sistema inmune atacase a las células sanas y producir problemas autoinmunes», afirma el doctor Sánchez-Bayona, «Para ello se necesitan encontrar proteínas ‘diana’ que tengan las células tumorales y no se expresen o que lo hagan en muy baja proporción en las células sanas».
La clave para superar esta dificultad también es la que hace que estas vacunas sean tan prometedoras. Y es que la identificación de esas ‘dianas’ pasa por un estudio personalizado del paciente, de forma que las vacunas de ARNm se perfilan como un estandarte de la medicina personalizada.
Hoy en día es posible secuenciar las células sanas y las tumorales para poder compararlas entre sí e identificar con precisión las diferencias. Hablamos de cientos, incluso miles de mutaciones, que gracias a la informática podremos reducir a un número más manejable de posibilidades.
Se trata de identificar los llamados neoantígenos, aquellos específicos para el tumor de un paciente (puede tener marcadores únicos), comunes en un determinado tipo de cáncer o compartidos entre varios tipos. Para ello, bastaría con analizar los tejidos del paciente, además de contar con una base de datos que permita comparar perfiles. Las vacunas de ARNm pueden incorporar hasta 34 neoantígenos, de forma que podrían apuntar a varias ‘dianas’ a la vez.
En la era de la medicina personalizada las vacunas de ARNm son una herramienta a tener en cuenta, y además con un perfil de efectos secundarios mejor tolerados que el de la quimioterapia convencional. “Aunque la inmunoterapia puede producir reacciones como fiebre, dolor muscular o dolor en las articulaciones tras su administración”, «suelen ser efectos leves y transitorios en su gran mayoría». Lo vimos con las vacunas del covid-19, y es un cuadro conocido.
Pero las ventajas no quedan ahí, el oncólogo recuerda que las vacunas pueden llegar a generar memoria inmunológica, así que de igual modo que podemos presentar batalla a un virus como el SARS-CoV-2 tras habernos vacunados, nuestro sistema inmune también podría ser capaz de reconocer la amenaza de cáncer en un futuro si existen recaídas con células que presenten la misma proteína, atacándolas antes de que ésta sea clínicamente evidente.
Vacunas ARNm contra el cáncer
En la actualidad se está probando con éxito la posibilidad de combinar la vacuna de ARNm con otras inmunoterapias. Moderna publicó hace algunas semanas los resultados preliminares de un ensayo clínico en pacientes con Melanoma en estadio III/IV que recibieron tanto la vacuna como inmunoterapia con Pembrolizumab. Al comparar los resultados de esta combinación con los de pacientes que solo habían recibido el Pembrolizumab, se constató una reducción del 44% en el primer grupo en el riesgo de recidiva o muerte por enfermedad.
Lo evidente es que las vacunas permiten un mayor grado de personalización en el tratamiento que las inmunoterapias basadas en anticuerpos, tienen una «alta especificidad». Pero al mismo tiempo estas terapias resultan un complemento muy interesante, ya que «estimulan al sistema inmune para que reconozca las células tumorales como una amenaza», potenciando así la eficacia de la vacuna.
No se conseguirá algo de forma inmediata, los tiempos no serán tan rápidos como con la covid. Quedan años de trabajo, investigación y ensayos hasta que estos indicios se traduzcan en un éxito tangible, en una cura real. Pero hoy podemos vislumbrar ese futuro un poco más cerca.
Los casos de cáncer en España se estabilizan. Pero, la inversión en ciencia sigue congelada, lo que obstaculiza que los avances se instalen rápidamente.
En 2023 se estabilizan los casos de cáncer en España, según el informe realizado por la Sociedad Española de Oncología Médica (SEOM) Las cifras del cáncer en España 2023, presentado con motivo del Día Mundial del Cáncer que se celebrará el próximo 4 de febrero. Así, este año se esperan 279.260 nuevos diagnósticos, frente a los 280.100 del pasado año, siendo el colorrectal, el de mama, pulmón, próstata y vejiga urinaria los más detectados, al igual que ocurrió en 2022.
Este informe, realizado en colaboración con la Red Española de Registros de Cáncer (Redecan), aporta los últimos datos disponibles de esta entidad así como los del Instituto Nacional de Estadística (INE) para España. «Estos datos indican una estabilización del cómputo total con respecto al pasado año. Pero, en la estimación estadística y epidemiológica no se incluye el posible efecto de la covid-19 en esta estabilización», señala Jaume Garcerán, presidente de Redecan, originado, probablemente, por el elevado número de pacientes mayores de edad que fallecieron en la pandemia.
Garcerán también explica que al igual que se espera un incremento de la incidencia del cáncer en el mundo, en España, la incidencia en 2040 podría alcanzar los 341.000 casos».
En contrapartida, la estabilización también se sigue produciendo en las partidas económicas para investigación. Cuanto antes incorporemos los avances, cuanto más se invierta, más repercute sobre la vida de las personas y sobre su calidad de vida».
Las inversiones para investigación, en general, se mantienen » por debajo de paises de nuestro entorno», señala Enriqueta Felip, presidenta de SEOM. Aún así, los ensayos clínicos y la investigación de excelencia siguen adelante.
Reforzar los recursos
La inversión para ciencia «no alcanza aún el 2% del PIB, cifra por debajo de la de países como Francia, Italia o Alemania, por ejemplo, que realizan una apuesta más importante», detalla De Castro, quien, no obstante, señala que se están haciendo esfuerzos en esta propuesta que, seguramente, partió de mínimos, no de máximos».
Y es que la innovación, término en el que se encuadran actualmente la medicina de precisión y las terapias dirigidas, está ligada directamente a los avances en investigación, tanto básica como traslacional.
«Los nuevos tratamientos se basan en investigación y no solo de nuevos fármacos y de diagnósticos sino todo lo que rodea a las investigaciones básica y clínica. Para ello hay que tener recursos. Por ejemplo, la puesta en marcha de ensayos clínicos, en los que destacamos la generosidad de pacientes y familiares por su participación, constituyen la prueba de concepto para el desarrollo de nuevos fármacos eficaces y seguros, así como de oportunidades para el paciente».
Con prudencia, pero con optimismo, los expertos relatan la innovación que ha supuesto la medicina de precisión en el abordaje del cáncer y la puesta en marcha de un programa nacional -que ya se están implementando en algunas comunidades autonómas españolas- y que recoge, entre otros aspectos, la secuenciación masiva de genes que ofrece la posibilidad de tratamiento personalizado a cada tumor y a cada paciente», considera De Castro.
Las cifras para 2023
En el último informe 2023 de las cifras del cáncer en España se concluye que los cánceres de colon y recto (42.721 nuevos casos), mama (35.001), pulmón (31.282), próstata (29.002) y vejiga urinaria (21.694) serán los más frecuentemente diagnosticados. Muy por detrás se encuentran los linfomas no hodgkinianos (9.943), el cáncer de páncreas (9.280), el cáncer de riñón (8.626), el melanoma maligno cutáneo (8.049), los cánceres de cavidad oral y faringe (7.882), y los cánceres de cuerpo uterino (7.171), estómago (6.932) e hígado (6.695).
En los hombres, al igual que en 2022, serán mayoritarios los de próstata (29.002), colon y recto (26.357), pulmón (22.266) y vejiga urinaria (17.731). En las mujeres, los de mama (35.001) y los de colon y recto (16.364). «En mujeres, el de pulmón es el más incidente desde 2019 por el aumento del consumo de tabaco en el mismo a partir de los años 70. Hace año, este tumor en mujeres no aparecía ni el décimo lugar», indica Garcerán.
 Cifras de supervivencia de cáncer en 2023 y los factores de riesgo asociados. Infografía: SEOM.
Cifras de supervivencia de cáncer en 2023 y los factores de riesgo asociados. Infografía: SEOM.
En las últimas décadas, el número absoluto de cánceres diagnosticados en España se ha incrementado por varias causas: el aumento poblacional, el envejecimiento de la población, la exposición a factores de riesgo (como el tabaco, el alcohol, la contaminación, la obesidad o el sedentarismo) y, la detección precoz en algunos tipos de cáncer como el colorrectal, los de mama, cérvix o próstata.
En general, la supervivencia ha aumentado tres puntos, tanto en hombres como en mujeres, con mayores tasas en menores de 75 años. «Aumenta por la prevención, por los diagnósticos precoces, por los nuevos tratamientos. Pero, avanza lentamente, lo que pone de relieve la importancia de la investigación», considera Garcerán.
La supervivencia «se ha duplicado en los últimos 40 años, teniendo en cuenta datos solo hasta 2008, lo que indica que no se han recogido los avances que se han producido en los últimos años y que han repercutido, claramente, en un aumento de la misma», indica Felip.
En cuanto a la mortalidad por cáncer a nivel mundial, al igual que con la incidencia, se espera un incremento en los próximos años. En concreto se baraja la cifra de más de 16 millones de personas en 2040. En España, en concreto pasará de 112.000 en 2020 a más de 159.000 en 2040.
Los cánceres responsables del mayor número de fallecimientos a nivel mundial fueron el de pulmón (18,2% del total de muertes por cáncer), el colorrectal (9,5%), el hepático (8,4%), el de estómago (7,8%) y el de mama (6,9%). En España el INE ha publicado recientemente los datos de mortalidad para el año 2021 que reflejan que se produjeron 450.744 defunciones con una disminución de la tasa bruta de mortalidad del 8,7% respecto al año anterior.
Los tumores constituyen la segunda causa de muerte en nuestro país (25,2% de los fallecimientos, 113.662) con un aumento del 0,8% respecto al año anterior y sólo por detrás de las enfermedades del sistema circulatorio (26,4% de las muertes, 119.196). Las enfermedades infecciosas, que incluyeron la covid-19, fueron la tercera causa de muerte con el 10,2% del total.
En los hombres, los tumores han seguido siendo la principal causa de mortalidad en España en 2021 (67.884), por delante de las enfermedades cardiovasculares (55.905) e infecciosas (25.728). Sin embargo, en las mujeres, las enfermedades cardiovasculares fueron la principal causa de mortalidad (63.291), seguidas de los tumores (45.818) y las enfermedades infecciosas (20.273).
La supervivencia neta a cinco años del diagnóstico de los pacientes diagnosticados entre 2008-2013, en España fue de 55,3% en los hombres y de 61,7% en las mujeres. Esta diferencia se debe probablemente a que determinados tumores son más frecuentes en un sexo que en otro, ya que las diferencias más importantes en supervivencia se deben al tipo tumoral (junto con el estadio al diagnóstico).
«La supervivencia de los pacientes con cáncer de España es similar a la de los países de nuestro entorno. Se estima que se ha duplicado en los últimos 40 años y es probable que, aunque lentamente, continúe aumentando en los próximos años.
Bibliografia
1.- Rodrigo Sánchez-Bayona, secretario científico de la Sociedad Española de Oncología Médica (SEOM) y oncólogo del Hospital Universitario 12 de Octubre en Madrid,
Gracia de Pablos. Madrid Dom, 05/02/2023 – 08:00
Javier de Castro, Enriqueta Felip y Jaume Garcerán, de SEOM. Foto: SEOM.
explica el doctor Sánchez-Bayona,
Raquel Serrano. Madrid Lun, 30/01/2023 – 14:53
Jaume Garcerán, presidente de Redecan,
![4: Glioblastoma con un alto grado de densidad celular y algunas células multinucleadas [29].](http://enriquerubio.net/wp-content/uploads/4-glioblastoma-con-un-alto-grado-de-densidad-celu.png)
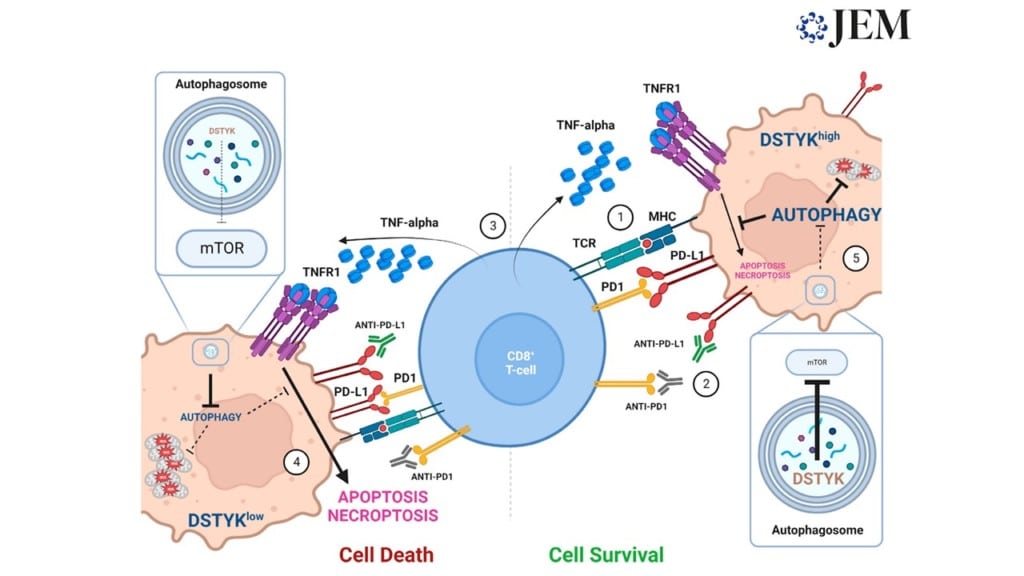
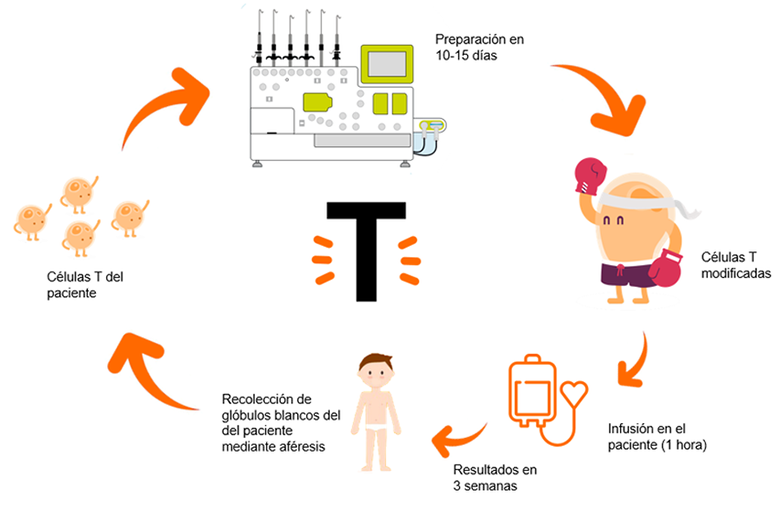
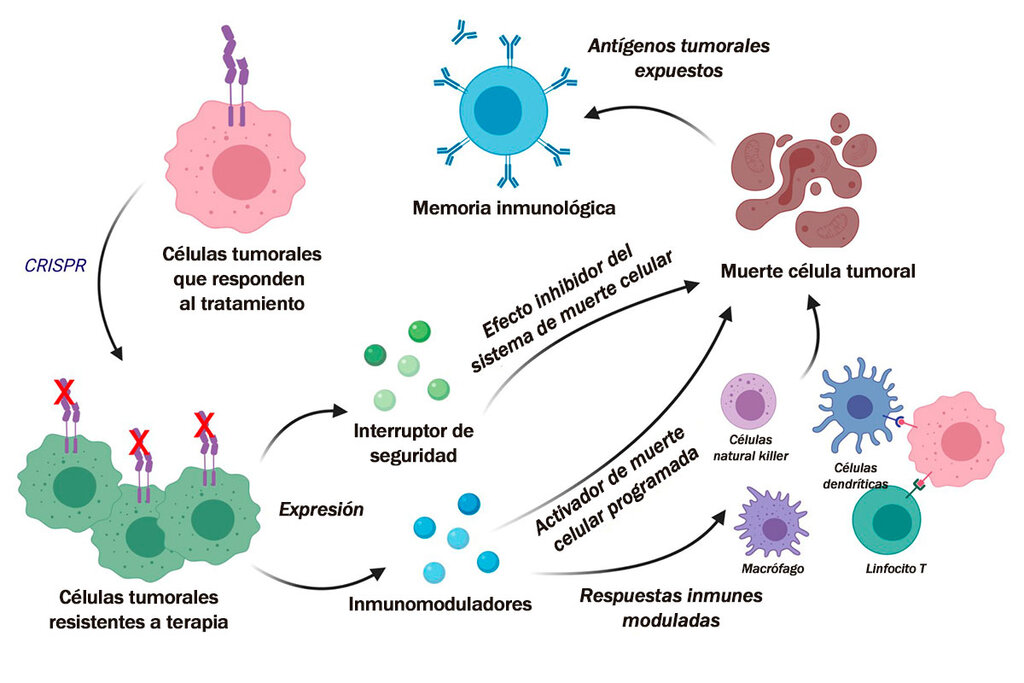 Esquema gráfico del desarrollo de esta nueva terapia celular frente al cáncer. Gráfico: KOK SIONG CHEN Y KHALID SHAH.
Esquema gráfico del desarrollo de esta nueva terapia celular frente al cáncer. Gráfico: KOK SIONG CHEN Y KHALID SHAH.
 40 años de sida: el primer caso de VIH del Estado se diagnosticó en Vall d’Hebron
40 años de sida: el primer caso de VIH del Estado se diagnosticó en Vall d’Hebron
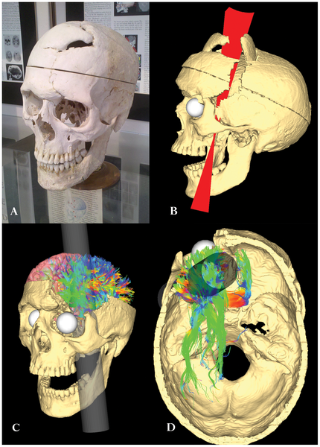

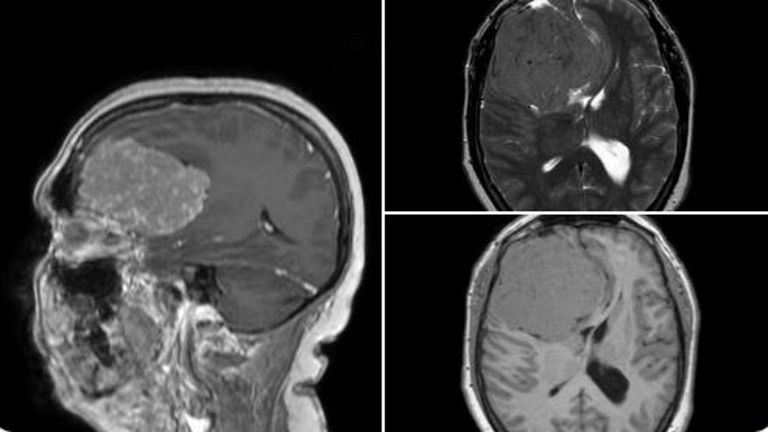 Imágenes del cerebro de la paciente en las que se observa el enorme tumor del lóbulo frontal
Imágenes del cerebro de la paciente en las que se observa el enorme tumor del lóbulo frontal
 A AL CANCER
A AL CANCER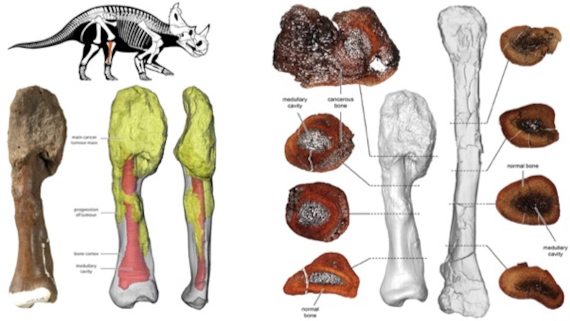 El peroné de Centrosaurus apertus, mostrando osteosarcoma. Crédito: Royal Ontario Museum/McMaster University
El peroné de Centrosaurus apertus, mostrando osteosarcoma. Crédito: Royal Ontario Museum/McMaster University En los elefantes, una especie con una baja incidencia de cáncer, se ha encontrado un gen supresor de tumores. Crédito: Diego Delso
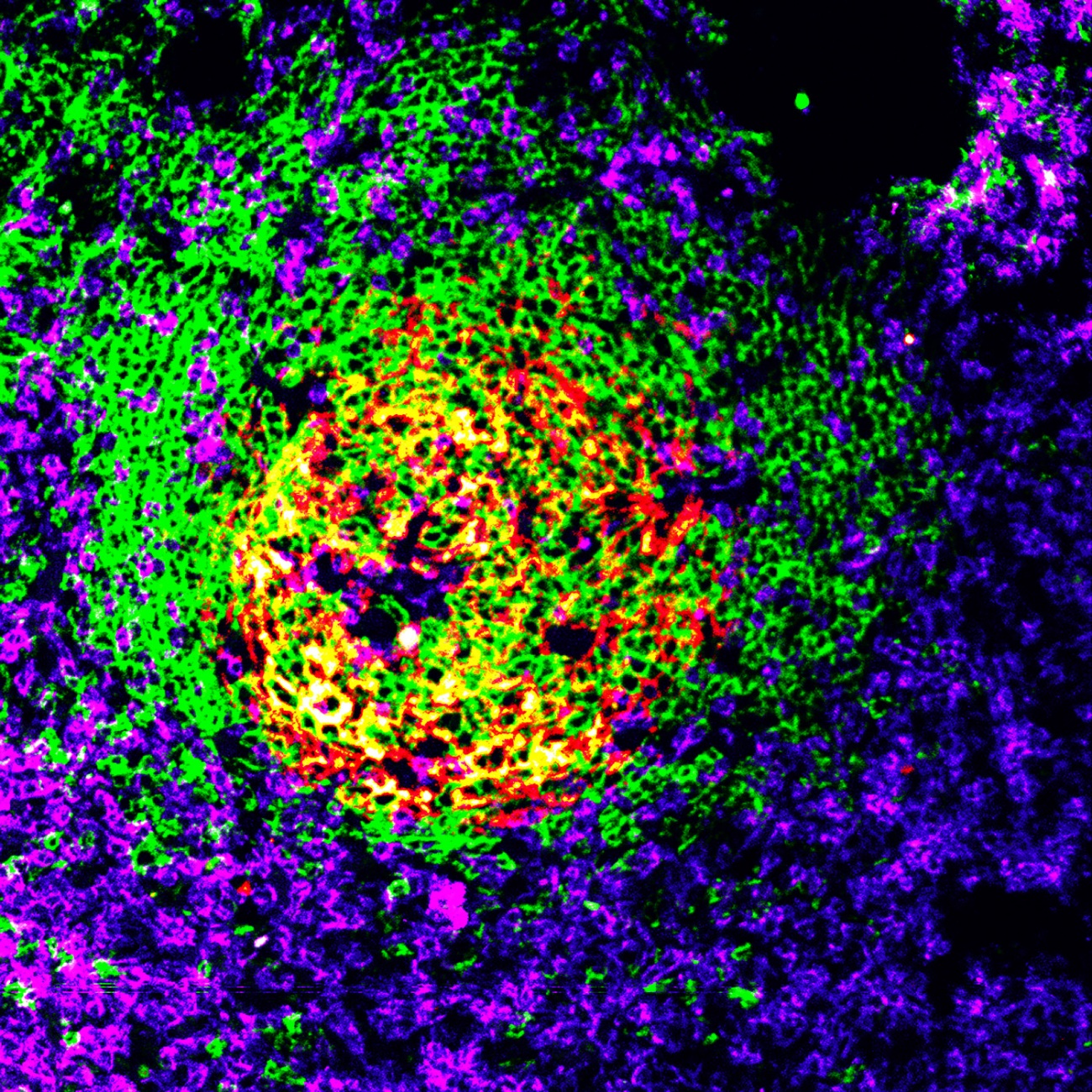
En los elefantes, una especie con una baja incidencia de cáncer, se ha encontrado un gen supresor de tumores. Crédito: Diego Delso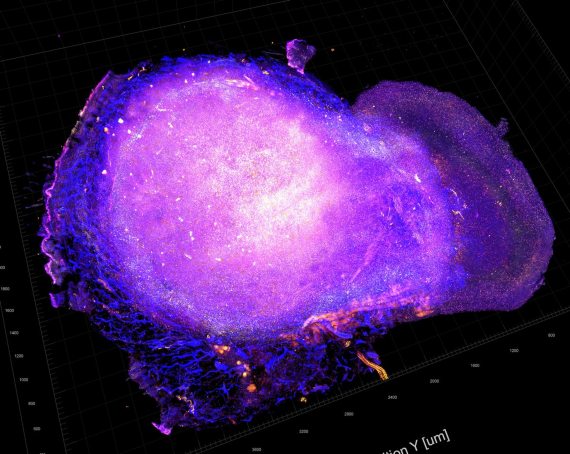 Respuesta inmunitaria antitumoral. Crédito: NIH
Respuesta inmunitaria antitumoral. Crédito: NIH

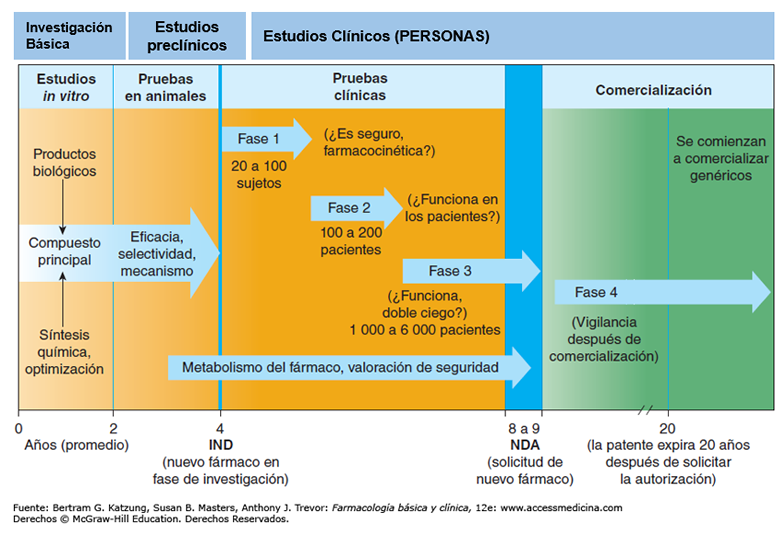
 e dos décadas de investigación se encuentra de lleno en la fase III de ensayo clínico.
e dos décadas de investigación se encuentra de lleno en la fase III de ensayo clínico.