VACUNA Y TRATAMIENTO DEL GLIOBLASTOMA
Terapia bifuncional con células cancerígenas diseñada para eliminar tumores establecidos y entrenar al sistema inmunitario para prevenir la recurrencia.
![4: Glioblastoma con un alto grado de densidad celular y algunas células multinucleadas [29].](http://enriquerubio.net/wp-content/uploads/4-glioblastoma-con-un-alto-grado-de-densidad-celu.png)
Glioblastoma con un alto grado de densidad celular y algunas células multinucleadas [29].
El glioblastoma es un cáncer cerebral de mal pronóstico y complejo abordaje.
Una novedosa forma de convertir las células cancerosas en potentes anticancerígenos y con una estrategia bifuncional: tratar y prevenir el tumor mediante la transformación de células tumorales vivas en un agente de tratamiento. Para ello, el equipo de Shah, director del Centro de Células Madre e Inmunoterapia Traslacional (CSTI) y vicepresidente de investigación en el Departamento de Neurocirugía del Brigham y profesores de la Escuela de Medicina de Harvard y el Instituto de Células Madre de Harvard (HSCI), en Estados Unidos, ha diseñado células tumorales vivas utilizando la herramienta de edición de genes CRISPR-CAS9 que fueron reutilizadas para liberar el agente que elimina las células tumorales.
Concretamente, los científicos han probado su vacuna anticancerígena de doble acción en un modelo de ratón afectado en cáncer cerebral; un glioblastoma avanzado, con resultados prometedores, según publican en Science Translational Medicine.
Células tumorales atacantes
El glioblastoma es el tumor cerebral primario más frecuente y de peor pronóstico. Tiene una evolución rápida y su aparición puede provocar cefaleas, somnolencia, convulsiones y problemas neurológicos que afecten a la visión, al habla y al movimiento, entre otra sintomatología.
Shah explica en el trabajo que el equipo persiguió una idea simple: tomar células cancerígenas y transformarlas en «vacunas y asesinos contra el cáncer». «Usando la ingeniería genética, estamos reutilizando las células cancerosas para desarrollar un tratamiento que elimine las células tumorales pero que, además, estimule el sistema inmunitario para destruir los tumores primarios y prevenir el cáncer», concreta.
Las vacunas para el tratamiento del cáncer son viejas conocidas y con una acción distinta a las que se emplean contra otros virus. En su desarrollo, el objetivo primordial ha sido el de preparar el sistema inmunitario para atacar las células malignas presentes en el organismo: es decir, en vez de centrarse en prevenir la enfermedad, estas estrategias buscan que sean el propio sistema inmunitario el que plante cara a una patología ya existente.
En estos momentos, en el área oncológica hay estrategias que podrían considerarse preventivas, como puede ser el caso de inmunizaciones frente a los virus del papiloma humano (VPH) o de la hepatitis B (VHB). En el ámbito terapéutico se han realizado diseños para el cáncer de próstata y el melanoma.
En cualquier caso, las vacunas contra el cáncer son un área activa de investigación para muchos laboratorios, pero el enfoque que ha adoptado el equipo de Shah es distinto. En lugar de utilizar células tumorales inactivadas, el equipo reutiliza células tumorales vivas, que poseen una característica inusual.
«Al igual que las palomas mensajeras que vuelven a posarse, las células tumorales vivas viajarán largas distancias a través del cerebro para regresar al sitio de sus células tumorales compañeras», señala el coordinador la investigación.
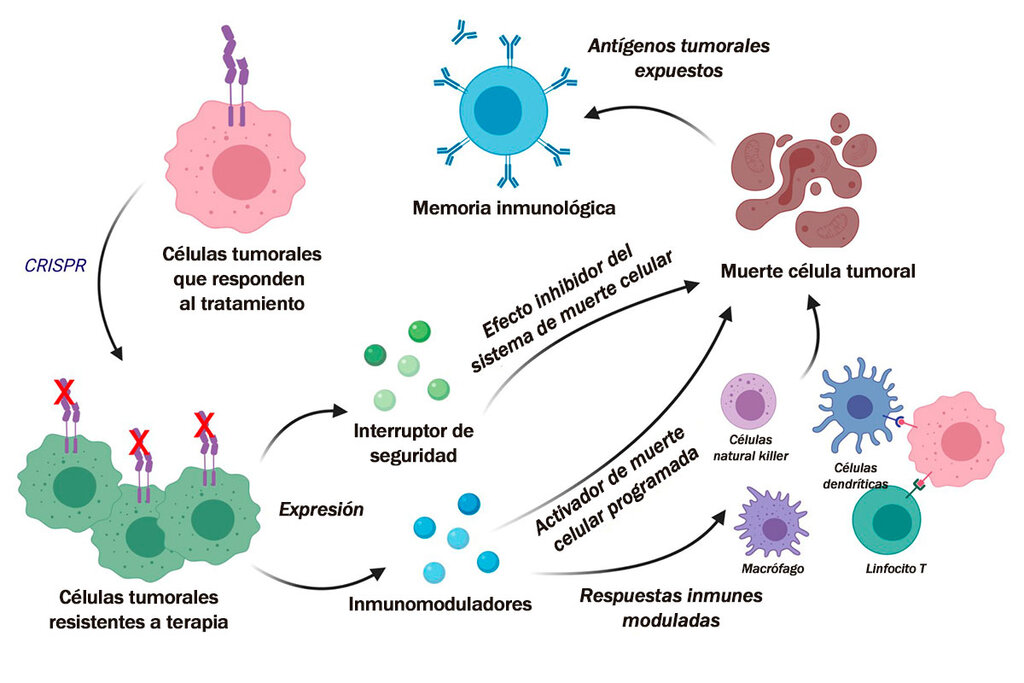 Esquema gráfico del desarrollo de esta nueva terapia celular frente al cáncer. Gráfico: KOK SIONG CHEN Y KHALID SHAH.
Esquema gráfico del desarrollo de esta nueva terapia celular frente al cáncer. Gráfico: KOK SIONG CHEN Y KHALID SHAH.
Aprovechando esta propiedad única, el equipo de Harvard diseñó células tumorales vivas utilizando la herramienta de edición de genes CRISPR-Cas9 y las reutilizó para liberar el agente que elimina las células tumorales.
Además, las células tumorales modificadas se diseñaron para expresar factores que facilitarían que el sistema inmunitario las detectara, etiquetara y recordara, preparando así al sistema inmunitario para una respuesta antitumoral a largo plazo.
El equipo probó sus células tumorales terapéuticas (ThTC) mejoradas con CRISPR y modificadas con ingeniería inversa en diferentes cepas de ratones, incluidas la que tenía células de médula ósea, hígado y timo derivadas de humanos, imitando el microambiente inmunitario humano. Se construyó además un interruptor de seguridad de dos capas en la célula cancerosa que, cuando se activa, erradica las ThTC si es necesario.
Sin embargo, en el trabajo los investigadores consideran que esta estrategia terapéutica «es aplicable a una gama más amplia de tumores sólidos, lo que justifica el desarrollo de más investigaciones con respecto a sus aplicaciones».
Esta terapia celular de doble acción fue segura, aplicable y eficaz en estos modelos, lo que «sugiere una nueva hoja de ruta hacia el tratamiento». Si bien los investigadores consideran que se necesitan más pruebas y desarrollo, el equipo ha elegido específicamente este modelo y utilizado células humanas para allanar el camino del trasvase de sus hallazgos al entorno de los pacientes.
Una idea y propósito que recalca Shah: «A lo largo de todo el trabajo que se ha llevado a cabo, incluso en las partes más técnicas, nunca hemos perdido de vista al paciente», señala subrayando que «nuestro objetivo es adoptar un enfoque innovador pero traducible para que podamos desarrollar una vacuna terapéutica contra el cáncer que, en última instancia, tendría un impacto duradero en la medicina».
DIRECTOR, CENTRO DE CÉLULAS MADRE E INMUNOTERAPIA TRASLACIONAL, BRIGHAM AND WOMEN’S HOSPITAL

El tratamiento exitoso de los tumores cerebrales sigue siendo uno de los mayores desafíos en oncología. El reconocimiento de que diferentes tipos de células que tienen potencial terapéutico pueden integrarse adecuadamente en todo el cerebro de los mamíferos después del trasplante ha revelado nuevas posibilidades para su uso en trasplantes. Nuestro laboratorio ha demostrado que diferentes células madre y células cancerosas albergan sitios de patología cerebral y, por lo tanto, pueden armarse con proteínas terapéuticas y virus oncolíticos, una estrategia que puede usarse para atacar células tumorales y células inmunitarias en el microambiente tumoral (TME) .
Nuestra investigación se basa en el desarrollo de modelos traducibles clínicamente de tumores cerebrales primarios, recurrentes y metastásicos, y terapias de receptores de superficie celular basadas en células que se dirigen simultáneamente a las vías de proliferación y muerte celular en un esfuerzo por erradicar los tumores cerebrales. Hemos diseñado diferentes tipos de células madre para liberar proteínas terapéuticas para inducir específicamente la apoptosis en las células tumorales y apuntar a diferentes poblaciones de células inmunitarias en TME y las hemos probado en modelos de tumores de ratón primarios y metastásicos. Nuestro laboratorio también se ha centrado en detectar tumores que son resistentes a diferentes fármacos terapéuticos y virus oncolíticos. Como resultado, hemos desarrollado moléculas terapéuticas bimodales que se pueden administrar con células madre y virus del herpes oncolítico, y hemos demostrado su eficacia en modelos de ratones con tumores cerebrales agresivos e invasivos.
Las células tumorales son prometedoras como agentes anticancerígenos debido a su capacidad para servir como fuente natural de neoantígenos específicos del paciente. Para aprovechar esto como terapia, recientemente hemos diseñado células tumorales autodirigidas mediante CRISPR/Cas9 para eliminar los receptores de la superficie celular y liberar ligandos dirigidos para matar las células tumorales. Hemos demostrado que las células tumorales terapéuticas reutilizadas (ThTC) se alojan específicamente en las células tumorales y liberan ligandos específicos que inducen la destrucción de las células tumorales, lo que se traduce en importantes beneficios de supervivencia en modelos de ratones con cáncer primario y cerebral. Más recientemente, hemos diseñado células tumorales para liberar agentes inmunomoduladores duales y hemos demostrado el potencial de estos ThTC para matar células tumorales e inducir memoria inmunológica simultáneamente. Intrínsecamente vinculados al paradigma de la terapia de tumores cerebrales están las técnicas de imagen,
En un esfuerzo por trasladar las terapias basadas en células a entornos clínicos, hemos demostrado que la encapsulación de células madre y células cancerosas dirigidas al receptor en una matriz extracelular sintética evita su rápido «lavado» posterior al trasplante en la cavidad de resección del tumor y tiene un efecto terapéutico significativo. beneficio en la supervivencia de ratones portadores de tumores cerebrales resecados. Nuestro programa de investigación está comprometido a lograr la visión de crear una oferta terapéutica «lista para usar» para el cáncer que impacte positivamente en la calidad de vida de las personas afectadas en todo el mundo.
Fundamentos
Shah, director del Centro de Células Madre e Inmunoterapia Traslacional (CSTI) y vicepresidente de investigación en el Departamento de Neurocirugía del Brigham y profesores de la Escuela de Medicina de Harvard y el Instituto de Células Madre de Harvard (HSCI), en Estados Unidos, ha diseñado células tumorales vivas utilizando la herramienta de edición de genes CRISPR-CAS9 que fueron reutilizadas para liberar el agente que elimina las células tumorales.