LA MICROBIOTA INTESTINAL EN LA SALUD Y ENFERMEDAD
No hay dudas de la relación que existe entre microbioma intestinal y salud, pero también la relación con la enfermedad
Aunque esta relación es compleja. Existen datos evidentes de la relación y por consiguiente el estudio de como equilibrar esta convivencia, sin que llegue a la patología es deseable.
Varias poblaciones grandes y diversas de bacterias, virus y hongos ocupan cada superficie del cuerpo humano.1
Se estima que existen casi 30 trillones de células bacterianas viviendo dentro de cada humano.2¡
Eso equivale a una bacteria por célula humana!2
Estos microbios se conocen colectivamente como el microbioma.31
El contacto con los microbios ocurre por primera vez durante el nacimiento. Algunos factores ambientales, como la dieta y los antibióticos afectan el microbioma de un humano.31
Las diferencias en el ambiente, la dieta y el comportamiento de cada individuo, marcan las distinciones entre los microbiomas de cada persona.1
Se presume que el microbioma de cada persona es único.4
Partiendo de esta hipótesis, se han desarrollado varias investigaciones que buscan una manera de utilizar el microbioma como una herramienta de identificación, semejante a las huellas digitales.
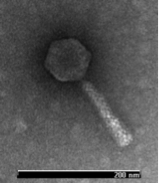
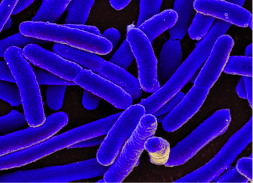
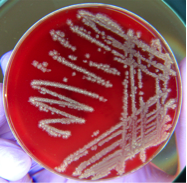

De derecha a izquierda: Una micrografía electrónica de transmisión de un virus de bacteria (bacteriófago), una micrografía electrónica de barrido de la bacteria E. coli, una bacteria genérica (blanca) creciendo en una placa de agar, y unos hongos comestibles silvestres.
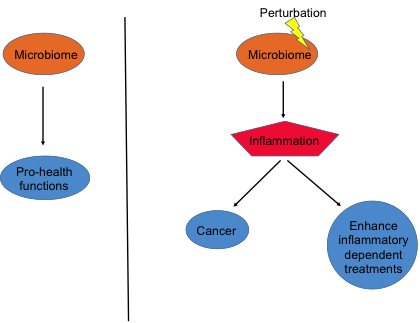
Los millones de organismos que componen el microbioma humano desempeñan un rol importante en la salud y en la enfermedad humana.
Cada tipo de microbio ocupa un lugar específico dentro del cuerpo brindando apoyo a las funciones de los órganos respectivos; por ejemplo, las bacterias que viven en los intestinos ayudan a la digestión.31 Aunque los microbios tienen un rol importante en el mantenimiento de una buena salud, también se los ve involucrados en el desarrollo y en el progreso de algunos cánceres. Por otro lado, existe una gran cantidad de evidencia que indica que el microbioma puede alterar las reacciones a los tratamientos de cáncer.
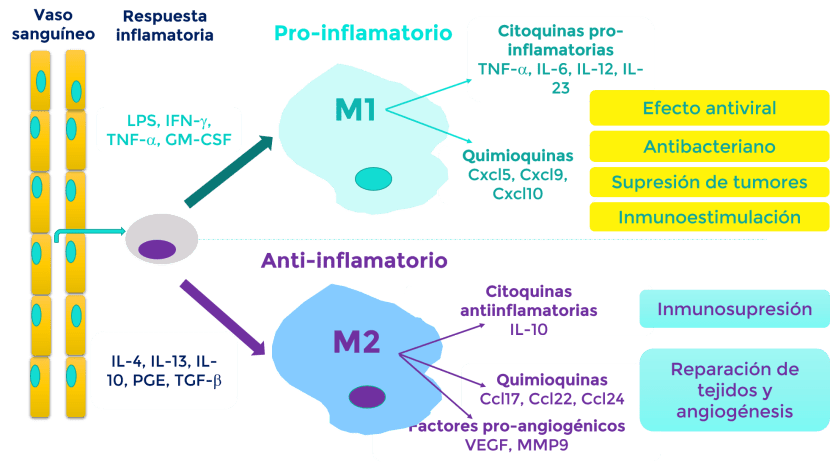
Los microbios interactúan con la salud, la enfermedad y la respuesta a los tratamientos. Asimismo, algunos tratamientos de cáncer utilizan la inflamación que a veces pueden realzar la eficacia de los tratamientos.
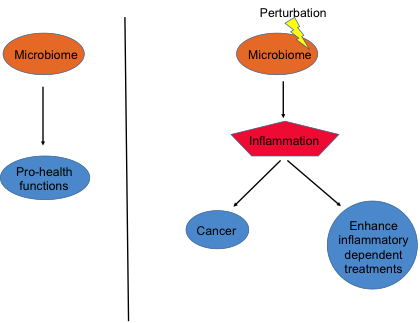
Sin embargo, cuando se presentan las alteraciones en el microbioma, las consecuencias pueden ser bastante negativas para la salud. Por ejemplo, las interferencias en las bacterias en los intestinos se asocian con las siguientes enfermedades:
Enfermedad del intestino inflamatorio
Síndrome del intestino irritable
Obesidad
Diabetes tipo 23
Además de la digestión, los microbios también participan en algunos procesos inmunológicos, en el metabolismo y en la reproducción.3
El microbioma y el cáncer
Existe una relación entre el microbioma humano y el desarrollo de cáncer. Inicialmente, los estudios epidemiólogos (estudios de poblaciones) indicaron que ciertos microbios tenían un rol en cáncer.
Cáncer estomacal
La relación entre la Helicobacter pylori (H. pylori), una bacteria con forma de espiral, y el desarrollo del cáncer brinda bastante información acerca de los microbios y el cáncer. Las infecciones por la H. pylori son comunes; los Centros para el control y la prevención de enfermedades (CDC) estima que dos tercios de la población de la población mundial soporta esta bacteria. Estas infecciones se contraen mediante la comida contaminada o el contacto de boca a boca.5
Una vez adentro de su anfitrión, la H. pylori penetra la capa mucosa que forra el estómago,5 una región protegida que dificulta la remoción de la bacteria por parte del sistema inmune.5Las infecciones por H. pylori no causan enfermedades en la mayoría de individuos; sin embargo, es un riesgo para aquellos individuos que sufren de úlceras o del cáncer estomacal.5 Algunos estudios poblacionales han demostrado que los individuos infectados con H. pylori tienen un riesgo de desarrollar un cáncer estomacal 8 veces mayor en comparación aquellos sin la bacteria.5El mecanismo exacto por el cual la H. pylori eleva el riesgo de desarrollar un cáncer aun no se define por completo.5 Sin embargo, existen evidencias que indican que la inflamación crónica causada por una infección por H. pylori promueve el desarrollo de cáncer.5 El CDC recomienda realizarse pruebas para detectar la presencia de la H. pylori aparte del tratamiento respectivo en el caso de una infección posterior a la cura de un cáncer gástricos para evitar la recurrencia de la enfermedad. Se recomienda lo mismo para aquellos individuos que han tenido de úlceras.5
Cáncer de seno
En el 2016, un grupo de investigadores halló a varias poblaciones de microbios en un tejido de seno.6 Los efectos de la presencia del microbioma en el tejido mamario aún no se conocen a detalle.7 No obstante, en numerosos estudios, la presencia de distintas poblaciones bacterianas se detectó en tejidos mamarios afectados por enfermedades benignas y malignas (cancerosas).67
Aun no se define si los microbiomas en el seno contribuyen al desarrollo de tumores, o si son un resultado de la enfermedad. En los laboratorios, se han desarrollado algunas hipótesis que indican una posible asociación entre ciertos tipos de bacterias con el crecimiento de tumores.67 A un grupo de ratones de laboratorio que padecían de una predisposición a desarrollar el cáncer se los infectó con Helicobacter hepaticus (H. hepaticus).6Los resultados indicaron que los ratones infectados tenían desarrollaron más tumores en las glándulas mamarias y sufrieron de más inflamación en comparación con los ratones no infectados.6Estos resultados sugieren que la H. hepaticus contribuye a la progresión de cáncer al provocar la inflamación de dichos tejidos.
Cáncer de piel
El microbioma de la piel es diverso y cambia según su ubicación en el cuerpo.7 Varios experimentos realizados con ratones de laboratorio han hallado que el microbioma puede desempeñar papeles protectores o perjudiciales en relación al desarrollo del cáncer.78 El grupo de ratones que recibieron antibióticos (para matar su microbioma) se vieron expuestos a un riesgo aumentado de desarrollar un melanoma y a una supervivencia reducida.78Estos resultados revelan que el microbioma puede proteger en contra del desarrollo de este tipo de cáncer. Por otro lado, también hay evidencia que demuestra que las «colas» (flagelos) de algunas bacterias promueven la inflamación crónica, lo cual ocasiona daños en los tejidos y como resultado, el cáncer de piel.8Los resultados de otra investigación, en la cual los roedores modelo pasaron por modificaciones genéticas que bloqueaban las reacciones a los los flagelos bacterianos,8indican que estos ratones estaban protegidos en contra de un cáncer artificial, implicando que la respuesta inflamatoria a la bacteria puede llevar al desarrollo de cáncer.8
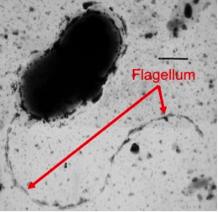
Una micrografía electrónica de transmisión de una bacteria con flagelo.
Cáncer colorrectal
El microbioma bucal de un individuo saludablescomúnmente contiene la bacteria Fusobacterium nucleatum (F. nucleatum).9 Sin embargo, varios estudios han detectado la presencia de la F. nucleatum en adenomas colorrectales y en crecimientos tumorígenos del cáncer colorrectal en sus etapas avanzadas.9Recientemente, se descubrió que la F. nucleatum puede ser la causa de las reacciones inflamatorias que activan a aquellos genes que promueven el cáncer.9 La activación de estos genes causa un incremento en la proliferación de las células del cáncer colorrectal.9
Cáncer cervical, anal y oral
Aproximadamente, el 15% de todos los cánceres humanos se pueden atribuir a un virus.10El virus del papiloma humano (VPH/HPV) es responsable por casi todos los casos de cánceres anales y cervicales.10Estos virus también pueden ser la causa de algunos cánceres de boca y cuello.10Interesantemente, en muchos individuos saludables, los virus del papiloma humano son un componente común de los microbiomas de la piel y la mucosa.11Este tipo de virus también están asociado con el cáncer de hígado y con el cáncer de piel. Haga clic en este enlace para aprender más acerca de los virus y su relación con el cáncer.
El microbioma y el tratamiento del cáncer
La inclusión del microbioma humano dentro de la investigación acerca de los tratamientos de cáncer es relativamente reciente. Los estudios más nuevos han destacado la importancia y la relevancia del uso de los microbios en la recuperación de la enfermedad.127Interesantemente, el microbioma también puede estimular la actividad inmunológica en contra del cáncer.13Por ejemplo, se halló que la ciclofosfamida (un medicamento para tratar la leucemia y algunos linfomas) altera el ambiente microbiano de los intestinos. Como resultado, se promovió la producción de células inmunes, aumentando la eficacia de ciclofosfamida.14Para reiterar, los microbios también pueden estimular las reacciones inflamatorias que causan el cáncer. No obstante, estas reacciones inflamatorias también pueden traer beneficios y realzar la eficacia de los tratamientos contra el cáncer. Algunas terapias, como la quimioterapia de platino y la inmunoterapia CpG-oligonucleótido funcionan mediante las reacciones inflamatorias.12Un estudio reveló que un grupo de ratones de laboratorio que recibió antibióticos (matan al microbioma intestinal) no respondió con tanta eficacia a la quimioterapia de platino ni a la inmunoterapia CpG-oligonucleótido en comparación con otro grupo de ratones que mantuvo intacto su microbioma.12Estos resultados sugieren que el microbioma intestinal complementa a los efectos de las terapias que dependen de la inflamación.12
Por otro lado, la resistencia a los tratamientos de cáncer se ha visto vinculado a la presencia de ciertos tipos de bacterias intestinales. Un grupo de expertos que investigaban la farmacorresistencia en pacientes de cáncer colorrectal detectaron una cantidad elevada en el intestino de la Fusobacterium nucleatum. Se reveló que este organismo simultáneamente prevenía la muerte celular (apoptosis) de las células cancerígenas y estimulaba la autofagia, un mecanismo de supervivencia que emplean las células de cáncer. 15
Esta claro es que los microbios desempeñan un rol muy importante en el desarrollo del cáncer y en la reacción corporal al tratamiento. Adicionalmente, los investigadores esperan poder identificar los aspectos beneficiosos del microbioma para poder aprovecharse del mismo como método de luchar contra el cáncer y para deshacerse de aquellos componentes microbianos que promueven el desarrollo de la enfermedad.7
Microbioma y ejercicio fisico
Existe una mayor presencia de bacterias antiinflamatorias y menor de proinflaflamatorias entre quienes realizan actividad física, abriendo la puerta a la prevención de enfermedades.
 Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Un estudio llevado a cabo por investigadores la Universidad de Oviedo ha permitido comprobar cómo la microbiota intestinal cambia en función de si se practica ejercicio físico o no y lo hace también dependiendo de la actividad física que se practique. Esta investigación abre una puerta para entender mejor como fomentar la presencia de bacterias intestinales beneficiosas.
Son las principales conclusiones de este trabajo, liderado por profesionales de las áreas de Microbiología, Anatomía y Fisiología de la Universidad de Oviedo, pertenecientes al grupo 3BIOACTIVE, y cuyos resultados han sido publicados en Frontiers in Physiology
Esta investigación ayuda a entender cómo la actividad física puede actuar sobre las bacterias del intestino, lo que podría aplicarse, en el futuro, en la prevención de enfermedades que pueden alterar estos microorganismos, esenciales para el mantenimiento de la salud, así como en la prescripción de ejercicio físico de forma individualizada teniendo en cuenta la microbiota.
Ha sido realizada con un modelo animal, en concreto ratones de laboratorio sanos sometidos a entrenamiento de fuerza o resistencia durante cuatro semanas. Los autores del estudio eligieron estos animales porque se parecen genéticamente mucho entre sí y viven en condiciones muy controladas, lo que permite aislar el efecto real de cada tipo de ejercicio, algo mucho más complejo en humanos.
Sin embargo, sus datos han servido para comprobar como la microbiota cambia en función de si se practica ejercicio físico o no, de tal modo que se observó una menor presencia de bacterias proinflamatorias, del género ‘Ruminococcus’, en los grupos que practicaron ejercicio frente a los ratones sedentarios.
También se observó una mayor abundancia de bacterias antiinflamatorias, del género ‘Parabacteroides’, en aquellos ratones sometidos a ejercicio físico, tanto en los que practicaron fuerza como en los que ejercitaron resistencia.
Este hallazgo confirma el efecto positivo del ejercicio físico en cuanto al incremento de la presencia de bacterias relacionadas con la respuesta inflamatoria, según explica uno de los supervisores del trabajo, Felipe Lombó, profesor de Microbiología del Departamento de Biología Funcional de la Universidad de Oviedo.
Asimismo, también han podido determinar que hay bacterias que específicamente aumentan su presencia en el intestino con el entrenamiento de la fuerza y otras que lo hacen con la práctica de la resistencia.
Por ejemplo, la especie ‘Clostridium cocleatum’ presenta una abundancia mayor en los ratones que entrenaron fuerza, una especie que se ha utilizado para la prevención de infección por ‘Clostridium difficile’ en modelos murinos de enfermedad.
En el caso del entrenamiento de resistencia, observaron mayor presencia del género ‘Desulfovibrio’, asociado a la protección de las células endoteliales en ratones envejecidos.
Aunque este estudio se ha realizado en ratones, el análisis de estos efectos de los diferentes tipos de entrenamiento puede abrir la puerta a entender mejor cómo podemos fomentar la presencia de bacterias intestinales beneficiosas, no solo en la salud, sino también en la enfermedad, destaca Benjamín Fernández, profesor de Anatomía del Departamento de Morfología y Biología Celular, experto en Medicina del Deporte de la citado universidad y también supervisor del estudio.
Cristina Tomás, profesora de Fisiología del Departamento de Biología Funcional, recuerda que la práctica de ejercicio físico regular se asocia históricamente a un menor riesgo de mortalidad y a una menor incidencia de patologías crónicas muy prevalentes en los humanos en países desarrollados.
Las alteraciones de la microbiota intestinal, en este contexto, cada vez cobran mayor importancia en el desarrollo de estas patologías tan prevalentes. «Sabíamos que el ejercicio y la microbiota intestinal tienen puntos en común de incidencia en patología y salud. Sin embargo, los mecanismos exactos a través de los cuales se define el efecto protector de las bacterias que pueblan nuestro intestino era más desconocido y nuestro estudio ayuda a entenderlo un poco más», destaca la investigadora.
Esta experta subraya que, en humanos, se ha descrito que el ejercicio regular, principalmente el ejercicio de resistencia o aeróbico, modifica la diversidad y abundancia de las bacterias del intestino. Estos cambios, independientes de la dieta, suelen revertir una vez que cesa la práctica regular de la actividad física.
«El problema reside en que los datos que obtenemos con humanos pueden verse influidos por factores ambientales como la dieta, el alcohol, el consumo de drogas e incluso por características antropométricas, que también pueden modificar la microbiota intestinal. Sin embargo, los modelos animales, con sus limitaciones, nos ofrecen una mejor comprensión de los cambios en la microbiota inducidos por el ejercicio, porque podemos controlar mejor el resto de variables», añade.
Para realizar el estudio, los investigadores de la Universidad de Oviedo utilizaron 26 ratones sanos, divididos en tres grupos: ratones sedentarios, ratones sometidos a entrenamiento de resistencia en una cinta rodante y ratones sujetos a entrenamiento de fuerza en una escalera vertical.
Después de un periodo de adaptación, se entrenó a los ratones durante cuatro semanas, cinco días a la semana. Los investigadores extrajeron el ADN bacteriano a partir de muestras del ciego de estos ratones, una región del intestino en la que residen las bacterias de estos animales. El análisis de este ADN permitió clasificar las diferentes bacterias presentes en las muestras y conocer el porcentaje de cada uno de los taxones bacterianos.
«Conocer cómo la actividad física puede actuar sobre nuestras bacterias intestinales puede facilitar la prevención de muchas enfermedades en las que se ha observado alteraciones en la microbiota intestinal, desde el síndrome del intestino irritable hasta la enfermedad de Alzheimer, incluso ayudar en la búsqueda de tratamientos para cuando la enfermedad ya esté presente”, destaca Tomás.
La extrapolación de los datos de ratones a humanos debe considerarse con precaución, más aún porque las diferencias en la composición de la microbiota intestinal entre humanos y ratones puede llevar a resultados sesgados.
En biología, todo esta relacionado con toda y de ello depende la enfermedad o la salud.
Estudiar las proporciones es vital , pero su imbricación lo hace difícil.
Bibliografia.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo. Foto: Covadonga Díaz.
1.a. b. c. d. e. Ursell LK, Metcalf JL, Parfrey LW, Knight R. Defining the Human Microbiome. Nutrition reviews. 2012 Aug; 70(Suppl 1): S38-S44. [PUBMED]
2.a. b. Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016 Aug 19;14(8):e1002533. [PUBMED]
3.a. b. c. d. e. Cho I, Blaser MJ. The Human Microbiome: at the interface of health and disease. Nature reviews. Genetics. 2012 Mar 13; 13(4): 260-270. [PUBMED]
4.Franzosa EA, Huang K, Meadow JF, Gevers D, Lemon KP, Bohannan BJ, Huttenhower C. Identifying personal microbiomes using metagenomic codes. Proc Natl Acad Sci U S A. 2015 Jun 2;112(22):E2930-8. [PUBMED]
5.a. b. c. d. e. f. g. h. Helicobacter pylori and Cancer. National Cancer Institute. [https://www.cancer.gov/about-cancer/causes-prevention/risk/infectious-agents/h-pylori-fact-sheet]
6.a. b. c. d. e. Hieken TJ, Chen J, Hoskin TL, Walther-Antonio M, Johnson S, Ramaker S, Xiao J, Radisky DC, Knutson KL, Kalari KR, Yao JZ, Baddour LM, Chia N, Degnim AC. The Microbiome of Aseptically Collected Human Breast Tissue in Benign and Malignant Disease.Scientific Reports. 2016 Aug 3; 6: 30751. [PUBMED]
7.a. b. c. d. e. f. g. h. Pevsner-Fischer M, Tuganbaev T, Meijer M, Zhang SH, Zeng ZR, Chen MH, Elinav E. Role of the microbiome in non-gastrointestinal cancers. World Journal of Clinical Oncology. 2016 Apr 10; 7(2): 200-213. [PUBMED]
8.a. b. c. d. e. Pfirschke C, Garris C, Pittet MJ. Common TLR5 mutations control cancer progression. Cancer Cell. 2015 Jan 12;27(1):1-3. [PUBMED]
9.a. b. c. d. Rubinstein MR, Wang X, Liu W, Hao Y, Cai G, Han YW. Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesin. Cell host & microbe. 2013 Aug 14; 14(2): 195-206. [PUBMED]
10.a. b. c. McLaughlin-Drubin ME, Munger K. Viruses Associated with Human Cancer. Biochimica et biophysica acta. 2007 Dec 23; 1782(3): 127-150 [PUBMED]
11.Antonsson A, Forslund O, Ekberg H, Sterner G, Hansson BG. The Ubiquity and Impressive Genomic Diversity of Human Skin Papillomaviruses Suggest a Commensalic Nature of These Viruses.Journal of Virology. 2000 Dec; 74(24): 11636-11641[PUBMED]
12.a. b. c. d. Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, Molina DA, Salcedo R, Back T, Cramer S, Dai RM, Kiu H, Cardone M, Naik S, Patri AK, Wang E, Marincola FM, Frank KM, Belkaid Y, Trinchieri G, Goldszmid RS. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science. 2013 Nov 22;342(6161):967-70. [PUBMED]
13.Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ, Schlitzer A, Ginhoux F, Apetoh L, Chachaty E, Woerther PL, Eberl G, Bérard M, Ecobichon C, Clermont D, Bizet C, Gaboriau-Routhiau V, Cerf-Bensussan N, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013 Nov 22;342(6161):971-6. [PUBMED]
14.Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ, Schlitzer A, Ginhoux F, Apetoh L, Chachaty E, Woerther PL, Eberl G, Bérard M, Ecobichon C, Clermont D, Bizet C, Gaboriau-Routhiau V, Cerf-Bensussan N, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013 Nov 22;342(6161):971-6. [PUBMED]
15.Yu T1, Guo F, Yu Y, Sun T, Ma D, Han J, Qian Y, Kryczek I, Sun D, Nagarsheth N, Chen Y, Chen H, Hong J, Zou W, Fang JY. Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy. Cell. 2017 Jul 27;170(3):548-563.e16. doi: 10.1016/j.cell.2017.07.008.[PUBMED]
LA MICROBIOTA INTESTINAL EN LA SALUD Y ENFERMEDAD
No hay dudas de la relación que existe entre microbioma intestinal y salud, pero también la relación con la enfermedad
Aunque esta relación es compleja. Existen datos evidentes de la relación y por consiguiente el estudio de como equilibrar esta convivencia, sin que llegue a la patología es deseable.
Varias poblaciones grandes y diversas de bacterias, virus y hongos ocupan cada superficie del cuerpo humano.1
Se estima que existen casi 30 trillones de células bacterianas viviendo dentro de cada humano.2¡
Eso equivale a una bacteria por célula humana!2
Estos microbios se conocen colectivamente como el microbioma.31
El contacto con los microbios ocurre por primera vez durante el nacimiento. Algunos factores ambientales, como la dieta y los antibióticos afectan el microbioma de un humano.31
Las diferencias en el ambiente, la dieta y el comportamiento de cada individuo, marcan las distinciones entre los microbiomas de cada persona.1
Se presume que el microbioma de cada persona es único.4
Partiendo de esta hipótesis, se han desarrollado varias investigaciones que buscan una manera de utilizar el microbioma como una herramienta de identificación, semejante a las huellas digitales.
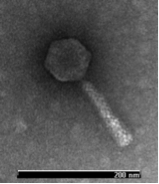
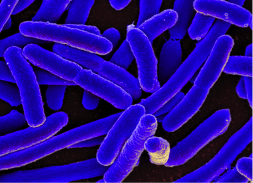
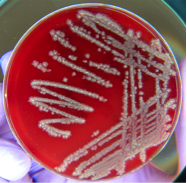

De derecha a izquierda: Una micrografía electrónica de transmisión de un virus de bacteria (bacteriófago), una micrografía electrónica de barrido de la bacteria E. coli, una bacteria genérica (blanca) creciendo en una placa de agar, y unos hongos comestibles silvestres.
Los millones de organismos que componen el microbioma humano desempeñan un rol importante en la salud y en la enfermedad humana.
Cada tipo de microbio ocupa un lugar específico dentro del cuerpo brindando apoyo a las funciones de los órganos respectivos; por ejemplo, las bacterias que viven en los intestinos ayudan a la digestión.31 Aunque los microbios tienen un rol importante en el mantenimiento de una buena salud, también se los ve involucrados en el desarrollo y en el progreso de algunos cánceres. Por otro lado, existe una gran cantidad de evidencia que indica que el microbioma puede alterar las reacciones a los tratamientos de cáncer.
Los microbios interactúan con la salud, la enfermedad y la respuesta a los tratamientos. Asimismo, algunos tratamientos de cáncer utilizan la inflamación que a veces pueden realzar la eficacia de los tratamientos.
Sin embargo, cuando se presentan las alteraciones en el microbioma, las consecuencias pueden ser bastante negativas para la salud. Por ejemplo, las interferencias en las bacterias en los intestinos se asocian con las siguientes enfermedades:
Enfermedad del intestino inflamatorio
Síndrome del intestino irritable
Obesidad
Diabetes tipo 23
Además de la digestión, los microbios también participan en algunos procesos inmunológicos, en el metabolismo y en la reproducción.3
El microbioma y el cáncer
Existe una relación entre el microbioma humano y el desarrollo de cáncer. Inicialmente, los estudios epidemiólogos (estudios de poblaciones) indicaron que ciertos microbios tenían un rol en cáncer.
Cáncer estomacal
La relación entre la Helicobacter pylori (H. pylori), una bacteria con forma de espiral, y el desarrollo del cáncer brinda bastante información acerca de los microbios y el cáncer. Las infecciones por la H. pylori son comunes; los Centros para el control y la prevención de enfermedades (CDC) estima que dos tercios de la población de la población mundial soporta esta bacteria. Estas infecciones se contraen mediante la comida contaminada o el contacto de boca a boca.5
Una vez adentro de su anfitrión, la H. pylori penetra la capa mucosa que forra el estómago,5 una región protegida que dificulta la remoción de la bacteria por parte del sistema inmune.5Las infecciones por H. pylori no causan enfermedades en la mayoría de individuos; sin embargo, es un riesgo para aquellos individuos que sufren de úlceras o del cáncer estomacal.5 Algunos estudios poblacionales han demostrado que los individuos infectados con H. pylori tienen un riesgo de desarrollar un cáncer estomacal 8 veces mayor en comparación aquellos sin la bacteria.5El mecanismo exacto por el cual la H. pylori eleva el riesgo de desarrollar un cáncer aun no se define por completo.5 Sin embargo, existen evidencias que indican que la inflamación crónica causada por una infección por H. pylori promueve el desarrollo de cáncer.5 El CDC recomienda realizarse pruebas para detectar la presencia de la H. pylori aparte del tratamiento respectivo en el caso de una infección posterior a la cura de un cáncer gástricos para evitar la recurrencia de la enfermedad. Se recomienda lo mismo para aquellos individuos que han tenido de úlceras.5
Cáncer de seno
En el 2016, un grupo de investigadores halló a varias poblaciones de microbios en un tejido de seno.6 Los efectos de la presencia del microbioma en el tejido mamario aún no se conocen a detalle.7 No obstante, en numerosos estudios, la presencia de distintas poblaciones bacterianas se detectó en tejidos mamarios afectados por enfermedades benignas y malignas (cancerosas).67
Aun no se define si los microbiomas en el seno contribuyen al desarrollo de tumores, o si son un resultado de la enfermedad. En los laboratorios, se han desarrollado algunas hipótesis que indican una posible asociación entre ciertos tipos de bacterias con el crecimiento de tumores.67 A un grupo de ratones de laboratorio que padecían de una predisposición a desarrollar el cáncer se los infectó con Helicobacter hepaticus (H. hepaticus).6Los resultados indicaron que los ratones infectados tenían desarrollaron más tumores en las glándulas mamarias y sufrieron de más inflamación en comparación con los ratones no infectados.6Estos resultados sugieren que la H. hepaticus contribuye a la progresión de cáncer al provocar la inflamación de dichos tejidos.
Cáncer de piel
El microbioma de la piel es diverso y cambia según su ubicación en el cuerpo.7 Varios experimentos realizados con ratones de laboratorio han hallado que el microbioma puede desempeñar papeles protectores o perjudiciales en relación al desarrollo del cáncer.78 El grupo de ratones que recibieron antibióticos (para matar su microbioma) se vieron expuestos a un riesgo aumentado de desarrollar un melanoma y a una supervivencia reducida.78Estos resultados revelan que el microbioma puede proteger en contra del desarrollo de este tipo de cáncer. Por otro lado, también hay evidencia que demuestra que las «colas» (flagelos) de algunas bacterias promueven la inflamación crónica, lo cual ocasiona daños en los tejidos y como resultado, el cáncer de piel.8Los resultados de otra investigación, en la cual los roedores modelo pasaron por modificaciones genéticas que bloqueaban las reacciones a los los flagelos bacterianos,8indican que estos ratones estaban protegidos en contra de un cáncer artificial, implicando que la respuesta inflamatoria a la bacteria puede llevar al desarrollo de cáncer.8
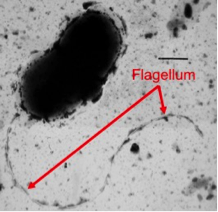
Una micrografía electrónica de transmisión de una bacteria con flagelo.
Cáncer colorrectal
El microbioma bucal de un individuo saludablescomúnmente contiene la bacteria Fusobacterium nucleatum (F. nucleatum).9 Sin embargo, varios estudios han detectado la presencia de la F. nucleatum en adenomas colorrectales y en crecimientos tumorígenos del cáncer colorrectal en sus etapas avanzadas.9Recientemente, se descubrió que la F. nucleatum puede ser la causa de las reacciones inflamatorias que activan a aquellos genes que promueven el cáncer.9 La activación de estos genes causa un incremento en la proliferación de las células del cáncer colorrectal.9
Cáncer cervical, anal y oral
Aproximadamente, el 15% de todos los cánceres humanos se pueden atribuir a un virus.10El virus del papiloma humano (VPH/HPV) es responsable por casi todos los casos de cánceres anales y cervicales.10Estos virus también pueden ser la causa de algunos cánceres de boca y cuello.10Interesantemente, en muchos individuos saludables, los virus del papiloma humano son un componente común de los microbiomas de la piel y la mucosa.11Este tipo de virus también están asociado con el cáncer de hígado y con el cáncer de piel. Haga clic en este enlace para aprender más acerca de los virus y su relación con el cáncer.
El microbioma y el tratamiento del cáncer
La inclusión del microbioma humano dentro de la investigación acerca de los tratamientos de cáncer es relativamente reciente. Los estudios más nuevos han destacado la importancia y la relevancia del uso de los microbios en la recuperación de la enfermedad.127Interesantemente, el microbioma también puede estimular la actividad inmunológica en contra del cáncer.13Por ejemplo, se halló que la ciclofosfamida (un medicamento para tratar la leucemia y algunos linfomas) altera el ambiente microbiano de los intestinos. Como resultado, se promovió la producción de células inmunes, aumentando la eficacia de ciclofosfamida.14Para reiterar, los microbios también pueden estimular las reacciones inflamatorias que causan el cáncer. No obstante, estas reacciones inflamatorias también pueden traer beneficios y realzar la eficacia de los tratamientos contra el cáncer. Algunas terapias, como la quimioterapia de platino y la inmunoterapia CpG-oligonucleótido funcionan mediante las reacciones inflamatorias.12Un estudio reveló que un grupo de ratones de laboratorio que recibió antibióticos (matan al microbioma intestinal) no respondió con tanta eficacia a la quimioterapia de platino ni a la inmunoterapia CpG-oligonucleótido en comparación con otro grupo de ratones que mantuvo intacto su microbioma.12Estos resultados sugieren que el microbioma intestinal complementa a los efectos de las terapias que dependen de la inflamación.12
Por otro lado, la resistencia a los tratamientos de cáncer se ha visto vinculado a la presencia de ciertos tipos de bacterias intestinales. Un grupo de expertos que investigaban la farmacorresistencia en pacientes de cáncer colorrectal detectaron una cantidad elevada en el intestino de la Fusobacterium nucleatum. Se reveló que este organismo simultáneamente prevenía la muerte celular (apoptosis) de las células cancerígenas y estimulaba la autofagia, un mecanismo de supervivencia que emplean las células de cáncer. 15
Esta claro es que los microbios desempeñan un rol muy importante en el desarrollo del cáncer y en la reacción corporal al tratamiento. Adicionalmente, los investigadores esperan poder identificar los aspectos beneficiosos del microbioma para poder aprovecharse del mismo como método de luchar contra el cáncer y para deshacerse de aquellos componentes microbianos que promueven el desarrollo de la enfermedad.7
Microbioma y ejercicio fisico
Existe una mayor presencia de bacterias antiinflamatorias y menor de proinflaflamatorias entre quienes realizan actividad física, abriendo la puerta a la prevención de enfermedades.
 Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Un estudio llevado a cabo por investigadores la Universidad de Oviedo ha permitido comprobar cómo la microbiota intestinal cambia en función de si se practica ejercicio físico o no y lo hace también dependiendo de la actividad física que se practique. Esta investigación abre una puerta para entender mejor como fomentar la presencia de bacterias intestinales beneficiosas.
Son las principales conclusiones de este trabajo, liderado por profesionales de las áreas de Microbiología, Anatomía y Fisiología de la Universidad de Oviedo, pertenecientes al grupo 3BIOACTIVE, y cuyos resultados han sido publicados en Frontiers in Physiology
Esta investigación ayuda a entender cómo la actividad física puede actuar sobre las bacterias del intestino, lo que podría aplicarse, en el futuro, en la prevención de enfermedades que pueden alterar estos microorganismos, esenciales para el mantenimiento de la salud, así como en la prescripción de ejercicio físico de forma individualizada teniendo en cuenta la microbiota.
Ha sido realizada con un modelo animal, en concreto ratones de laboratorio sanos sometidos a entrenamiento de fuerza o resistencia durante cuatro semanas. Los autores del estudio eligieron estos animales porque se parecen genéticamente mucho entre sí y viven en condiciones muy controladas, lo que permite aislar el efecto real de cada tipo de ejercicio, algo mucho más complejo en humanos.
Sin embargo, sus datos han servido para comprobar como la microbiota cambia en función de si se practica ejercicio físico o no, de tal modo que se observó una menor presencia de bacterias proinflamatorias, del género ‘Ruminococcus’, en los grupos que practicaron ejercicio frente a los ratones sedentarios.
También se observó una mayor abundancia de bacterias antiinflamatorias, del género ‘Parabacteroides’, en aquellos ratones sometidos a ejercicio físico, tanto en los que practicaron fuerza como en los que ejercitaron resistencia.
Este hallazgo confirma el efecto positivo del ejercicio físico en cuanto al incremento de la presencia de bacterias relacionadas con la respuesta inflamatoria, según explica uno de los supervisores del trabajo, Felipe Lombó, profesor de Microbiología del Departamento de Biología Funcional de la Universidad de Oviedo.
Asimismo, también han podido determinar que hay bacterias que específicamente aumentan su presencia en el intestino con el entrenamiento de la fuerza y otras que lo hacen con la práctica de la resistencia.
Por ejemplo, la especie ‘Clostridium cocleatum’ presenta una abundancia mayor en los ratones que entrenaron fuerza, una especie que se ha utilizado para la prevención de infección por ‘Clostridium difficile’ en modelos murinos de enfermedad.
En el caso del entrenamiento de resistencia, observaron mayor presencia del género ‘Desulfovibrio’, asociado a la protección de las células endoteliales en ratones envejecidos.
Aunque este estudio se ha realizado en ratones, el análisis de estos efectos de los diferentes tipos de entrenamiento puede abrir la puerta a entender mejor cómo podemos fomentar la presencia de bacterias intestinales beneficiosas, no solo en la salud, sino también en la enfermedad, destaca Benjamín Fernández, profesor de Anatomía del Departamento de Morfología y Biología Celular, experto en Medicina del Deporte de la citado universidad y también supervisor del estudio.
Cristina Tomás, profesora de Fisiología del Departamento de Biología Funcional, recuerda que la práctica de ejercicio físico regular se asocia históricamente a un menor riesgo de mortalidad y a una menor incidencia de patologías crónicas muy prevalentes en los humanos en países desarrollados.
Las alteraciones de la microbiota intestinal, en este contexto, cada vez cobran mayor importancia en el desarrollo de estas patologías tan prevalentes. «Sabíamos que el ejercicio y la microbiota intestinal tienen puntos en común de incidencia en patología y salud. Sin embargo, los mecanismos exactos a través de los cuales se define el efecto protector de las bacterias que pueblan nuestro intestino era más desconocido y nuestro estudio ayuda a entenderlo un poco más», destaca la investigadora.
Esta experta subraya que, en humanos, se ha descrito que el ejercicio regular, principalmente el ejercicio de resistencia o aeróbico, modifica la diversidad y abundancia de las bacterias del intestino. Estos cambios, independientes de la dieta, suelen revertir una vez que cesa la práctica regular de la actividad física.
«El problema reside en que los datos que obtenemos con humanos pueden verse influidos por factores ambientales como la dieta, el alcohol, el consumo de drogas e incluso por características antropométricas, que también pueden modificar la microbiota intestinal. Sin embargo, los modelos animales, con sus limitaciones, nos ofrecen una mejor comprensión de los cambios en la microbiota inducidos por el ejercicio, porque podemos controlar mejor el resto de variables», añade.
Para realizar el estudio, los investigadores de la Universidad de Oviedo utilizaron 26 ratones sanos, divididos en tres grupos: ratones sedentarios, ratones sometidos a entrenamiento de resistencia en una cinta rodante y ratones sujetos a entrenamiento de fuerza en una escalera vertical.
Después de un periodo de adaptación, se entrenó a los ratones durante cuatro semanas, cinco días a la semana. Los investigadores extrajeron el ADN bacteriano a partir de muestras del ciego de estos ratones, una región del intestino en la que residen las bacterias de estos animales. El análisis de este ADN permitió clasificar las diferentes bacterias presentes en las muestras y conocer el porcentaje de cada uno de los taxones bacterianos.
«Conocer cómo la actividad física puede actuar sobre nuestras bacterias intestinales puede facilitar la prevención de muchas enfermedades en las que se ha observado alteraciones en la microbiota intestinal, desde el síndrome del intestino irritable hasta la enfermedad de Alzheimer, incluso ayudar en la búsqueda de tratamientos para cuando la enfermedad ya esté presente”, destaca Tomás.
La extrapolación de los datos de ratones a humanos debe considerarse con precaución, más aún porque las diferencias en la composición de la microbiota intestinal entre humanos y ratones puede llevar a resultados sesgados.
En biología, todo esta relacionado con toda y de ello depende la enfermedad o la salud.
Estudiar las proporciones es vital , pero su imbricación lo hace difícil.
Bibliografia.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo. Foto: Covadonga Díaz.
1.a. b. c. d. e. Ursell LK, Metcalf JL, Parfrey LW, Knight R. Defining the Human Microbiome. Nutrition reviews. 2012 Aug; 70(Suppl 1): S38-S44. [PUBMED]
2.a. b. Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016 Aug 19;14(8):e1002533. [PUBMED]
3.a. b. c. d. e. Cho I, Blaser MJ. The Human Microbiome: at the interface of health and disease. Nature reviews. Genetics. 2012 Mar 13; 13(4): 260-270. [PUBMED]
4.Franzosa EA, Huang K, Meadow JF, Gevers D, Lemon KP, Bohannan BJ, Huttenhower C. Identifying personal microbiomes using metagenomic codes. Proc Natl Acad Sci U S A. 2015 Jun 2;112(22):E2930-8. [PUBMED]
5.a. b. c. d. e. f. g. h. Helicobacter pylori and Cancer. National Cancer Institute. [https://www.cancer.gov/about-cancer/causes-prevention/risk/infectious-agents/h-pylori-fact-sheet]
6.a. b. c. d. e. Hieken TJ, Chen J, Hoskin TL, Walther-Antonio M, Johnson S, Ramaker S, Xiao J, Radisky DC, Knutson KL, Kalari KR, Yao JZ, Baddour LM, Chia N, Degnim AC. The Microbiome of Aseptically Collected Human Breast Tissue in Benign and Malignant Disease.Scientific Reports. 2016 Aug 3; 6: 30751. [PUBMED]
7.a. b. c. d. e. f. g. h. Pevsner-Fischer M, Tuganbaev T, Meijer M, Zhang SH, Zeng ZR, Chen MH, Elinav E. Role of the microbiome in non-gastrointestinal cancers. World Journal of Clinical Oncology. 2016 Apr 10; 7(2): 200-213. [PUBMED]
8.a. b. c. d. e. Pfirschke C, Garris C, Pittet MJ. Common TLR5 mutations control cancer progression. Cancer Cell. 2015 Jan 12;27(1):1-3. [PUBMED]
9.a. b. c. d. Rubinstein MR, Wang X, Liu W, Hao Y, Cai G, Han YW. Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesin. Cell host & microbe. 2013 Aug 14; 14(2): 195-206. [PUBMED]
10.a. b. c. McLaughlin-Drubin ME, Munger K. Viruses Associated with Human Cancer. Biochimica et biophysica acta. 2007 Dec 23; 1782(3): 127-150 [PUBMED]
11.Antonsson A, Forslund O, Ekberg H, Sterner G, Hansson BG. The Ubiquity and Impressive Genomic Diversity of Human Skin Papillomaviruses Suggest a Commensalic Nature of These Viruses.Journal of Virology. 2000 Dec; 74(24): 11636-11641[PUBMED]
12.a. b. c. d. Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, Molina DA, Salcedo R, Back T, Cramer S, Dai RM, Kiu H, Cardone M, Naik S, Patri AK, Wang E, Marincola FM, Frank KM, Belkaid Y, Trinchieri G, Goldszmid RS. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science. 2013 Nov 22;342(6161):967-70. [PUBMED]
13.Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ, Schlitzer A, Ginhoux F, Apetoh L, Chachaty E, Woerther PL, Eberl G, Bérard M, Ecobichon C, Clermont D, Bizet C, Gaboriau-Routhiau V, Cerf-Bensussan N, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013 Nov 22;342(6161):971-6. [PUBMED]
14.Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ, Schlitzer A, Ginhoux F, Apetoh L, Chachaty E, Woerther PL, Eberl G, Bérard M, Ecobichon C, Clermont D, Bizet C, Gaboriau-Routhiau V, Cerf-Bensussan N, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013 Nov 22;342(6161):971-6. [PUBMED]
15.Yu T1, Guo F, Yu Y, Sun T, Ma D, Han J, Qian Y, Kryczek I, Sun D, Nagarsheth N, Chen Y, Chen H, Hong J, Zou W, Fang JY. Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy. Cell. 2017 Jul 27;170(3):548-563.e16. doi: 10.1016/j.cell.2017.07.008.[PUBMED]
 Magnifica micrografía electrónica de barrido de células humanas (azul) infectadas con SARS-CoV-2 (rojo). Foto: CSIC.
Magnifica micrografía electrónica de barrido de células humanas (azul) infectadas con SARS-CoV-2 (rojo). Foto: CSIC.





 Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.





 Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.
Benjamín Fernández, Cristina Tomás y Manuel Fernández Sanjurjo, autores del estudio realizado en la Universidad de Oviedo.

 Recreación del virus SARS-CoV-2.Pixabay
Recreación del virus SARS-CoV-2.Pixabay