Microglía
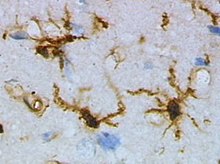
Células microglia, la primera y principal línea de defensa del sistema nervioso central.
Las microglías, microgliales o células de Hortega son células neurogliales del tejido nervioso con capacidad fagocitaria y de soporte, que forman el sistema inmunitario del sistema nervioso central (SNC)1 y que constituyen aproximadamente el 10% de las células del cerebro.2 Se originan durante el desarrollo a partir de precursores mesenquimales que, independientemente de la circulación sanguínea, penetran en el parénquima cerebral. Durante la vida adulta se ha propuesto que se pueden renovar por división in situ, a partir de precursores de la médula ósea, o desde monocitos que alcanzan el sistema nervioso a través de la sangre. Sin embargo, la producción de microglía a partir de precursores de la médula ósea o monocitos circulantes sólo se ha observado tras irradiar el sistema nervioso central.[cita requerida] Representan el sistema fagocítico mononuclear en el sistema nervioso central.
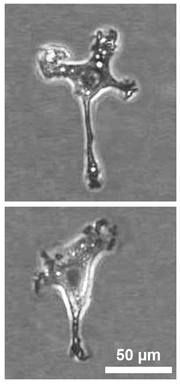
Dos células de microglia con Lamelipodios de aspecto «ameboide».
Se encuentran diseminadas en la totalidad del SNC, son células de pequeño tamaño, tinción oscura y asemejan débilmente oligodendrocitos. Tienen un citoplasma escaso, un núcleo oval o triangular y prolongaciones irregulares cortas. Estas células funcionan como fagocitos eliminando sustancias de desecho y estructuras dañadas del SNC. La microglia también defiende el sistema nervioso de virus, microorganismos y tumoraciones. Cuando por cualquier razón se activan, actúan como células presentadoras de antígenos y segregan citocinas. A diferencia del resto de células neurogliales, estas células no se originan del tubo neural, sino que tienen origen mesodérmico.
Las células de microglía cumplen funciones importantes no sólo relacionadas con la eliminación de residuos o la respuesta inmune. Por ejemplo, se sabe que juegan un papel importante durante el desarrollo en la inducción de muerte celular controlada en ciertas regiones. Además, también parecen tener un papel en la angiogénesis (generación de vasos sanguíneos). También existen estudios que demuestran que las células de microglía están implicadas en la eliminación de las terminales sinápticas.
El papel más ampliamente conocido de la microglía es el de vigilar el sistema nervioso central. Las células de microglía «no activas» están continuamente analizando su entorno con sus terminaciones, que son altamente dinámicas. Cuando se produce un daño en el sistema nervioso central las células de microglía reaccionan y se acercan a la lesión. También, «activadas» modifican su morfología (normalmente ramificada) y adquieren un aspecto ameboide, debido a la proyección de Lamelipodios.
Además, las células de microglía expresan moléculas proinflamatorias que tienen por objetivo eliminar células dañadas o infectadas y a agentes patógenos que pudieran ser perjudiciales. Sin embargo, estas moléculas también pueden dañar a neuronas sanas. Por otro lado, las células de microglía son capaces de producir moléculas antiinflamatorias que consiguen frenar el proceso inflamatorio y aumentar la supervivencia de las células viables.
Contienen lisosomas y cuerpos residuales. Generalmente se la clasifica como célula de la neuroglia. Presentan el antígeno común leucocítico y el antígeno de histocompatibilidad clase II, propio de las células presentadoras de antígenos. Además presentan receptores para moléculas señal propias del encéfalo, como el glutamato y el GABA
Historia[editar]
Victor Babeș describió la activación de la microglía en un caso de la rabia en 1897, pero no sabían lo que eran. Vieron los racimos de la microglía. Franz Nissl y F.Robertson fueron los primeros en descubrir las células de microglía, y Pío del Río Hortega, un discípulo de Santiago Ramón y Cajal, fue el primero en llamar a estas células «microglía», alrededor de 1920. Debido a esto también reciben el nombre de células de Hortega.
Las nuevas técnicas descubrieron alrededor de los años 1980 que las células de microglía están relacionadas con las de macroglía.
Microgliogénesis[editar]
Durante la hematopoyesis primitiva en ratones, esto es, en la etapa embrionaria y fetal, a partir del día 6.5 post-coito (pc), surgen, en el saco vitelino, células madre hematopoyéticas (CMH) que originarán células progenitoras de distintos linajes. Entre los días 7.5 – 8.0 pc, surgen células progenitoras eritromieloides (KIT+, Ter119+ y RUNX1+). A lo largo del día 9.0 pc estas células expresan CD45, pero no marcadores mieloides (estadio A1), más tarde expresan marcadores mieloides como los receptores de quimiocinas CX3C1 (CX3CR1) y del factor estimulante de colonia 1 (CSF1R), así como la glicoproteína F4/80 (estadio A2). Además, expresan metaloproteinasas (MMP-8 y MMP-9) lo que sugiere que, a partir de ese momento, empiezan a migrar hacia el mesénquima neuronal. Mientras tanto, estas continúan madurando y, aproximadamente, en el día 14.0 pc las células adquieren una morfología ramificada. Por otro lado, durante la hematopoyesis definitiva; es decir, una vez que la aorta gonadal-mesonefro (AGM) y el hígado fetal se han vuelto los principales órganos hematopoyéticos (durante los días 10.5 y 12.5 pc, respectivamente), se forman fagocitos-mononucleares que migran hacia el cerebro, sin embargo, estos son macrófagos distintos a la microglía y residen perivascularmente, en el plexo coroideo y en meninges.
Postnatalmente, los monocitos formados en la médula ósea de huesos largos, a partir de precursores leucocitarios, migran vascularmente y colonizan los tejidos [1, 2].
Véase también[editar]
Referencias[ Esteves, Madalena; Almeida, Armando; Leite-Almeida, Hugo (1 de enero de 2020). Salgado, Antonio J., ed. Handbook of Innovations in Central Nervous System Regenerative Medicine (en inglés). Elsevier. pp. 1-28. ISBN 978-0-12-818084-6. doi:10.1016/b978-0-12-818084-6.00001-5. Consultado el 21 de octubre de 2020.
Sousa, Carole; Biber, Knut; Michelucci, Alessandro (2017). «Cellular and Molecular Characterization of Microglia: A Unique Immune Cell Population». Frontiers in Immunology (en inglés) 8. ISSN 1664-3224. PMC 5332364. PMID 28303137. doi:10.3389/fimmu.2017.00198. Consultado el 21 de octubre de 2020.
Prinz, M. and Priller, J. (2014) Microglia and brain macrophages in the molecular age: from origin to neuropsychiatric disease. Nature. 15(5).
Saijo, K. and Glass, C. K. (2011) Microglial cell origin and phenotypes in health and disease. doi:10.1038/nri3086.
Texto y Atlas de Histología (tercera edición), Leslie P. Gartner, James L. Hia