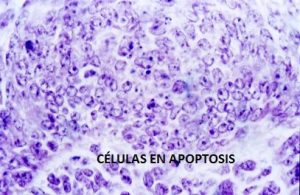
 Apoptosis
Apoptosis
El médico se pone en contacto con terminós biológicos, que maneja perfectamente y que los utiliza en la clínica de rutina, pero sin un claro conocimiento de su etimología. Estos términos traducidos del griego o latín y dada la enorme cantidad de palabras científicas que utilizamos, facilitan la confusión, motivo esto de grandes problemas. Para un futuro próximo hará falta un cambio importante , en la terminología científica. Mas concreto y universal.
La Apoptosis, de los términos más usados en medicina es la muerte celular programada procede del griego apóptōsis, que significa: apó «a partir de» + ptōsis «caída». También se la llama. «muerte celular apoptótica» y «muerte celular programada».5 es importante diferenciarlo de otros tipos de muerte celular, comola necrosis.
La apoptosis es una vía de destrucción o muerte celular programada y provocada por el mismo organismo, con el fin de controlar su desarrollo y crecimiento, puede ser de naturaleza fisiológica y está desencadenada por señales celulares controladas genéticamente. Hace posible la destrucción de las células dañadas, evitando replicación indiscriminada de una célula dañada.12
No es lo mismo la necrosis , que es un patrón morfológico que ocurre después de la muerte de un tejido en organismos vivos, que proporciona ventajas al conjunto del organismo durante su ciclo normal de vida.3
El Nobel del año 2002 fue concedido a Sydney Brenner (Gran Bretaña), H. Robert Horvitz (EUA) y John E. Sulston (GB) «por sus descubrimientos concernientes a la regulación genética del desarrollo de órganos y la muerte celular programada».4
La apoptosis puede ocurrir en múltiples ocasiones;, cuando una célula se halla dañada y no tiene posibilidades de ser reparada, o cuando ha sido infectada por un virus. La «decisión» de iniciar la apoptosis puede provenir de la célula misma, del tejido circundante o de una reacción proveniente del sistema inmunológico. La incapacidad de una célula dañada para realizar la apoptosis, puede inducir a esta célula a continuar dividiéndose sin mayor restricción, y convertirse en un tumor.
Ciertas células del sistema inmunitario, los linfocitos B y linfocitos T, pueden llegar a desarrollar propensión a atacar células de tejido sano del propio organismo al que pertenecen. Estas células autorreactivas son eliminadas mediante apoptosis. Por ejemplo, antes de ser liberados hacia el resto del organismo, los linfocitos T, una vez formados en la médula ósea, son sometidos a pruebas de reacciones autoinmunes dentro del timo, que es el órgano encargado de su maduración para evitar reacciones de autoinmunidad. De esta forma, alrededor del 95% de los linfocitos T recién creados —y que son los que han mostrado propensión a atacar tejido propio— son destruidos vía apoptosis.
La apoptosis es parte integral del desarrollo de los tejidos tanto de plantas (viridiplantae) como de animales pluricelulares (metazoa), y no provoca la respuesta inflamatoria característica de la necrosis .
La apoptosis de los tejidos productos de patógenos no dan el mismo patrón morfológico,. Las células dañadas no se hinchan y revienta en el espacio intercelular-: En las células en proceso de apoptosis, sus núcleos se encogen, y con frecuencia se fragmentan. De esta manera, pueden ser eficientemente englobadas y, sus componentes son reutilizados por macrófagos o por células del tejido adyacente.
Durante la apoptosis se consigue: La eliminación de células en exceso y la eliminación de células que representan un peligro para la integridad del organismo.
Son un ejemplo de la funcionalidad de la apoptosis ;
• La reabsorción de la cola de los renacuajos
• La eliminación de las membranas interdigitales en la formación de los dedos en el feto.
• Para llegar al estado adulto el nematodo el C.elegans tiene que perder por apoptosis 131 células
• La eliminación del endometrio al iniciarse la menstruación
• La formación de las sinapsis entre neuronas en cerebro requiere la eliminación por apoptosis de una serie de células.
De ahí la eliminación de una serie de células, depende la integridad del organismo:
• Células infectadas con virus, son destruidas por los linfocitos T citotóxicos.
• Células del sistema inmune. Después de la respuesta inmune, las células efectoras han de ser eliminadas para prevenir que ataquen a los constituyentes propios del organismo. Los linfocitos T citotóxicos inducen la apoptosis en cada una de las distintas células del sistema inmune e incluso en ellas mismas. Cualquier defecto en la maquinaria apoptótica de estas células inmunes, se encuentran asociados con enfermedades autoinmunes tales como el lupus eritematoso o la artritis reumatoide.
• Células con DNA lesionado. La lesión en su genoma hace que las células puedan llegar a desarrollar cáncer. Las células responden a la lesión al DNA incrementando la producción de p53, un poderoso inductor de la apoptosis. Las mutaciones en p53 producen una proteína defectuosa que a menudo se detecta en células cancerosas
• Células cancerosas. La radioterapia y la quimioterapia inducen la apoptosis en algunos tipos de cáncer.6
Las células que componen un órgano o tejido deben permanecer constante, dentro de ciertos límites. Las células de la sangre y de piel, por ejemplo, son constantemente renovadas por sus respectivas células progenitoras. Por lo tanto, esta proliferación de nuevas células tiene que ser compensada por la muerte de otras células. Esto forma parte de la homeostasis, o equilibrio de un organismo
Estos procesos de la apoptosis se activan de dos formas :
• una inducción negativa: como la pérdida de una actividad supresora, la falta de factores de crecimiento o la disminución de los contactos con las células que la rodean.
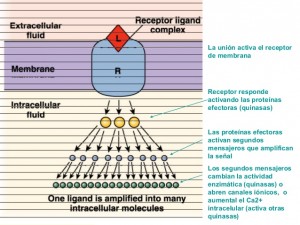
• una inducción positiva: como es el resultado de la unión de un ligando a un receptor o la recepción de señales conflictivas.7
Investigación científica indica que hay tres vías de apoptosis, el extrínseco, el intrínseco y el perforina/granzima.
La vía extrínseca de señalización es la encargada del inicio de apoptosis, se encuentra involucrada a interacciones mediadas por receptores transmembrales como los receptores de muerte caracterizados por presentar un dominio extracelular, rico en cisteína con dominios citoplásmicos de aproximadamente 80 aminoácidos, y un segundo dominio de localización citoplasmática conocido como el «dominio de la muerte» que es el responsable de la apoptosis. Su activación siempre conduce a la muerte de la célula, en estos encontramos a:
• receptores del factor de necrosis tumoral (TNF)- se conectan con complejos como el TRADD (TNFR-asociado al dominio de muerte) que actúa como una plataforma de adaptación para reclutar moléculas de señalización, como la proteína de interacción con el receptor, y activa factores de transcripción (NFk B y el JNK/AP-1). A diferencia de Fas, el receptor de TNF raramente activa procesos de apoptosis, a menos que la síntesis de proteínas se encuentre bloqueada, sugiriendo la existencia de factores celulares que suprimen los estímulos apoptóticos generados por el TNF. Los modelos FasL/FasR y TNF-α/TNFR1 mejor caracterizan los eventos de la vía extrínseca.8
• los receptores Fas- proteínas transmembranales que en la porción intracelular se enlaza con FADD (factor asociado al dominio de muerte) activando caspasas 8 y 10 (grupo de proteínas perteneciente al grupo de las cisteín-proteasas, caracterizadas por presentar un residuo de cisteína que media la ruptura de otras proteínas). En el modelo de FasL/FasR, la aglutinación del Fas ligando al receptor Fas causa la aglutinación de la proteína adaptador FADD. Después de esto, un complejo de muerte inducida señalización es formado y como resultado la procaspasa-8 se activa. Una vez que procaspasa-8 se activa, la fase de ejecución de apoptosis se inicia. Esta fase es considerada la vía final de apoptosis. Caspasas de ejecución activan endonucleasas citoplasmáticas que degradan material nuclear y proteasas que degradan proteínas nucleares y citoesqueletos. Caspasas-3, caspasas-6 y caspasas-7 funcionan como efector caspasas que henden varios sustratos que incluyen citoqueratinas, PARP, la membrana plasmática del citoesqueleto proteína alfa fodrin, la proteína nuclear NuMA y otros que causan los cambios en morfología y bioquímica en las células apoptóticas. Estos tipos de receptores y su ligando desempeñan un papel importante en modelos apoptóticos como son la supresión periférica de las células T maduras al final de una respuesta inmune, la muerte de células diana (células infectadas por virus), la destrucción de células cancerosas mediada por células T citotóxicas y por natural killer, así como la eliminación de las células inmunes reactivas a tumores que expresan constitutivamente el ligando de Fas.7
Apoptosis mediada por receptores de muerte se puede inhibir por la proteína c-FLIP lo cual se ata a FADD y la caspasa-8 causando ineficaces (Elmore 2007).
• receptores de glutamato, de trombina y canales iónicos dependientes de voltaje: desempeñan una función fisiológica, pero su sobreactivación puede conducir también a la muerte. los receptores del aminoácido neurotransmisor glutamato participan en más del 80% de las sinapsis excitadoras del SNC y se han relacionado con los procesos que rodean a la memoria y a la transmisión nerviosa. Sin embargo, su sobreestimulación puede desencadenar la muerte neuronal —excitotoxicidad— descrita en los procesos como isquemia/reperfusión, infarto, esclerosis lateral amiotrófica o enfermedad de Parkinson.7
La vía extrínseca que se induce extracelularmente, mientras que la vía intrínseca se induce intracelularmente. La vía intrínseca de la apoptosis puede ser desencadenada por daño en el ADN, grandes aumentos en la concentración de calcio citosólico910 o estrés celular, así como un aumento en la generación de especies reactivas de oxígeno en la mitocondria.11 Esto activa la expresión del gen supresor de tumores p53, que a continuación, activa las proteínas pro-apoptóticas. PUMA y NOXA se expresan por el gen p53 y codifican para los dos miembros de la familia Bcl2 que gobiernan la permeabilización de la membrana mitocondrial externa, Bax y Bak. La expresión de estas proteínas provoca una translocación de la mitocondria, reduciendo la su membrana que resulta en la liberación de citocromo C y Apaf-1. Una vez que el citocromo C se une a Apaf-1 y procaspasa-9, se forma un apoptosoma. Este apoptosoma a continuación, activa la caspasa-9. Una vez que la caspasa-9 se activa, la mayor activación de otras caspasas, como las caspasas-3 y -7 permiten la digestión de los objetivos esenciales que afectan a la viabilidad celular.12
La activación de los segundos mensajeros (p 53 y Bcl2) suele conducir a la disfunción de las organelas citoplasmáticas, como la mitocondria y el retículo endoplásmico, o la regulación de la actividad de complejos enzimáticos como cinasas y fosfatasas que a su vez regulan la función de otras proteínas.7
Durante el procesamiento normal de señales tienen lugar aumentos transitorios de la [Ca2+] i . Sin embargo, incrementos aberrantes pueden producir daño celular y en algunos casos su muerte. En estos procesos el calcio puede activar enzimas como proteasas y lipasas, induciendo la producción de radicales libres, además de regular y potenciar la expresión génica al modular la actividad de factores de trasncripción. En condiciones fisiológicas, las células presentan un equilibrio entre la generación de radicales libres y los sistemas antioxidantes de defensa. En algunos procesos de muerte celular se ha descrito la ruptura de este equilibrio, observándose un aumento en la oxidación de proteí-nas con la formación de grupos carbonilo y peroxidación lipídica, habiéndose demostrado la existencia de una localización compartimentada de derivados carbonílicos libres a partir de lípidos, proteínas, hidratos de carbono y ácidos nucleicos (2,4- dinitrofenilhidracina).7
La translocación de la ceramida a la mitocondria provoca cambios iónicos entre la matriz mitocondrial y el citoplasma, produciendo un descenso del potencial transmembranal y la formación del poro de permeabilidad transitoria mitocondrial, conduciendo a la apoptosis. Los valores de ceramida pueden ser aumentados tanto por factores externos (radiación UV, agentes oxidantes), como a través de receptores de membrana (FasR y TNFR) o directamente por glucocorticoides.7
El aumento en los valores p53 conduce a la inducción en la transcripción de otros genes como p21/WAF1/Cip1, un inhibidor de proteínas cinasas reguladas por ciclinas, inhibiendo la entrada en fase S del ciclo celular. Como resultado la célula se detiene en la fase G1, la cual provee de una barrera cinética en la replicación de un genoma potencialmente dañado. Si la célula no puede reparar el daño genético, p53 induce la muerte celular por un mecanismo que se postula que puede estar mediado por aumentos en la síntesis de Bax, una proteína de la familia de Bcl-2 con propiedades proapoptóticas. un mal funcionamiento del gen p53 puede promover el desarrollo de tumores debido a la proliferación de células con una reparación del ADN de forma incompleta.7
Una vez que la célula recibe una señal de muerte, debe decidir si debe sobrevivir o desencadenar los procesos de muerte. En esta fase de decisión se ha situado a la mitocondria como organelo fundamental. Como uno de los acontecimientos principales se altera la permeabilidad de las membranas mitocondriales a causa de la formación de un complejo multiproteico que conduce a la liberación del contenido intramitocondrial como el citocromo C, el factor inductor de apoptosis y miembros de la familia de caspasas. otros acontecimientos desencadenados en la membrana son la alteración de la cadena transportadora de electrones, la perdida de potencial electroquímico y cambios en el ciclo metabólico de óxido/reducción.7
Cuando la célula va a morir, una serie de procesos bioquímicos que conducen a la degradación de proteínas y de la cromatina, se producen en su interior. Y de ello se encargan las proteasas implicadas en la muerte celular; las caspasas, las calpaínas, la granzima B y el complejo multiproteico denominado proteosoma.7
La activación de las caspasas se debe a estímulos tanto extracelulares como intracelulares. Estas hidrolizan secuencias específicas de tetrapéptidos que contienen un residuo aspartato. Entre sus sustratos se encuentran: elementos del citoesqueleto (actina, fodrina, proteína Tau y catenina), enzimas encargadas de reparar (PARP) o degradar (ADNasa) el ADN celular, factores de transcripción (retinoblastoma, HDM2), proteínas reguladoras (proteína cinasa C, fosfatasas 2A, cinasas de adhesión focal), así como miembros de la familia del oncogén Bcl-2 (Bid). Las calpaínas son cisteína proteasas que requieren Ca2+ para su traslocación hasta la membrana citoplasmática, rápida autólisis y activación. Entre sus sustratos se encuentran también factores de transcripción, oncogenes, proteínas de membrana y del citoesqueleto. Estas están sobreactivadas durante procesos excitotóxicos e isquémicos y en patologías como la enfermedad de Alzheimer.7
Referencias
Manual de Patología General. Daño celular irreversible. Apoptosis.
Lozano G.M., Bejarano, I., Espino, J., González, D., Ortiz, A., García, J.F., Rodríguez, A.B., Pariente, J.A. (2009). «Density gradient capacitation is the most suitable method to improve fertilization and to reduce DNA fragmentation positive spermatozoa of infertile men». Anatolian Journal of Obstetrics & Gynecology 3(1): 1-7.
Uguz AC, Naziroglu M, Espino J, Bejarano I, González D, Rodríguez AB, Pariente JA (November 2009). «Selenium Modulates Oxidative Stress-Induced Cell Apoptosis in Human Myeloid HL-60 Cells Through Regulationof Calcium Release and Caspase-3 and -9 Activities». J Membrane Biol 232: 15-23. doi:[10.1007/s00232-009-9212-2].
The Nobel Foundation. «The Nobel Prize in Physiology or Medicine 2002». Consultado el 25 de noviembre de 2015.
Real Academia Nacional de Medicina. Diccionario de términos médicos. Madrid: Panamericana; 2012.
Cascales Angosto, Maria (2003). «Bases moleculares de la apoptosis». Anal. Real Acad. Nal. Farm. Consultado el 17 de noviembre de
j Jordan, J. (2003). «Apoptosis: muerte celular programada». Centro Regional de Investigaciones Biomédicas. Consultado el 15 de noviembre de 2016.
González D., Rodríguez, A.B., Pariente, J.A. (2014). «TNFa-induced apoptosis in human myeloid cell lines HL-60 and K562 is dependent of intracellular ROS generation». Molecular and Cellular Biochemistry 390: 281-2
Lozano G.M., Bejarano, I., Espino, J., González, D., Ortiz, A., García, J.F., Rodríguez, A.B., Pariente, J.A. (2009). «Relationship between Caspase Activity and Apoptotic Markers in Human Sperm in Reponse to Hydrogem Peroxide and Progesterone». Journal of Reproduction and Development 55(6): 615-621.
González D., Espino, J., Bejarano, I., López, J.J., Rodríguez, A.B., Pariente, J.A. (2010). «Caspase-3 and -9 are activated in human myeloid HL-60 cells by calcium signal». Molecular and Cellular Biochemistry 333: 151-157.
D. González, I. Bejarano, C. Barriga, A.B. Rodríguez, J.A. Pariente (2010). «Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal». Current Signal Transduction Therapy 5: 181-186. doi:[10.2174/157436210791112172]
Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, Barriga C, Pariente JA, Rodríguez AB (2009). «Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells». International Journal of Biomedical science 5(3): 246-256.
 LAS FUNCIONES DEL CEREBRO REPTILIANO .
LAS FUNCIONES DEL CEREBRO REPTILIANO .