EL CUARTO CEREBRO

Paul D. MacLean,
Personalmente me parece atractivo el cerebro Triuno, si se le agrega la capacidad del ingenio humano de fabular desde lo desconocido.
Anatomicamente parececen independientes, los cerebros de
Reptiles Mamiferos y homínidos
Las descripciones paracen acertadas,
El cerebro triúnico es un modelo para el cerebro y el comportamiento humano de los vertebrados, propuesto por Paul MacLean en la década de los 60 para explicar la función de los rastros de evolución existentes especialmente en la estructura del cerebro humano. En este modelo, el cerebro se divide en tres cuerpos separados que tienen su propia inteligencia especial, subjetividad, sentido del tiempo y el espacio, y memoria.1
El cerebro triúnico consiste en el complejo reptiliano, el sistema límbico y el neocórtex. Sin embargo, esta hipótesis ha dejado de ser defendida por algunos investigadores en neuroanatomía evolutiva comparativa de la era post-2000.23.
Una descripción breve de los tres cerebros, para seguir con el sistema perceptivo, de mas reciente descripción.
El complejo-R, también conocido como el «cerebro reptiliano», incluye el tronco del encéfalo y el cerebelo. El término «cerebro reptiliano» deriva del hecho de que el cerebro de un reptil es dominado por el tronco encefálico y el cerebelo, que controla el comportamiento y el pensamiento instintivo para sobrevivir. Este cerebro controla los músculos, el equilibrio y las funciones autónomas (p. ej., respiración y latido del corazón).1 Por consiguiente, es principalmente reactivo a estímulos directos. MacLean ilustra esta función al sugerir que organiza los procesos involucrados en el regreso de las tortugas marinas a la misma playa donde nacieron años atrás.[cita requerida]
El sistema límbico
MacLean, por primera vez, introdujo el término «sistema límbico» en un estudio en 1952. Esta porción del cerebro deriva del «cerebro viejo del mamífero».1 El sistema límbico es el origen de las emociones. Es el encargado de regular las emociones, la memoria y las relaciones sociales. Cuando esta parte del cerebro es estimulada, tal como por corriente eléctrica ligera, las emociones son producidas.
MacLean observa que todo en el sistema límbico es «agradable o desagradable». La supervivencia está basada en una forma evasiva de dolor (desagradable) y una forma recurrente de placer (agradable).1
El sistema límbico incluye la amígdala, el hipotálamo y el hipocampo. El sistema límbico tiene que interactuar con el neocórtex porque no puede funcionar completamente solo. Necesita interaccionar con el neocórtex para procesar las emociones.
El neocórtex
El neocórtex, también conocido como «corteza cerebral», se encuentra únicamente en el cerebro de los mamíferos, incluyendo los seres humanos. El neocórtex es responsable de la ejecución de las funciones del cerebro de carácter superior, que abarcan la cognición, la percepción sensorial y el sofisticado control motriz.4 La evolución del neocórtex en los mamíferos se considera un avance clave que permitió las funciones cognitivas más elevadas,5 es decir, el lenguaje, el pensamiento avanzado, el razonamiento y el conocimiento. Paul MacLean consideraba su aparición como el paso más reciente en la evolución del cerebro de los mamíferos, lo que les confería la habilidad para el lenguaje, la abstracción, la planificación y la percepción.
Al mismo tiempo pero con diferencia en la comunicación aparece el cerebro del reconocimiento.
Reconoce cosas que existen cuando esta indemne principalmente la corteza cerebral y dejan de existir si esta desaparece o se lesiona.
Y como otra veces en ciencias, su descripción se ha hecho desde la patología y no desde la fisiología.
Es posible también, que una lesión sea capaz de fabricar :
Agnosia (del griego ἀγνωσία: «desconocimiento») es la incapacidad de procesar la información sensorial. El término agnosia fue usado por primera vez por Sigmund Freud en 1891.1 2 Hay una incapacidad para reconocer objetos, personas, sonidos, olores o tamaños mientras que el sentido en sí no falla y tampoco hay una pérdida de memoria. La agnosia se asocia con daños cerebrales o enfermedades neurológicas, en particular con el daño en la frontera occipitotemporal que es parte de la corriente ventral.
Que se puede abreviar como “falta de conciencia de un déficit”
Esta complicada clasificación que mezcla localizacion y función, tienen mucha cara de ser una adulteracion , pero surge de la necesidad de entenderlo
1Tipos de Agnosia
1.1Según la etapa perceptiva
1.2Según la modalidad
2Causas
3Etiología
4Tratamiento
5Véase también
6Referencias
7Enlaces externos
Tipos de Agnosia Según la etapa perceptiva
Elaborada por Lissauer (1890), es aplicable casi exclusivamente a las agnosias visuales. Su mérito se basa en concebir el reconocimiento en dos aspectos, uno meramente perceptivo, y el otro de asociación de la percepción con aspecptos previamente almacenados. Según esto la agnosia se puede dividir en:
| Akinetopsia |
También conocida como akinetopsia cerebral, esto se asocia con la incapacidad de percibir el movimiento visual. Una causa de la akinetopsia cerebral son las lesiones fuera de la corteza estriada. |
| Anosognosia |
Esta es la incapacidad de obtener retroalimentación sobre la propia condición y puede confundirse con la falta de comprensión, pero es causada por problemas en los mecanismos de retroalimentación en el cerebro. Es causada por un daño neurológico y puede ocurrir en relación con una serie de alteraciones neurológicas, pero es más comúnmente referida en casos de parálisis después de un accidente cerebrovascular. Las personas con anosognosia con discapacidades múltiples pueden incluso ser conscientes de algunas de sus discapacidades pero completamente incapaces de percibir otras. |
| Agnosia visual aperceptiva |
Los pacientes no pueden distinguir las formas visuales y, por lo tanto, tienen problemas para reconocer, copiar o discriminar entre diferentes estímulos visuales. A diferencia de los pacientes que sufren de agnosia asociativa, aquellos con agnosia aperceptiva no pueden copiar imágenes. |
| Agnosia visual asociativa |
Los pacientes logran describir escenas visuales y clases de objetos, pero aún no los reconocen. Pueden, por ejemplo, saber que un tenedor es algo con lo que comes, pero pueden cometer el error de confundirlo con una cuchara. Los pacientes que sufren de agnosia asociativa todavía pueden reproducir una imagen a través de lo antes visto o revisado. |
| Astereognosis |
También conocida como agnosia somatosensorial, está conectada al sentido táctil, es decir, al tacto. Al paciente le resulta difícil reconocer los objetos al tacto en función de su textura, tamaño y peso. Sin embargo, pueden describirlo verbalmente o reconocer el mismo tipo de objetos a partir de imágenes o dibujar imágenes de ellos. Se piensa que está conectado a lesiones o daños en la corteza somatosensorial. |
| Agnosia auditiva |
La agnosia auditiva ha sido reconocida desde 1877. Con la agnosia auditiva, hay dificultades para distinguir las señales auditivas ambientales y no verbales, incluida la dificultad para distinguir los sonidos del habla que no son del habla, aunque la audición suele ser normal. Hay dos tipos de agnosia auditiva: semántica asociativa y agnosia discriminativa. La agnosia asociativa semántica se asocia con lesiones en el hemisferio izquierdo, mientras que la agnosia discriminativa se asocia con lesiones en el hemisferio derecho. |
| Agnosia verbal auditiva |
También conocido como sordera pura (PWD). Esto se presenta como una forma de significado ‘sordera’ en la que la audición está intacta pero hay una dificultad significativa para reconocer las palabras habladas como semánticamente significativas. |
| Autotopagnosia |
Se asocia con la incapacidad de orientar partes del cuerpo y, a menudo, es causada por una lesión en la parte parietal de las radiaciones tálamicas posteriores. |
| Acromatopsia cerebral |
Dificultad para percibir colores en los que el mundo puede parecer gris o en tonos de gris. La acromatopsia cerebral es causada por daño neurológico. Hay dos regiones del cerebro que se especializan en el reconocimiento de color, las áreas V4 y V8. Si hay una lesión unilateral en el área V4, una pérdida de percepción del color en solo la mitad del campo visual puede resultar conocida como hemiacromatopsia. Similar, pero distinta, es la agnosia de color, que implica tener dificultades para reconocer los colores, mientras que aún se pueden percibir como medidos por una tarea de clasificación o clasificación de colores. |
| Sordera Cortical |
Está referido hacia las personas que no logran percibir ninguna información auditiva, pero su audición está intacta. |
| Agnosia ambiental |
Es la incapacidad de ubicar una habitación o edificio específico con el que uno está familiarizado, así como la incapacidad de proporcionar instrucciones sobre cómo llegar a un lugar determinado. Estas personas experimentan dificultades con las rutas de aprendizaje. Esta forma de agnosia a menudo se asocia con lesiones en las regiones bilaterales o posteriores del hemisferio derecho. También se asocia con la prosopagnosia y la enfermedad de Parkinson. |
| Agnosia Digital |
Es la incapacidad de distinguir los dedos en la mano. Está presente en las lesiones del lóbulo parietal dominante y es un componente del síndrome de Gerstmann. |
| Agnosia |
Los pacientes perciben sólo partes de detalles, no todo el objeto. |
| Agnosia integradora |
Por lo general, un paciente tiene una forma de agnosia asociativa o agnosia aperceptiva. Sin embargo, en el caso de la agnosia integrativa, un paciente se encuentra entre una forma de agnosia asociativa y aperceptiva. Aquí es donde uno tiene la capacidad de reconocer elementos de algo, sin embargo, ser incapaz de integrar estos elementos en conjuntos perceptivos comprensibles. |
| Agnosia dolorosa |
También conocida como analgesia,ésta es la dificultad para percibir y procesar el dolor; Pensado para apuntalar algunas formas de autolesión. |
| Fonagnosia |
Es la incapacidad de reconocer voces familiares, aunque el oyente puede entender las palabras utilizadas. |
| Prosopagnosia |
También conocida como ceguera facial y agnosia facial: los pacientes no pueden reconocer conscientemente las caras familiares, a veces incluso las propias. Esto se percibe a menudo como una incapacidad para recordar nombres. |
| Alexia pura |
Incapacidad para reconocer textos. Los pacientes con alexia pura a menudo tienen daño en su cuerpo calloso, así como daño en las áreas de asociación visual izquierda. En la alexia pura se implica no poder leer material impreso, pero estas personas aún tienen la capacidad de escribir. Los individuos con alexia pura usualmente leen palabras letra por letra. Sin embargo, los individuos con alexia pura muestran un efecto de frecuencia. Son capaces de leer palabras de alta frecuencia mejor y más rápido que pueden leer palabras de baja frecuencia. |
| Agnosia semántica |
Aquellos con esta forma de agnosia son efectivamente «ciegos a los objetos» hasta que usan sistemas sensoriales no visuales para reconocer el objeto. Por ejemplo, sentir, tocar, oler, balancear o mover el objeto puede provocar la realización de su semántica (significado) |
| Agnosia socioemocional |
En ocasiones denominada agnosia expresiva, esta es una forma de agnosia en la que la persona no puede percibir la expresión facial, el lenguaje corporal y la entonación, lo que hace que no puedan percibir las emociones de las personas de forma no verbal y limita ese aspecto de la interacción social. |
| Simultagnosia |
La incapacidad para procesar la entrada visual en su conjunto. La persona, en cambio, procesa caras, cuerpos, objetos, habitaciones, lugares, imágenes poco a poco. Al mirar una imagen, pueden describir las partes de la imagen, pero tienen dificultades para comprender la imagen en su conjunto. La simultagnosia ocurre en el síndrome de Bálint , pero también puede ocurrir en una lesión cerebral. Esta condición también se puede describir al ver sólo un objeto a la vez. Un ejemplo es tener dos tazas en su campo visual y solo poder ver una a la vez. |
| Agnosia táctil |
Incapacidad para reconocer o identificar objetos con solo tocar. |
| Agnosia de tiempo |
Es la falta de comprensión y seguimiento de la duración de un evento. |
| Desorientación topográfica |
También conocida como agnosia topográfica, esta es una forma de agnosia visual en la cual una persona no puede confiar en las señales visuales para guiarlas direccionalmente debido a la incapacidad de reconocer objetos. Sin embargo, aún pueden tener una excelente capacidad para describir el diseño visual del mismo lugar. Los pacientes con agnosia topográfica tienen la capacidad de leer mapas, pero se pierden en ambientes familiares. |
| Disgnosia visuoespacial |
Esto es una pérdida del sentido de «ubicación» en la relación de uno mismo con el entorno de uno mismo y en la relación de los objetos entre sí. Puede incluir apraxia de construcción, desorientación topográfica, ataxia óptica, apraxia ocular motora, apraxia de apósito y confusión derecha-izquierda. |
| Agnosia Visual |
La agnosia visual esta asociada con daños en el lóbulo occipital y temporal izquierdos. Muchos tipos de agnosias visuales involucran la incapacidad de reconocer objetos. |
Otra clasificación se basa en el tipo de elemento no reconocido:
Agnosia visual
La agnosia visual es una categoría amplia que se refiere a una deficiencia en la capacidad de reconocer objetos visuales. La agnosia visual puede subdividirse aún más en dos subtipos diferentes: agnosia visual a perceptiva y agnosia visual asociativa.
Las personas con agnosia visual a perceptiva muestran la capacidad de ver contornos cuando se muestra un objeto, pero experimentan dificultades si se les pide que categoricen los objetos. La agnosia visual adecuada se asocia con daño a un hemisferio, específicamente daño a las secciones posteriores del hemisferio derecho.
En contraste, las personas con agnosia visual asociativa experimentan dificultades cuando se les pide que nombren objetos. La agnosia asociativa se asocia con daños en los hemisferios derecho e izquierdo en el borde occipitotemporal. Una forma específica de agnosia visual asociativa se conoce como prosopagnosia. La prosopagnosia es la incapacidad de reconocer caras. Por ejemplo, estas personas tienen dificultades para reconocer a amigos, familiares y compañeros de trabajo. Sin embargo, las personas con prosopagnosia pueden reconocer todos los demás tipos de estímulos visuales.
Prosopagnosia
Agnosia cromática
Simultagnosia
Cinetoagnosia
Alexia o agnosia para las palabras
Agnosia Verbal
La Agnosia Verbal, o Agnosia Verbal Auditiva, se refiere a “la incapacidad de comprender palabras a pesar de que su capacidad para leer, hablar y escribir se mantiene intacta”.[24] Los pacientes reportan que si escuchan los sonidos que se producen, pero esos sonidos son irreconocibles o no los pueden interpretar.
EXAMINADOR: ¿Qué comiste para el desayuno?
PACIENTE: Desayuno, desayuno, me suena familiar pero no se a lo que se refiere. (Obler & Gjerlow 1999:45)
A pesar de la incapacidad para procesar lo que el hablante dice, se reporta que algunos pacientes reconocen ciertas características sobre la voz del hablante ( como por ejemplo que es un hombre o una mujer).
Causas
La agnosia puede deberse a accidentes cerebrovasculares, demencia u otros trastornos neurológicos. También puede ser inducido por un traumatismo o por una lesión en la cabeza, una infección cerebral o hereditaria. Además, algunas formas de agnosia pueden ser el resultado de trastornos del desarrollo. El daño que causa la agnosia generalmente ocurre en los lóbulos occipital o parietal del cerebro. Aunque en modalidades, se podrán ver afectadas las habilidades cognitivas, mientras que en otras áreas se conservan.
Los pacientes que experimentan una recuperación dramática de la ceguera experimentan una agnosia significativa.
¿Tienen estos trastornos clínicos una localización de as lesiones?
El efecto del daño en el surco temporal superior es consistente con varios tipos de deficiencias neurolingüísticas, y algunos afirman que la agnosia es uno de ellos. El surco temporal superior es vital para la comprensión del habla porque la región está muy involucrada con la interfaz léxica. Según el modelo TRACE II de 1985, la interfaz léxica asocia ondas sonoras (fonemas) con características morfológicas para producir palabras significativas. Este proceso de asociación se logra mediante la inhibición / excitación lateral de ciertas palabras dentro del léxico (vocabulario) de un individuo. [24] Por ejemplo, si un experimentador dijera DOG en voz alta, la expresión se activaría e inhibiría varias palabras dentro de la interfaz léxica de los sujetos:
DOG activa 3, e inhibe 0 letras en DOG. – +3
DOG activa 2, e inhibe 1 letras en FOG. – +2
DOG activa 1, e inhibe 2 letras en DAN. – +1
La consistencia de este modelo con respecto a la agnosia se demuestra por la evidencia de que las lesiones bilaterales del surco temporal superior producen «sordera total» (Kussmaul, 1877), o como se entiende hoy en día: agnosia del habla. Los pacientes con sordera con palabras puras demuestran la incapacidad de reconocer y procesar los sonidos del habla con un procesamiento auditivo normal para los sonidos que no son del habla por debajo del nivel de la corteza.
Diagnóstico
Para evaluar la agnosia de un individuo, debe verificarse que el individuo no esté sufriendo una pérdida de sensibilidad, y que tanto su capacidad de lenguaje como su inteligencia estén intactas. Para que un individuo sea diagnosticado con agnosia, solo debe estar experimentando un déficit sensorial en una modalidad única. Para hacer un diagnóstico, se debe hacer la distinción entre agnosia aperceptiva y asociativa. Esta distinción se puede obtener haciendo que el individuo complete las tareas de copia y comparación. Si el individuo sufre de una forma de agnosia aperceptiva, no podrá igualar dos estímulos que son idénticos en apariencia. En contraste, si un individuo sufre de una forma de agnosia asociativa, no será capaz de igualar diferentes ejemplos de un estímulo. Por ejemplo, una persona que ha sido diagnosticada con agnosia asociativa en la modalidad visual no podría hacer coincidir las imágenes de una computadora portátil que está abierta con una computadora portátil que está cerrada.
Alexia pura.
Las personas con alexia pura suelen tener dificultades para leer palabras y dificultades para identificar las letras. Para evaluar si una persona tiene alexia pura, se deben realizar pruebas de reconocimiento. Un individuo con alexia pura debe poder copiar un conjunto de palabras y debe poder reconocer letras.
Prosopagnosia
A los individuos comúnmente se les muestra fotos de caras humanas que les podrían parecer familiares, tales como actores famosos, cantantes, políticos o miembros familiares. Las fotos que se les enseña a los pacientes están selectas para ser apropiadas para su edad y cultura. La tarea involucra al examinador haciéndole preguntas al individuo que no puede reconocer cada cara. Si el individuo no puede nombrar de quien es la cara que aparece en la foto, el examinador puede hacer una pregunta que podría ayudarlo a reconocer la cara en la foto.
Agnosia auditiva
Agnosia auditiva verbal,o afasia de wernicke tipo I
Agnosia auditiva no verbal
Amusia receptiva
Agnosia tactíl
Asteroagnosia
Agnosia gustativa
Agnosia olfativa
Agnosia espacial
Agnosia topográfica. Incapacidad para orientarse.
Agnosias corporales
Asomatoagnosia
Hemiasomatognosia
Misoplejía
Somatoparafrenia
Autotopognosia
Analgoagnosia o asimbolia al dolor
El término agnosia hace referencia a «ausencia de reconocimiento». Se trata de la incapacidad para llevar a cabo un reconocimiento integral aunque el recuerdo exista en alguna modalidad sensorial o categoría conceptual aisladas. El agnóstico identifica las propiedades (visuales, táctiles o auditivas) pero luego no lo reconoce como tal. Suele suceder solo en una modalidad sensorial (el agnósico es capaz de reconocer al tacto que tiene un libro en sus manos pero no ocurre lo mismo al verlo). Existen distintos tipos de agnosia: 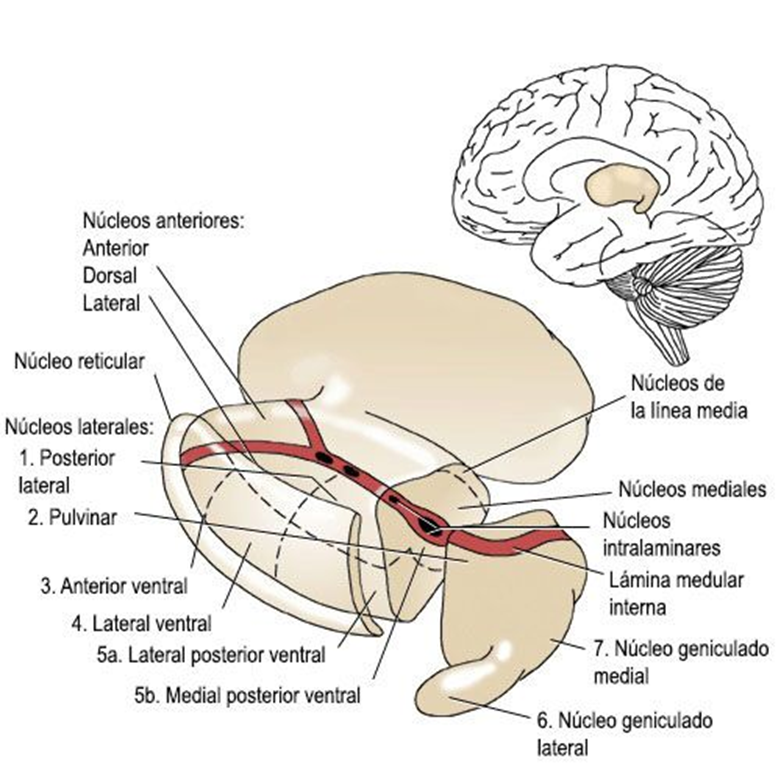
Dentro de esta capitulo, mi experiencia en las lesiones frontales apicales y lesiones del paleo espino talamico en los nucleos intralaminares del talamo, me llevaron al conocimiento de que el enfermo reconoce el dolor pero no le da connotaciones desagradables. 
“El dolor sigue igual pero ya no me importa”
Y de una manera sorprendente desaparecen lesiones benignas de la heterogéneas con cierta brusquedad.
Ceguera cortical o discapacidad visual cortical
Qué es la ceguera cortical o la discapacidad visual cortical
La ceguera cortical es la falta de visión, no por un problema ocular o una enfermedad visual, sino debido a un daño cerebral en las áreas visuales primarias del lóbulo occipital (corteza visual).
Los ojos y las vías nerviosas encargadas de trasladar y recibir la información visual funcionan correctamente, de hecho, las pupilas de las personas con discapacidad visual cortical son capaces de reaccionar a los estímulos nerviosos. Sin embargo, toda esta información no llega a procesarse correctamente en el cerebro debido a algún tipo de lesión en estas vías.
Causas de la ceguera cortical
La causa directa de la ceguera cortical es la presencia de lesiones a nivel bilateral en los lóbulos occipitales. Estas lesiones suelen estar provocadas por accidentes cerebrovasculares (ictus); por traumatismos craneoencefálicos con hemorragia cerebral asociada y deterioro del lóbulo occipital; por infecciones como meningitis o encefalitis y en algunos casos por malformaciones durante la gestación que provocan o la no existencia de dicho lóbulo o que es disfuncional.
Cómo ve una persona con ceguera cortical
Tal y como hemos observado, la ceguera cortical se debe a una lesión cerebral y no a una patología ocular. De este modo, los ojos y el nervio óptico se encuentran en perfecto estado y, por eso, son capaces de reaccionar a ciertos estímulos como la luz o el movimiento. Sin embargo, al deberse a una lesión cerebral la información no se procesa correctamente, las imágenes no llegan a proyectarse y la ceguera es total.
En estudios con lesiones unilateral (un solo hemisferio dañado), se ha demostrado que el paciente no puede ver lo que hay en su campo visual, pero se ha observado que si que puede alcanzar los objetos colocados en el campo ciego, o esquivar los objetos que hay en su camino para no tropezar con ellos.
En ocasiones, la ceguera cortical puede estar acompañada de anosognosia o síndrome de Anton. La personas que padecen este síndrome niega estar ciega, no reconocen el déficit visual, e intentan actuar y moverse con normalidad. Además, la anosognosia puede provocar confabulaciones o alucinaciones visuales asociadas a esta negación.
Agnosias visuales: Son incapaces de reconocer los objetos que se les presentan en la modalidad visual. Por ejemplo, no son capaces de decir que es una «mesa» pero relatan que están viendo un tablón de madera que se sustenta sobre 4 palos, por ejemplo. El cerebro no sabe interpretar lo que ven los ojos del paciente. Existe la denominada simultagnosia, en el que el paciente es capaz de reconocer los objetos de forma aislada pero es incapaz de ponerlos en relación. Por ejemplo, puede ver a una mujer extendiendo un mantel sobre una mesa, pero no identifica esa acción como «poner la mesa».
Un reciente caso, me muestra una chica de 16 años, que tras un golpe de peqeña, es incapaz de comer sola, pero sortea los objetos que se colocan en su camino. La TAC muestra una antigua lesión occipital apical bilateral de años de evolución y que se produjo, tras una caída de pequeña.
Agnosias táctiles: Incapacidad de reconocer objetos por el tacto, a pesar de no existir ningún déficit o anomalía sensoperceptiva (también agnosia táctil, estereognosia o asterognosia).
Agnosias auditivas: Incapacidad para entender el lenguaje normal (sordera verbal) o reconocer una serie de sonidos con música (amusia sensorial), a pesar de no existir ningún déficit o anomalía sensoperceptiva.
Agnosias motoras: Dificultad para recordar o memorizar esquemas motores (también se conocen como apraxias).
Agnosias corporales: Incapacidad para identificar o reconocer la totalidad del propio cuerpo (somatognosia), la mitad lateral (hemisomatognosia) o sólo una parte del cuerpo (autopagnosia).
Cuando la descripción ocupa tanto espacio como la función, nos vemos obligados a crear u nuevo cuerpo.
Y posibleemnte este no es asi, pero si que la aparición de regiones anatómicas da lugar a nuevas funciones cada vez mas complejas
Etiología
La agnosia es el resultado de una lesión en el cerebro, concretamente en las áreas receptoras secundarias situadas en el tálamo y en la corteza cerebral Esta lesión puede deberse a un traumatismo craneoencefálico, accidenteerebrovascular (ictus), demencia, intoxicación por monóxido de carbono u otros desórdenes neurológicos.
Esta difícil presentación clínica, invita a considerar una delgada manta cortical, , difícil de morfolizar, pero su lesion inhibe una función perceptiva.
Podiamos resumir, que disitntos componentes del cerebro, al ser lesionados, presntan manifestaciones o manifestaciones diferentes.
El tronco del encéfalo, el cerebro de los reptiles, es el responsable de funciones vitales
El Diencefalo, regula con bastante claridad la emoción y la memoria
La corteza del cerebro, sostienene manifestaciones psíquicas, y sobre todo regula las funcione de esta. Y aquí donde aparece en la posibilidad, no solo existe una lesión o función superior, sino la capacidad de usarla y controlarla
No es que a la naturaleza le interese mantener nombres para señalar regiones y funciones, pero si persiste esta capacidad da lugar a perdida del conocimiento de ellas y también de sus manejo
Tratamiento
Inicialmente, muchos individuos con una forma de agnosia desconocen hasta qué punto tienen un déficit perceptivo o de reconocimiento. Esto puede ser causado por anosognosia, que es la falta de conciencia de un déficit. Esta falta de conciencia generalmente conduce a una forma de negación y resistencia a cualquier forma de ayuda o tratamiento. Hay varios métodos que se pueden usar que pueden ayudar al individuo a reconocer el deterioro en la percepción o el reconocimiento que pueden tener. A un paciente se le puede presentar un estímulo a la modalidad deteriorada solo para ayudar a aumentar su conciencia de su déficit.
Alternativamente, una tarea puede dividirse en sus partes componentes para que el individuo pueda ver cada parte del problema causado por el déficit. Una vez que el individuo reconoce su déficit de percepción o reconocimiento, se puede recomendar algún tratamiento.
Existen varias formas de tratamientos, como estrategias compensatorias con modalidades alternativas, estrategias verbales, señales alternativas y estrategias organizativas.
BIBLIOGRAFIA
↑ Kiverstein, J., & Miller, M. (2015). The embodied brain: towards a radical embodied cognitive neuroscience. Frontiers in Human Neuroscience, 9, 237. http://doi.org/10.3389/fnhum.2015.00237
↑ Lodato, Simona; Arlotta, Paola (13 de noviembre de 2015). «Generating Neuronal Diversity in the Mammalian Cerebral Cortex». Annual Review of Cell and Developmental Biology (en inglés) 31 (1): 699-720. PMC 4778709. PMID 26359774. doi:10.1146/annurev-cellbio-100814-125353. «The neocortex is the part of the brain responsible for execution of higher-order brain functions, including cognition, sensory perception, and sophisticated motor control ».
↑ Lui, Jan H.; Hansen, David V.; Kriegstein, Arnold R. (2011). «Development and Evolution of the Human Neocortex». Cell 146 (1): 18-36. PMC 3610574. PMID 21729779. doi:10.1016/j.cell.2011.06.030. «Evolution of the neocortex in mammals is considered to be a key advance that enabled higher cognitive function. »
Bibliografía[editar]
Referencias
↑ Saltar a:a b c d Kazlev, et al., M. Alan (19 de octubre de 2003). «The Triune Brain.». KHEPER. Archivado desde el original el 19 de noviembre de 2003. Consultado el 25 de mayo de 2007.
↑ Patton, Paul (December, 2008). «One World, Many Minds: Intelligence in the Animal Kingdom». Scientific American.
Gardner, Russell; Cory, Gerald A. (2002). The evolutionary neuroethology of Paul MacLean: convergences and frontiers. Nueva York: Praeger. ISBN 0-275-97219-4. OCLC 49649452.
Kral, V. A.; MacLean, Paul D. (1973). A Triune concept of the brain and behaviour, by Paul D. MacLean. Including Psychology of memory, and Sleep and dreaming; papers presented at Queen’s University, Kingston, Ontario, February 1969, by V. A. Kral [et al.] Toronto: Published for the Ontario Mental Health Foundation by Univ. of Toronto Press. ISBN 0-8020-3299-0. OCLC 704665.
MacLean, Paul D. Brain Evolution Relating to Family, Play, and the Separation Call. Arch. Gen. Psychiatry 42: 405-417, 1985.
MacLean, Paul D. (1990). The triune brain in evolution: role in paleocerebral functions. Nueva York: Plenum Press. ISBN 0-306-43168-8. OCLC 20295730.
Rubio Garcia E. Talamotomias de los nucleos intralaminares en el dolor
 Pilar García, una futura donante. Foto: ALBERTO DI LOLLI
Pilar García, una futura donante. Foto: ALBERTO DI LOLLI Este banco es el único en España que está integrado en las mismas instalaciones que un centro socio-sanitario, el Centro Alzheimer Fundación Reina Sofía. Foto: ALBERTO DI LOLLI
Este banco es el único en España que está integrado en las mismas instalaciones que un centro socio-sanitario, el Centro Alzheimer Fundación Reina Sofía. Foto: ALBERTO DI LOLLI



 Yago Nieto, del MD Anderson de la Universidad de Texas.
Yago Nieto, del MD Anderson de la Universidad de Texas.