Vacunas contra el cáncer
Todos soñamos con que se pueda obtener una vacuna eficaz contra el cáncer y convertir en una enfermedad crónica pero no necesariamente mortal, esta enfermedad.
Que duda cabe que las vacunas han sido, si, uno de los mayores remedios contra las enfermedades infecciosas, pero esta costando trabajo que las vacunas se puedan aplicar a sistemas patógenos no infeccioso, no obstante los repetidos trabajos desarrolldos, demuestran que esto puede ser posible.
A continuación hago un resumen de inmunidad y vacunas en el cáncer del NIH, instituto Nacional del cáncer, que me parece muy interesante aparecido en 2015.
El sistema inmunitario es una compleja red de células, tejidos, órganos y sustancias producidas por ellos que ayuda al cuerpo a combatir infecciones y otras enfermedades. Por mucho tiempo se ha reconocido la función del sistema inmunitario en la defensa contra microbios que causan enfermedades. Los científicos han descubierto también que el sistema inmunitario puede proteger al cuerpo contra peligros que presentan ciertas células dañadas, enfermas o anómalas, incluso células cancerosas (1).
Los glóbulos blancos, o leucocitos, tienen la más importante función en las respuestas inmunitarias. Estas células llevan a cabo las muchas tareas requeridas para proteger al cuerpo contra los microbios y las células anormales que causan enfermedades.
Algunos tipos de leucocitos recorren el sistema circulatorio en busca de invasores foráneos y de células enfermas, dañadas o muertas. Estos glóbulos blancos de la sangre proveen un grado de protección inmunitaria general— o no específico.
Otros tipos de leucocitos, conocidos como linfocitos, proveen protección dirigida contra amenazas específicas, ya sea de un microbio específico o de una célula enferma o anormal. Los grupos más importantes de linfocitos responsables de llevar a cabo respuestas inmunitarias contra tales amenazas son las células B y las células T.
Las células B producen anticuerpos, los cuales son proteínas grandes secretadas que se unen a invasores foráneos o a células anormales y las vuelven pasivas y ayudan a destruirlas. Las células T citotóxicas, las cuales se conocen también como células T asesinas, destruyen a las células infectadas o anormales al expedir compuestos químicos tóxicos o al incitar a las células a que se autodestruyan (en un proceso conocido como apoptosis).
Otros tipos de linfocitos y de leucocitos tienen funciones de apoyo para asegurar que las células B y las células T asesinas llevan a cabo sus trabajos efectivamente. Estas células de apoyo son las células T auxiliares y las células dendríticas, las cuales ayudan a activar tanto a las células B como a las células T citotóxicas y facilitan su respuesta a amenazas específicas.
Los antígenos son sustancias que tienen la posibilidad de causar que el cuerpo arme una respuesta inmunitaria contra ellas. Ayudan a que el sistema inmunitario determine si algo es foráneo o “no es propio”. Las células normales en el cuerpo tienen antígenos que las identifican como “propias”. Los antígenos propios comunican al sistema inmunitario que las células normales no son una amenaza y que deberá ignorarlas (2). Al contrario, los microbios son reconocidos por el sistema inmunitario como una amenaza posible que deberán ser destruidos porque llevan antígenos foráneos, o no propios.
Las células cancerosas pueden llevar antígenos propios y antígenos que se conocen como asociados con cáncer. Los antígenos asociados con cáncer marcan las células cancerosas como anormales o foráneas y pueden hacer que las células T citotóxicas lancen un ataque contra ellas (1-7). Los antígenos asociados con cáncer pueden ser:
• Antígenos propios producidos en cantidades mucho más grandes por las células cancerosas que por las células normales y, en esa forma, el sistema inmunitario las ve como foráneas.
• Los antígenos que no son producidos normalmente por el tejido en donde se forma el cáncer (por ejemplo, los antígenos que son producidos normalmente solo por tejido embriónico pero que se expresan en un cáncer adulto) y, así, son vistos como foráneos por el sistema inmunitario.
• Los antígenos que se forman recientemente, o neo-antígenos, que resultan de mutaciones de genes en células cancerosas y que el sistema inmunitario no había visto antes.
Sin embargo, varios factores pueden dificultar que el sistema inmunitario se apunte a cánceres que crecen para destruirlos:
• Muchos antígenos asociados con cánceres son solo versiones ligeramente alteradas de antígenos propios y, por esto, puede ser difícil que el sistema inmunitario los reconozca.
• Las células cancerosas pueden sufrir cambios genéticos que puedan conducir a la pérdida de antígenos asociados con cáncer.
• Las células cancerosas pueden evadir las respuestas inmunitarias de las células T citotóxicas contra el cáncer. Como resultado de esto, aun cuando el sistema inmunitario reconozca como amenaza a un cáncer en crecimiento, el cáncer puede todavía escaparse a un fuerte ataque del sistema inmunitario (8).
Las vacunas son medicinas que refuerzan la habilidad natural del sistema inmunitario para proteger al cuerpo contra “invasores foráneos”, principalmente de agentes infecciosos que puedan causar enfermedades.
Cuando un microbio infeccioso invade al cuerpo, el sistema inmunitario lo reconoce como foráneo, lo destruye, y “recuerda” impedir otra infección en caso que el microbio invada de nuevo al cuerpo en el futuro. Las vacunas aprovechan esta respuesta defensiva de memoria.
La mayoría de las vacunas se producen con versiones inocuas de microbios— destruidos o debilitados, o partes de microbios— que no causan enfermedades pero pueden estimular una respuesta inmunitaria contra los microbios. Cuando el sistema inmunitario encuentra estas sustancias por medio de una vacunación, responde a ellas, las elimina del cuerpo y se forma una memoria de ellas. La memoria inducida por la vacuna hace que el sistema inmunitario actúe rápido para proteger al cuerpo si se infecta por los mismos microbios en el futuro.
Las vacunas contra el cáncer pertenecen a una clase de sustancias que se conocen como modificadoras de respuesta biológica. Los modificadores de respuesta biológica trabajan al estimular o restaurar la habilidad del sistema inmunitario para combatir infecciones y enfermedades. Hay dos tipos amplios de vacunas contra el cáncer:
• Vacunas preventivas (o profilácticas), las cuales tratan de impedir que se presente el cáncer en gente sana.
• Vacunas de tratamiento (o terapéuticas), las cuales tienen como objeto el tratamiento de un cáncer existente al reforzar la respuesta inmunitaria natural del cuerpo contra el cáncer (9). Las vacunas de tratamiento son una forma de inmunoterapia.
Dos tipos de vacunas preventivas de cáncer (las vacunas contra el virus del papiloma humano y las vacunas contra el virus de la hepatitis B) están disponibles en los Estados Unidos, y una vacuna de tratamiento (para cáncer metastático de próstata) está disponible.
Las vacunas preventivas de cáncer se dirigen a sustancias infecciosas que causan o contribuyen a que se forme el cáncer (10). Son semejantes a las vacunas tradicionales, las cuales ayudan a impedir enfermedades infecciosas, como el sarampión o la polio, al proteger al cuerpo contra la infección. Tanto las vacunas de prevención de cáncer como las vacunas tradicionales están basadas en antígenos que llevan las sustancias infecciosas y que son relativamente fáciles de reconocer como foráneas por el sistema inmunitario.
La mayoría de las vacunas de prevención, incluso las que se dirigen a virus que causan cáncer (virus de la hepatitis B y virus del papiloma humano), estimulan la producción de anticuerpos que se unen a microbios específicos en el blanco y bloquean su habilidad para causar infecciones.
¿Cuáles vacunas de prevención de cáncer están aprobadas en los Estados Unidos?
• Vacunas contra los virus del papiloma humano (VPH). Las infecciones persistentes por tipos de VPH de alto riesgo pueden causar cáncer de cuello uterino, cáncer de ano, cáncer de orofaringe y cánceres de vagina, de vulva y de pene.Tres vacunas están aprobadas por la Administración de Alimentos y Medicamentos (FDA) para prevenir la infección por VPH: Gardasil®, Gardasil 9® y Cervarix®. Gardasil y Gardasil 9 están aprobadas para usarse en mujeres de 9 a 26 años de edad para la prevención de los cánceres de cuello uterino, de vulva, vagina y de ano causados por VPH; de lesionesprecancerosas de cuello uterino, de vulva, vagina y de ano; y de verrugas genitales. Gardasil y Gardasil 9 fueron aprobadas también para usarse en hombres para la prevención de cáncer de ano causado por VPH y para lesiones precancerosas de ano y verrugas genitales. Gardasil fue aprobada para usarse en hombres de 9 a 26 años de edad, y Gardasil 9 fue aprobada para usarse en hombres de 9 a 15 años de edad. Cervarix fue aprobada para usarse en mujeres de 9 a 25 años de edad para la prevención del cáncer cervical (o cuello uterino) causado por VPH.
• Vacunas contra el virus de la hepatitis B (VHB). La infección crónica por el virus de la hepatitis B puede conducir a cáncer de hígado. La FDA ha aprobado muchas vacunas que protegen contra la infección por el VHB. Dos vacunas, Engerix-B y Recombivax HB, protegen solo contra la infección por VHB. Ambas vacunas están aprobadas para usarse en individuos de todas las edades. Algunas otras vacunas protegen contra la infección por VHB así como por otros virus. Twinrix protege contra el VHB y contra el virus de la hepatitis A, y Pediarix contra el VHB, contra el poliovirus y la bacteria que causa difteria, tétanos y tosferina. Twinrix está aprobado para usarse en personas de 18 años y más. Pediarix está aprobado para usarse en infantes cuyas madres no tienen el antígeno de superficie de VHB (HBsAg) y se administra tan pronto como desde las 6 semanas de edad hasta los 6 años. La vacuna original contra el VHB fue aprobada por la FDA en 1981, y así fue la primera vacuna de prevención de cáncer en ser producida y comercializada con éxito. Hoy en día, la mayoría de los niños de los Estados Unidos están vacunados contra el VHB al poco tiempo después de nacer (11).
¿Cómo se diseñan las vacunas de tratamiento de cáncer para que funcionen?
Las vacunas de tratamiento de cáncer se usan para tratar cánceres que ya se han formado. La intención es que retrasen o detengan el crecimiento de células cancerosas; causar que se reduzca el tumor; impedir que regrese el cáncer; o eliminar las células cancerosas que no hayan sido destruidas por otras formas de tratamiento.
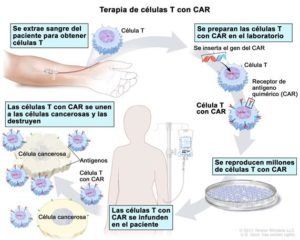
Las vacunas de tratamiento de cáncer se diseñan para que funcionen al activar las células T citotóxicas y para dirigirlas a que reconozcan y actúen contra tipos específicos de cáncer o para inducir la producción de anticuerpos que se unan a las moléculas en la superficie de las células cancerosas. Para lograr esto, las vacunas de tratamiento introducen uno o varios antígenos en el cuerpo, generalmente por inyección, en donde causan una respuesta inmunitaria que resulta en la activación de las células T o en producción de anticuerpos. Los anticuerpos reconocen y se unen a los antígenos en la superficie de las células cancerosas, mientras que las células pueden detectar también antígeno de cáncer dentro de las células cancerosas.
La producción de vacunas efectivas de tratamiento ha resultado más difícil y problemática que la formulación de vacunas preventivas de cáncer (12). Para ser efectivas, las vacunas para tratamiento de cáncer necesitan lograr dos propósitos. Primero, como las vacunas preventivas, las vacunas de tratamiento de cáncer deben estimular respuestas inmunitarias específicas dirigidas al blanco correcto. Segundo, las respuestas inmunitarias deben tener la potencia suficiente para traspasar las barreras que usan las células cancerosas para protegerse de los ataques de las células T citotóxicas.
En abril de 2010, la FDA aprobó la primera vacuna de tratamiento de cáncer. Esta vacuna, sipuleucel-T (Provenge®), está aprobada para usarse en algunos hombres con cáncer metastático de próstata. Está diseñada para estimular una respuesta inmunitaria a la fosfatasa ácida prostática (PAP), un antígeno que se encuentra en la mayoría de las células cancerosas de próstata. En estudios clínicos, sipuleucel-T aumentó cerca de cuatro meses la supervivencia de hombres con cierto tipo de cáncer metastático de próstata (13).
Al contrario de algunas otras vacunas de tratamiento de cáncer, sipuleucel-T se ajusta a cada paciente. La vacuna se formula al aislar células del sistema inmunitario llamadas células dendríticas, las cuales son un tipo de células que presentan antígenos (APC), de la sangre de un paciente por un procedimiento llamado leucocitaféresis. Estas células se envían al fabricante de la vacuna, en donde se cultivan junto con una proteína llamada PAP-GM-CSF. Esta proteína consiste de PAP unida a una proteína llamada factor estimulador de colonias de granulocitos y macrófagos (GM-CSF). El GM-CSF estimula al sistema inmunitario y mejora la presentación de antígenos.
Las células APC cultivadas con PAP-GM-CSF forman el componente activo de sipuleucel-T. Las células se regresan al médico que trata al paciente y se infunden en el paciente. Los pacientes reciben tres tratamientos, ordinariamente con una separación de dos semanas, y cada ronda de tratamiento requiere el mismo proceso de fabricación. Aunque no se conoce el mecanismo preciso de acción de sipuleucel-T, parece que las células APC que han absorbido PAP-GM-CSF estimulan a las células T del sistema inmunitario para que destruyan las células tumorales que expresan PAP.
En octubre de 2015, la FDA aprobó la primera terapia oncolítica con virus, talimogene laherparepvec (T-VEC, o Imlygic®) para el tratamiento de algunos pacientes con melanoma metastático que no puede ser operado quirúrgicamente. Además de infectar y de causar lisis en las células cancerosas cuando se inyecta directamente en tumores de melanoma, T-VEC induce respuestas en lesiones en donde no se inyectó, lo que sugiere que desencadena una respuesta inmunitaria contra el tumor semejante a las de otras vacunas anticancerosas.
Todas las vacunas preventivas contra el cáncer aprobadas por la FDA hasta la fecha se han producido mediante el uso de antígenos de microbios que causan o contribuyen a la formación de cáncer. Esto incluye a antígenos de VHB y a tipos específicos de VPH. Estos antígenos son proteínas que ayudan a formar la superficie externa de los virus. Ya que solo se usa una parte de los microbios, las vacunas resultantes no son infecciosas y, por lo tanto, no pueden causar enfermedades.
Investigadores están creando también versiones sintéticas de antígenos en el laboratorio para usarse en vacunas preventivas para cáncer. Para hacer esto, ellos modifican con frecuencia la estructura química de los antígenos para estimular respuestas inmunitarias que son más fuertes que las causadas por los antígenos originales (14).
En forma semejante, las vacunas de tratamiento de cáncer se crean usando antígenos asociados con cáncer o versiones modificadas de ellos. Los antígenos que se han usado hasta ahora incluyen proteínas, carbohidratos (azúcares), glucoproteínas o glucopéptidos (combinaciones de carbohidratos y proteína), y gangliósidos (combinaciones de carbohidratos y lípidos).
Las vacunas de tratamiento de cáncer se formulan también mediante el uso de células cancerosas debilitadas o muertas que llevan antígeno(s) específicos asociados con cáncer o células inmunitarias modificadas para presentar tal antígeno(s) en su superficie. Estas células pueden originarse del paciente mismo (llamada vacuna autógena, como con sipuleucel-T) o de otro paciente (llamada vacuna alogénica).
Algunas vacunas para el cáncer en su estadio tardío de formulación usan virus, levaduras o bacterias como vehículos (vectores) para depositar un antígeno o más en el cuerpo (15). Estos mismos vectores son inmunogénicos naturalmente (es decir, pueden estimular una respuesta inmunitaria) pero están modificados para que no puedan causar enfermedades.
Otros tipos de vacunas de tratamiento de cáncer que están siendo formuladas son las hechas con moléculas de ADN o de ARN que contienen instrucciones genéticas para antígenos asociados con cáncer. El ADN o el ARN pueden inyectarse solos en un paciente como vacuna de “ácido nucleico desnudo”, o empacada dentro de un virus inocuo. Después de que se inyecta el ácido nucleico desnudo o virus en el cuerpo, el ADN o ARN es absorbido por las células, las cuales empiezan a producir los antígenos asociados con el tumor. Los investigadores esperan que las células producirán suficientes antígenos asociados con el tumor para estimular una fuerte respuesta inmunitaria.
Ahora se usan varios antígenos diferentes asociados con cáncer para hacer vacunas experimentales de tratamiento de cáncer. Algunos de estos antígenos se encuentran sobre la mayoría de los tipos de células cancerosas o dentro de ellas. Otros son únicos a tipos específicos de cáncer (1, 5, 6, 13, 16-19).
Sustancias conocidas como adyuvantes se añaden con frecuencia a las vacunas para reforzar su habilidad de inducir fuertes respuestas inmunitarias contra el cáncer (20).
Los adyuvantes usados para vacunas para cáncer se originan de muchas fuentes diferentes. Algunos microbios, como el bacilo Calmette-Guérin (BCG), pueden servir como adyuvantes (21). Sustancias producidas por bacterias, como el Detox B (una emulsión aceitosa en forma de gotas de monofosforil lípido A y un esqueleto micobacteriano de pared celular) se usan con frecuencia también como adyuvantes. Productos biológicos derivados de organismos que no son microbios pueden usarse también como adyuvantes. Un ejemplo es la hemocianina de lapa californiana (KLH), la cual es una proteína grande producida por un molusco marino. Los antígenos que se pegan a la KLH han mostrado que aumentan su habilidad para estimular las respuestas inmunitarias. Aun algunas sustancias que no son biológicas, como un aceite emulsificado conocido como montanide ISA–51, pueden usarse como adyuvantes.
Las citocinas naturales o sintéticas pueden usarse también como adyuvantes. Las citocinas son sustancias producidas naturalmente por los glóbulos blancos para regular y afinar las respuestas inmunitarias. Algunas citocinas aumentan la actividad de las células B y de las células T citotóxicas, mientras que otras citocinas suprimen las actividades de estas células. Las citocinas usadas con frecuencia en las vacunas de tratamiento de cáncer o que se dan junto con ellas son la interleucina 2 (IL2, conocida también como aldesleucina) el interferón alfa (INF–a), y el factor estimulador de colonias de granulocitos y macrófagos (GM–CSF, conocido también como sargramostim) (22).
¿Tienen las vacunas contra el cáncer efectos secundarios?
Antes de autorizar cualquier vacuna, la FDA debe verificar que sea segura y efectiva. Las vacunas que tienen el fin de prevenir o de tratar cáncer parecen tener perfiles de seguridad comparables a los de otras vacunas (6). Sin embargo, los efectos secundarios de las vacunas para cáncer pueden variar entre las formulaciones de vacunas y de una persona a otra.
El efecto secundario que se notifica con más frecuencia de las vacunas para cáncer es la inflamación en el sitio de inyección, incluso enrojecimiento, dolor, inflamación, calentamiento de la piel, comezón y ocasionalmente una erupción cutánea.
Algunas personas experimentan síntomas como de gripe después de recibir una vacuna para cáncer, incluso fiebre, escalofríos, debilidad, mareos, náuseas, vómitos, dolor muscular, fatiga, dolor de cabeza y ocasionalmente dificultad para respirar. La presión arterial puede afectarse también. Estos efectos secundarios, que en general duran solo por un corto tiempo, indican que el cuerpo está respondiendo a la vacuna y produciendo una respuesta inmunitaria, como lo hace cuando se expone a un virus.
Otros problemas de salud más graves se han notificado en menos personas después de recibir una vacuna para el cáncer. Estos problemas pueden haber sido causados por la vacuna o no. Los problemas reportados han incluido asma, apendicitis, enfermedad inflamatoria pélvica y ciertas enfermedades autoinmunitarias, incluso artritis y lupus eritematoso sistémico.
Las vacunas que usan células o microbios pueden tener efectos secundarios adicionales. Por ejemplo, los efectos secundarios graves de sipuleucel-T son la infección cerca del sitio de inyección y sangre en la orina.
Las vacunas, como cualquier otra medicina que afecta al sistema inmunitario, pueden causar efectos adversos que pueden poner la vida en peligro. Por ejemplo, reacciones graves de hipersensibilidad (alérgicas) a ingredientes específicos de vacunas han ocurrido después de una vacunación. Sin embargo, tales reacciones graves son raras.
¿Pueden combinarse las vacunas de tratamiento de cáncer con otros tipos de terapia contra el cáncer?
Sí. En muchos de los estudios clínicos de vacunas de tratamiento de cáncer que están ahora en curso, las vacunas se administran con otras formas de terapia para el cáncer. Las terapias que se han combinado con vacunas de tratamiento de cáncer incluyen la cirugía, la quimioterapia, radioterapia, y algunas formas de terapia dirigida, incluso terapias que tienen como objeto reforzar las reacciones del sistema inmunitario contra el cáncer.
Varios estudios han sugerido que las vacunas de tratamiento de cáncer pueden ser más efectivas cuando se administran en combinación con otras formas de terapia para cáncer (18,23). Por ejemplo, estudios preclínicos y estudios clínicos en fase inicial han demostrado que la radioterapia puede intensificar la eficacia de las vacunas de tratamiento de cáncer (24). Además, en algunos estudios clínicos, las vacunas de tratamiento de cáncer han parecido aumentar la efectividad de otras terapias para cáncer (18,23).
Evidencia adicional sugiere que la extirpación quirúrgica de tumores grandes puede intensificar la efectividad de las vacunas de tratamiento de cáncer (23). En pacientes con enfermedad extensa, el sistema inmunitario puede verse abatido por el cáncer. La extirpación quirúrgica del tumor puede facilitar que el cuerpo presente una respuesta inmunitaria efectiva.
Los investigadores están diseñando también estudios clínicos para responder a cuestiones tales como si las vacunas de tratamiento de cáncer funcionan mejor cuando se administran antes, después o al mismo tiempo que otras terapias (7). Las respuestas a tales preguntas pueden no solo proveer información acerca de cómo usar mejor una vacuna específica de tratamiento de cáncer sino también revelar principios básicos adicionales que guíen la creación futura de terapias de combinación que incluyen vacunas.
¿Qué investigación hay en curso para mejorar las vacunas de tratamiento de cáncer?
Avances recientes en el conocimiento de cómo las células cancerosas evitan ser reconocidas y atacadas por el sistema inmunitario proporcionan a los investigadores la información necesaria para diseñar vacunas de tratamiento contra el cáncer que puedan lograr ambos objetivos (16,25).
Aunque los investigadores han identificado muchos antígenos asociados con cáncer, estas moléculas varían mucho en su habilidad para estimular una fuerte respuesta inmunitaria contra el cáncer. Dos campos principales de investigación están asignados a responder a este problema. Uno implica la identificación de antígenos novedosos asociados con cáncer, o neo-antígenos, que pueden resultar más efectivos en estimular respuestas inmunitarias que los antígenos que ya se conocen. Por ejemplo, un planteamiento de vacuna personalizada que se basa en neo-antígenos que está en pruebas clínicas en fase inicial comprende la identificación y puesta en el blanco de antígenos mutados específicos a los pacientes para crear vacunas de tratamiento para pacientes con glioblastoma y melanoma(26,27). El otro campo principal de investigación comprende la creación de métodos para incrementar la habilidad de los antígenos asociados con cáncer para estimular al sistema inmunitario. Hay también investigación en curso para determinar cómo combinar muchos antígenos con una sola vacuna de tratamiento de cáncer para producir respuestas inmunitarias óptimas contra el cáncer (28).
Mejorar nuestro entendimiento de la biología básica como fundamento de cómo interactúan las células del sistema inmunitario y las células cancerosas será muy importante para concebir vacunas contra el cáncer. Como parte de este programa, se están creando nuevas tecnologías. Por ejemplo, un nuevo tipo de tecnología con imágenes permite a los investigadores observar las células T citotóxicas y las células cancerosas interactuando dentro del cuerpo (29).
Los investigadores están tratando también de identificar mecanismos por los que las células cancerosas evaden o suprimen las respuestas inmunitarias contra el cáncer. Al comprender mejor en qué forma las células cancerosas manipulan el sistema inmunitario se podría llegar a la formulación de fármacos que bloquean esos procesos, lo que mejoraría la efectividad de las vacunas de tratamiento de cáncer (30).
Por ejemplo, algunas células cancerosas producen señales químicas que atraen glóbulos blancos conocidos como células T reguladoras, o Tregs, al sitio del tumor. Las Tregs liberan con frecuencia citocinas que suprimen la actividad de las células T citotóxicas (18, 31). La combinación de una vacuna de tratamiento de cáncer con un fármaco que impide la inactivación de las células T citotóxicas puede mejorar la efectividad de la vacuna al generar respuestas fuertes de las células T citotóxicas contra el tumor.
Los moduladores inmunitarios de puntos de control pueden también mejorar la efectividad de las vacunas contra cáncer (32). Estos moduladores se apuntan a otro mecanismo inmunitario regulador usado por las células cancerosas para evadir la destrucción, uno que implica las proteínas de puntos de control inmunitarios como el PD-1, el cual se expresa en la superficie de las células T. La unión de PD1 a proteínas compañeras específicas (o ligandos), llamadas PD-L1 y PD-L2, en la superficie de algunas células normales o células cancerosas crea una señal de “apagado” que dice a la célula T que no lance una respuesta inmunitaria contra esas células. (Esta unión hace que el sistema inmunitario no se exceda al actuar contra las células normales e impida la autoinmunidad). Algunas células tumorales expresan altas concentraciones de PD-L1, lo cual causa que las células T se “apaguen” y ayuda a las células cancerosas a evadir la destrucción inmunitaria. Los anticuerpos que bloquean la unión de una proteína de punto de control inmunitario a su ligando en una célula cancerosa eliminan esta señal de “apagado” y permiten que haya una respuesta inmunitaria contra las células cancerosas.
Varios de esos anticuerpos han sido aprobados por la FDA para el tratamiento de algunos cánceres y están mostrando efectos prometedores en otros cánceres (33). Ya que estas sustancias permiten que las células T sean más efectivas contra el cáncer, se espera que ellas también mejorarán la efectividad de las vacunas contra el cáncer. En verdad, se ha encontrado que sí lo hacen en modelos animales, y hay estudios clínicos en curso que combinan una vacuna con inhibición de PD1 o de PD-L1 (34).
Actualmente están en preparación varias vacunas diseñadas para tratar cánceres específicos (35–38). Estas incluyen vacunas con células dendríticas para carcinomametastático de células renales, glioblastoma y cáncer de próstata metastático refractario a hormonas; vacunas autólogas de células tumorales para cáncer colorrectal y linfoma folicular; vacunas antiidiotípicas para linfomas y algunos tumores sólidos; vacunas diseñadas para estimular una respuesta inmunitaria contra hormonas requeridas para el crecimiento y supervivencia de malignidades gastrointestinales; vacunas alogénicas para cáncer de pulmón; y vacuna con base en el ADN para cáncer metastático de seno.
¿Qué tipos de vacunas están siendo evaluadas en estudios clínicos?
La lista de abajo muestra los tipos de cáncer a los que se enfocan estudios clínicos activos patrocinados por el NCI para la prevención o tratamiento de cáncer mediante el uso de vacunas. Los nombres de los cánceres son enlaces a resultados de búsqueda de la lista de estudios clínicos del NCI. Se puede también buscar en esta lista en http://www.cancer.gov/clinicaltrials/search.
Estudios clínicos activos de vacunas de tratamiento de cáncer por tipo de cáncer:
• Cáncer de colon
• Cáncer de cuello uterino
• Cáncer de ovario
• Cáncer de páncreas
• Cáncer de próstata
• Cáncer de pulmón
• Cáncer de riñón
• Cáncer de seno
• Cáncer de vejiga
• Leucemia
• Linfoma de Hodgkin
• Linfoma no Hodgkin
• Melanoma
• Mieloma múltiple
• Tumores de cerebro
• Tumores sólidos
Estudios clínicos activos de vacunas de prevención de cáncer por tipo de cáncer:
• Cáncer de cuello uterino
• Tumores sólidos
Bibliografía selecta
1. Pardoll D. Cancer immunology. In: Abeloff M, Armitage J, Niederhuber J, Kastan M, McKenna W, eds. Abeloff’s Clinical Oncology. 4th ed. Philadelphia: Churchill Livingstone; 2008.
2. Murphy KM, Travers P, Walport M, editors. Janeway’s Immunobiology. 7th ed. New York: Garland Science, 2007.
3. Waldmann TA. Effective cancer therapy through immunomodulation. Annual Review of Medicine 2006; 57:65–81.
[PubMed Abstract]
4. Emens LA. Cancer vaccines: on the threshold of success. Expert Opinion on Emerging Drugs 2008; 13(2):295–308.
[PubMed Abstract]
5. Sioud M. An overview of the immune system and technical advances in tumor antigen discovery and validation. Methods in Molecular Biology 2007; 360:277–318.
[PubMed Abstract]
6. Pazdur MP, Jones JL. Vaccines: an innovative approach to treating cancer. Journal of Infusion Nursing 2007;30(3):173-178.
[PubMed Abstract]
7. Butterfield LH. Cancer vaccines. British Medical Journal 2015; 350:h988.
[PubMed Abstract]
8. Rivoltini L, Canese P, Huber V, et al. Escape strategies and reasons for failure in the interaction between tumour cells and the immune system: how can we tilt the balance towards immune-mediated cancer control? Expert Opinion on Biological Therapy 2005;5(4):463-476.
[PubMed Abstract]
9. Lollini PL, Cavallo F, Nanni P, Forni G. Vaccines for tumour prevention. Nature Reviews Cancer 2006; 6(3):204–216.
[PubMed Abstract]
10. Frazer IH, Lowy DR, Schiller JT. Prevention of cancer through immunization: prospects and challenges for the 21st century. European Journal of Immunology 2007; 37(Suppl 1):S148–S155.
[PubMed Abstract]
11. U.S. Centers for Disease Control and Prevention. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part 1: immunization of infants, children, and adolescents. Morbidity and Mortality Weekly Report 2005; 54(No. RR–16):1–31.
[PubMed Abstract]
12. Rosenberg SA, Yang JC, Restifo NP. Cancer immunotherapy: moving beyond current vaccines. Nature Medicine 2004; 10(9):909–915.
[PubMed Abstract]
13. Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. New England Journal of Medicine 2010;363(5):411-422.
[PubMed Abstract]
14. Berzofsky JA, Wood LV, Terabe M. Cancer vaccines: 21st century approaches to harnessing an ancient modality to fight cancer. Expert Review of Vaccines 2013; 12(10):1115-8. doi: 10.1586/14760584.2013.836906Notificación de salida.
15. Larocca C, Schlom J. Viral vector-based therapeutic cancer vaccines. Cancer Journal2011; 17(5):359-71.
[PubMed Abstract]
16. Parmiani G, Russo V, Marrari A, et al. Universal and stemness-related tumor antigens: potential use in cancer immunotherapy. Clinical Cancer Research 2007; 13(19):5675–5679.
[PubMed Abstract]
17. Parmiani G, De Filippo A, Novellino L, Castelli C. Unique human tumor antigens: immunobiology and use in clinical trials. The Journal of Immunology 2007; 178(4):1975–1979.
[PubMed Abstract]
18. Finn OJ. Cancer immunology. New England Journal of Medicine 2008;358(25):2704-2715.
[PubMed Abstract]
19. Curigliano G, Spitaleri G, Dettori M, et al. Vaccine immunotherapy in breast cancer treatment: promising, but still early. Expert Review of Anticancer Therapy 2007; 7(9):1225–1241.
[PubMed Abstract]
20. Chiarella P, Massi E, De Robertis M, Signori E, Fazio VM. Adjuvants in vaccines and for immunisation: current trends. Expert Opinion on Biological Therapy 2007; 7(10):1551–1562.
[PubMed Abstract]
21. Herr HW, Morales A. History of Bacillus Calmette-Guérin and bladder cancer: an immunotherapy success story. The Journal of Urology 2008; 179(1):53–56.
[PubMed Abstract]
22. Berzofsky JA, Terabe M, Wood LV. Strategies to use immune modulators in therapeutic vaccines against cancer. Seminars in Oncology 2012; 39(3):348-57.
[PubMed Abstract]
23. Emens LA. Chemotherapy and tumor immunity: an unexpected collaboration.Frontiers in Bioscience 2008; 13:249–257.
[PubMed Abstract]
24. Garnett-Benson C, Hodge JW, Gameiro SR. Combination regimens of radiation therapy and therapeutic cancer vaccines: mechanisms and opportunities. Seminars in Radiation Oncology 2015;2 5(1):46-53.
[PubMed Abstract]
25. Renkvist N, Castelli C, Robbins PF, Parmiani G. A listing of human tumor antigens recognized by T cells. Cancer Immunology and Immunotherapy 2001; 50(1):3–15.
[PubMed Abstract]
26. Duan F, Duitama J, Al Seesi S, et al. Genomic and bioinformatic profiling of mutational neoepitopes reveals new rules to predict anticancer immunogenicity. Journal of Experimental Medicine 2014; 211(11):2231-48.
[PubMed Abstract]
27. Kreiter S, Vormehr M, van de Roemer N, et al. Mutant MHC class II epitopes drive therapeutic immune responses to cancer. Nature 2015; 520(7549):692-6.
[PubMed Abstract]
28. Schlom J, Arlen PM, Gulley JL. Cancer vaccines: moving beyond current paradigms.Clinical Cancer Research 2007; 13(13):3776–3782.
[PubMed Abstract]
29. Ng LG, Mrass P, Kinjyo I, Reiner SL, Weninger W. Two-photon imaging of effector T-cell behavior: lessons from a tumor model. Immunological Reviews 2008; 221:147–162.
[PubMed Abstract]
30. Garnett CT, Greiner JW, Tsang KY, et al. TRICOM vector based cancer vaccines. Current Pharmaceutical Design 2006; 12(3):351–361.
[PubMed Abstract]
31. Zou W. Regulatory T cells, tumour immunity and immunotherapy. Nature Reviews Immunology 2006; 6(4):295–307.
[PubMed Abstract]
32. Sharpe AH, Wherry EJ, Ahmed R, Freeman GJ. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection. Nature Immunology 2007; 8(3):239-45.
[PubMed Abstract]
33. Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. New England Journal of Medicine 2012; 366(26):2443-54.
[PubMed Abstract]
34. Kleponis J, Skelton R, Zheng L. Fueling the engine and releasing the break: combinational therapy of cancer vaccines and immune checkpoint inhibitors. Cancer Biology and Medicine 2015; 12(3):201-8.
[PubMed Abstract]
35. Liu JK. Anti-cancer vaccines – a one-hit wonder? Yale Journal of Biology and Medicine2014; 87(4):481-489.
[PubMed Abstract]
36. Singh BH, Gulley JL. Therapeutic vaccines as a promising treatment modality against prostate cancer: rationale and recent advances. Therapeutic Advances in Vaccines 2014; 2(5):137-148.
[PubMed Abstract]
37. Freeman-Keller M, Goldman J, Gray J. Vaccine immunotherapy in lung cancer: Clinical experience and future directions. Pharmacology & Therapeutics 2015; 153:1-9.
[PubMed Abstract]
38. Tiriveedhi V, Tucker N, Herndon J, et al. Safety and preliminary evidence of biologic efficacy of a mammaglobin-a DNA vaccine in patients with stable metastatic breast cancer. Clinical Cancer Research 2014; 20(23):5964-5975.
[PubMed Abstract]
Recursos relacionados
• Terapias biológicas para el cáncer
• Vacunas contra los virus del papiloma humano
• Información sobre estudios clínicos para pacientes y personas a cargo de su cuidado
• Revisión: 18 de diciembre de 2015
Este texto puede copiarse o usarse con toda libertad. Sin embargo, agradeceremos que se dé reconocimient
 Linfocito T atacando un tumor.
Linfocito T atacando un tumor. Evidencia del beneficio de la inmunoterapia en diferentes tumores
Evidencia del beneficio de la inmunoterapia en diferentes tumores CIRUGIA DE TUMORES CEREBRALES, EN ENFERMOS DESPIERTOS.
CIRUGIA DE TUMORES CEREBRALES, EN ENFERMOS DESPIERTOS.