
¿Qué es la metástasis?
Todo el mundo sabe lo que es una metástasis Generalización del tumor
A la metástasis, también se denomina enfermedad diseminada, enfermedad a distancia o enfermedad secundaria.
. Si no hay metástasis se tiene la opción de eliminar el tumor mediante cirugía y existen claras opciones de curación, complementando en muchos casos este tratamiento con quimioterapia y radioterapia. En caso contrario la cirugía no será una opción de tratamiento y éste se centrará en el uso de quimioterapia y radioterapia: será de carácter paliativo y tenderá a aliviar los posibles síntomas, mejorar la calidad de vida y aumentar el tiempo de supervivencia.
Cuando se genera un tumor en cualquier parte del organismo (tumor primario), éste se vasculariza creando sus propios vasos sanguíneos con el fin de alimentarse y de este modo poder sobrevivir y además seguir creciendo. Es un proceso que se conoce como angiogénesis y que facilita que las células cancerosas más competentes pasen al torrente sanguíneo y viajen a través de la sangre y los vasos linfáticos hacia el resto del cuerpo. Si estas células son capaces de traspasar los capilares que llevan la sangre a otros órganos, entonces se asientan en ellos y, si evolucionan y se adaptan a ese nuevo medio, comienzan a reproducirse y a generar un nuevo tumor (tumor secundario).
Otro aspecto importante cuando no se han detectado metástasis es que las células cancerosas que se desplazan a través de los vasos linfáticos llegan a los ganglios y producen un aumento de su tamaño, lo que se conoce como adenopatías
Tampoco es infrecuente que en ocasiones un cáncer sea diagnosticado como consecuencia de los síntomas producidos por una metástasis, como puede ser el dolor causado por una metástasis ósea.
Cuando las células cancerosas procedentes del tumor primario migran a través de la sangre y se asientan en otro órgano, no tiene por qué desarrollarse la metástasis de forma inmediata. De hecho, el cáncer metastásico puede permanecer latente durante años o décadas a pesar de haberse diseminado y comenzar a crecer sin previo aviso de forma muy agresiva.
Todas estas circunstancias hacen que la existencia de metástasis implique un peor pronóstico. Tal es así, que los expertos consideran que el 90% de los fallecimientos por cáncer se producen a causa de las metástasis.
Las células que inician las metástasis son fundamentalmente distintas de las que originan el cáncer los tumores primarios, los tumores primarios se inician por mutaciones genéticas, las metástasis lo hacen reactivando genes que no están mutados pero estaban inactivos.
El objetivo es prevenir las metástasis eliminando la enfermedad residual que queda después de un tratamiento.
Hay dos momentos en que podemos tener la oportunidad de hacerlo.
¿En qué momentos?
Uno es cuando a una persona se le ha detectado un tumor y se le ha eliminado. Ese tumor ha estado allí durante meses o años, liberando una gran cantidad de células malignas a la sangre, antes de ser diagnosticado. La mayoría de las células liberadas a la sangre muere, pero una minoría sobrevive y llega a infiltrar otros tejidos. Aún no forman una metástasis, y tal vez no lo harán nunca. Sobre este proceso no sabíamos nada. Ahora sabemos quiénes son estas células, cómo el sistema inmunitario las mantiene a raya y cómo algunas veces llegan a formar metástasis. Conociéndolas, podremos explotar sus vulnerabilidades y eliminar de manera más efectiva la enfermedad residual.
¿Cuál es el otro momento?
Cuando una persona ya ha tenido una metástasis y ha recibido tratamientos que la han hecho desaparecer. Desafortunadamente, la desaparición no es completa. Quedan células tumorales residuales y la metástasis puede reaparecer al cabo de un tiempo. Pensamos que las células que quedan después del tratamiento vuelven a utilizar los mismos trucos biológicos que sus predecesoras y que por lo tanto tienen las mismas vulnerabilidades, que podremos atacar con fármacos.
¿El objetivo es prevenir la aparición o reaparición de metástasis, más que tratar las metástasis ya existentes?
Como se produce la metástasis y como se generaliza es un problema aún discontinuo precisamente este trabajo es consecuencia de la publicación del Dr. Massagué, es fundamental el conocimiento de la formación de la metástasis porque de ello ha de depender su tratamiento
Si los tumores primarios se inician por mutaciones y las metástasis no, ¿son adecuados para tratar las metástasis los fármacos actuales que atacan mutaciones?
Tenemos todo un arsenal de terapias moleculares y otros tratamientos que hacen desaparecer metástasis declaradas y que tienen al campo de la oncología esperanzado. El reto es hacer desaparecer también la enfermedad residual.
En estos días se ha publicado en la vanguardia varios trabajos sobre la visión que tiene el Doctor Massagué, que cambia la comprensión de la enfermedad y abre la vía a mejorar los tratamientos
_Joan Massagué, investigador del cáncer, en el Instituto Sloan Kettering de Nueva York (Memorial Sloan Kettering Cancer Center)
JOSEP CORBELLA, BARCELONA
Las células que inician las metástasis hackean un mecanismo de reparación natural del cuerpo humano y lo utilizan para extender el cáncer a otros órganos, según ha descubierto el científico Joan Massagué en una serie de investigaciones que cambian completamente la comprensión de las metástasis y abren la vía a nuevas estrategias para prevenirlas y curarlas.
Los resultados muestran que las metástasis:
NO SE INICIAN POR MUTACIONES GENÉTICAS QUE HABILITAN A LAS CÉLULAS DEL TUMOR PRIMARIO PARA MIGRAR A OTROS ÓRGANOS, COMO SE HABÍA ASUMIDO HASTA AHORA. SE PRODUCEN POR UNA REPROGRAMACIÓN DE LAS CÉLULAS, QUE REACTIVAN GENES QUE NO ESTÁN MUTADOS PERO ESTABAN APAGADOS.
Con esta reprogramación, algunas células tumorales adquieren un comportamiento de células madre regenerativas, que es lo que les permite crear las metástasis.
Para Massagué, director del Instituto Sloan Kettering de Nueva York, este descubrimiento supone la culminación de una línea de trabajo que inició hace casi veinte años, cuando decidió investigar la biología de las metástasis, pues son la causa de cerca del 90% de de las muertes por cáncer. Hasta entonces, las investigaciones sobre las bases biológicas del cáncer se habían focalizado en los tumores primarios.
Desde el año 2003, Massagué y otros investigadores que han seguido su estela han descrito multitud de alteraciones genéticas presentes en metástasis causadas por diferentes tipos de tumores. Pero “hay tantos genes especializados en metástasis que uno no sabe por dónde empezar; además, su aplicación clínica es limitada”, explica el científico, para quien mejorar el tratamiento de los pacientes es una prioridad.
“Por eso dirigí las investigaciones a identificar el programa central de las células iniciadoras de metástasis. Ahora lo tenemos”. Este programa central, añade, ofrece “una nueva visión de la metástasis”.
El descubrimiento cambia la comprensión de cómo las células tumorales colonizan órganos distantes
En una investigación presentada esta semana en la revista Nature Cancer , Massagué y su equipo demuestran que las células que inician las metástasis utilizan de manera maliciosa un mecanismo que, en los tejidos sanos, es beneficioso.
SE TRATA DE UN MECANISMO QUE PERMITE REGENERAR LOS TEJIDOS CUANDO SUFREN UNA ROTURA.
Para ello, las células segregan una molécula llamada L1CAM que favorece la adhesión entre células y permite sellar las heridas. Esta misma molécula es utilizada por algunas de las células que escapan de un tumor para adherirse a otros tejidos e iniciar las metástasis.
Trabajos anteriores del laboratorio de Massagué habían detectado que L1CAM está presente en metástasis procedentes de distintos tipos de tumores (mama, pulmón, riñón y colorrectal) que afectan a distintos órganos (cerebro, pulmón, hígado y hueso). El nuevo trabajo, basado en tumores colorrectales, revela el mecanismo por el que L1CAM inicia las metástasis.
Los resultados muestran que las metástasis no se producen por una selección natural de células del tumor primario con mutaciones genéticas que las habilitan para colonizar otros órganos. “Olvidémonos de las mutaciones que causan metástasis. No hay muchas, tal vez ninguna”, declara Massagué.
“Este concepto de que las células que causan metástasis no adquieren mutaciones nuevas es novedoso e importante”, señala Joaquín Arribas, investigador Icrea en el Instituto de Oncología de Vall d’Hebron (VHIO) que se formó en el laboratorio de Massagué en Nueva York en los años 90. “Cambia el campo de juego de la investigación sobre metástasis”.
Una de las implicaciones de este descubrimiento es que las células madre que causan los tumores primarios son distintas de las que causan metástasis. Por lo tanto, los modelos basados en el crecimiento de tumores primarios no son adecuados para comprender las metástasis ni para ensayar fármacos contra ellas.
Olvidémonos de las mutaciones que causan metástasis. No hay muchas, tal vez ninguna”
JOAN MASSAGUÉ Director de la investigación
Una segunda investigación del laboratorio de Massagué presentada la semana pasada en Nature confirma que las metástasis se deben a la reprogramación de células tumorales, que adquieren propiedades de células madre regenerativas. En este caso la investigación se ha centrado en metástasis hepáticas de cáncer de páncreas. Los resultados identifican las moléculas que permiten a las células tumorales atrincherarse en el hígado. Se trata de moléculas implicadas en el desarrollo embrionario y en la fibrosis –la formación de tejido conectivo, como en una cicatriz–, lo que indica que el proceso de metástasis se basa en la reprogramación.
Una tercera investigación dirigida por Massagué que ha explorado las metástasis causadas por tumores pulmonares apunta en la misma línea.
“Partiendo desde diferentes perspectivas y estudiando diferentes tipos de tumor, llegamos al resultado común de que las metástasis están causadas por células tumorales que actúan como células madre regenerativas”, resume Massagué.
El avance clave
Las metástasis se producen por una reprogramación de las células, que reactivan genes que no están mutados pero estaban apagados
Estos trabajos “confirman que las metástasis son un proceso muy complejo”, destaca Joan Seoane, que fue investigador posdoctoral en el laboratorio de Joan Massagué de 1998 al 2003 y actualmente es investigador Icrea en el Instituto de Oncología de Vall d’Hebron (VHIO). “Sólo si comprendemos esta complejidad podremos desarrollar tratamientos eficaces contra las metástasis”, que es uno de los grandes retos pendientes de la investigación del cáncer. “Los nuevos resultados son un avance relevante hacia este objetivo”.
Precisamente con el objetivo de trasladar los resultados de sus investigaciones a los pacientes, el equipo de Massagué ha desarrollado anticuerpos contra la molécula L1CAM –la que permite a las células que escapan de un tumor adherirse a otros tejidos–. En ensayos con cultivos de células tumorales de pacientes, estos anticuerpos han resultado altamente eficaces contra aquellas células que tienen niveles elevados de la molécula.
Sólo si comprendemos la complejidad de las metástasis podremos desarrollar tratamientos eficaces”JOAN SEOANE Investigador del Instituto de Oncología de Vall d’Hebron (VHIO)
El equipo del Instituto Sloan Kettering ha iniciado ensayos de los anticuerpos en ratones para tratar metástasis incipientes. También tiene ensayos en curso en ratones para tratar de eliminar las células metastásicas que puedan quedar después de tratamientos de quimioterapia o inmunoterapia.
“Desarrollar fármacos contra las metástasis es más complicado que hacerlo contra los tumores primarios, porque comprendemos peor la biología de las metástasis y porque los ensayos clínicos serán más largos y costosos”, advierte Eduard Batlle, investigador Icrea en el Institut de Recerca Biomèdica de Barcelona (IRB). “Pero tenemos que aprender a prevenir y tratar las metástasis para seguir reduciendo la mortalidad del cáncer. Los nuevos resultados de Joan Massagué son un avance muy importante en esta dirección”.
Este trabajo puede aclarar cómo se producen las metástasis, pero no como se curan. De forma que estamos donde antes necesitamos ahora que hemos descubierto cómo se producen y tenemos que aprender cómo se curan.
Nuestras ganas de solucionar el problema, no no proporcionan una solución hay que seguir.
Ha sentado las bases para comprender los distintos aspectos del problema en toda su complejidad, incluyendo cómo las células salen del tumor primario, cómo sobreviven en el torrente sanguíneo, cómo se evaden del sistema inmunitario, cómo anidan en un órgano distante, cómo se mantienen durante años en un estado de latencia y cómo después vuelven a proliferar”, destaca Eduard Batlle, del IRB.
Karuna Ganesh y Joan Massagué, investigadores del Instituto Sloan Kettering de Nueva York (Memorial Sloan Kettering Cancer Center)
Joan Massagué, investigador del cáncer, en el Instituto Sloan
Kettering de Nueva York (Memorial Sloan Kettering Cancer Center)
JOSEP CORBELLA, BARCELONA
15/01/2020 06:00Actualizado a15/01/2020 22:14
 watch
watch
 .
.
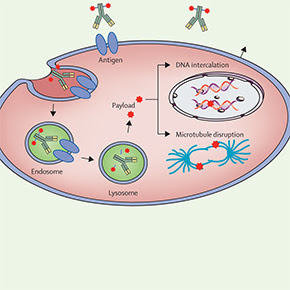 La inmunoterapia, también denominada terapia biológica, es un tipo de tratamiento para el cáncer que estimula las defensas naturales del cuerpo a fin de combatir el cáncer. Utiliza sustancias producidas por el cuerpo o fabricadas en un laboratorio para mejorar o restaurar la función del sistema inmunitario. La inmunoterapia puede actuar:
La inmunoterapia, también denominada terapia biológica, es un tipo de tratamiento para el cáncer que estimula las defensas naturales del cuerpo a fin de combatir el cáncer. Utiliza sustancias producidas por el cuerpo o fabricadas en un laboratorio para mejorar o restaurar la función del sistema inmunitario. La inmunoterapia puede actuar:
 Terapia con linfocitos T-CAR:
Terapia con linfocitos T-CAR: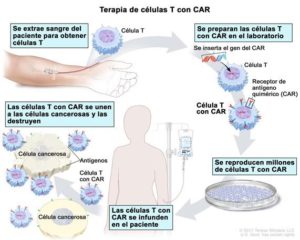
 LAS SINAPTOPATÍAS AUTOINMUNES
LAS SINAPTOPATÍAS AUTOINMUNES