 Los gérmenes en las enfermedades degenerativas
Los gérmenes en las enfermedades degenerativas
Filed under: DEGENERATIVAS — Enrique Rubio @ 15:47
Los gérmenes en las enfermedades degenerativas Introducción.
Este trabajo trata de encontrar una relación entre las enfermedades degenerativas y sobre todo neuro degenerativas y patógenos. Sobre todo, gérmenes. Buscando los datos exclusivamente en la literatura.
El trabajo de Kevin Tracey sobre el cambio de patología después de la revolución industrial , marca un hito para comprender la etiopatogenia de estas enfermedades.
Las enfermedades degenerativas tales como : enfermedad de Parkinson, ELA, esclerosis múltiple, enfermedad de Hungtintom entre otras, comparten. Una alteración de la microbiota, una emigración de germenes desde las grandes cavidades organicas, estos germenes se asientan en toda nuestra biología, por supuesto incluyendo el sistema nervioso, una reacción por parte del receptor y un intento de reparación del sistema inmunitario y como consecuencias, el depósito de Macrófagos que inutilizan parcial o totalmente al receptor.
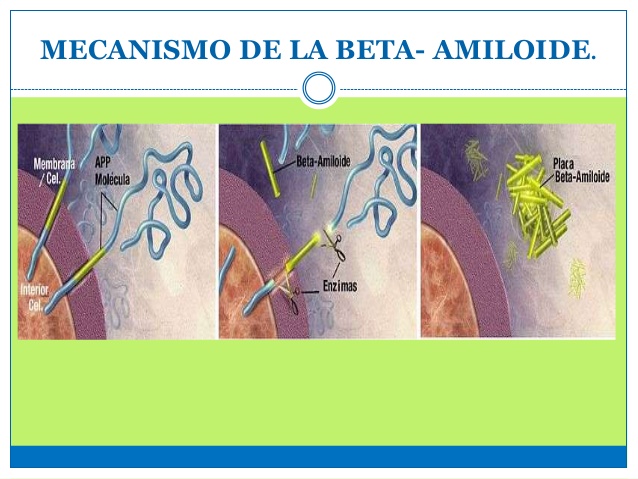
Las placas amiloide: La Tau y los cuerpos de Lewy con su toxico la sinucleina, dañan el parénquima y lo inutilizan progresivamente .
A este comportamiento, en forma de algoritmo, lo vamos a llamar por simplicar “ endiquela EN” que es una palabra gitana que significa “mirar lo que quiere expresar”.
Es imprescindible conocer la reacción inflamatoria ante el patógeno agresor.
No hace falta mencionar que los agentes polulantes son los responsable, tenga o no una alteración genética previa, y es necesario ver si ese patogeno es orgánico o incluso inorganico.
Las enfermedades neurodegenerativas son crónicas y afectan entre otros parénquimas, el sistema nervioso central (SNC)
1 Se caracterizan por cambios moleculares y genéticos en las células nerviosas que producen su degeneración, la disfunción nerviosa y la muerte, y en el intervalo, dan signos neurológicos y demencia.1,
2 . Las enfermedades neuroconductuales aparecen pero no exclusivamente en los jóvenes, con trastornos del espectro autista (ASD) que abarcan el autismo, el trastorno por déficit de atención, el síndrome de Asperger y otros trastornos
3. Los cambios geneticos que se han encontrado en estas enfermedades son complejos y no están directamente relacionados con las simples alteraciones genéticas.1,
4. Un amplio conjunto de circcunstancias colaboran en estas patologias: deficiencias alimenticias, toxinas ambientales, metales pesados, infecciones bacterianas y virales crónicas, respuestas inmunológicas autoinmunes, enfermedades vasculares, los traumatismos son causas importantes, acumulación de líquido en el cerebro, cambios en las concentraciones de neurotransmisores, entre otras, están involucradas en la patogenia de diversas enfermedades neurodegenerativas y neuroconductuales.1-3-5-8
5. Uno de los cambios bioquímicos encontrados en todas las enfermedades neurológicas, neurodegenerativas y neuroconductuales es la sobreexpresión de los compuestos radicales libres de oxidación (estrés oxidativo) que causan cambios estructurales de lípidos, proteínas y genéticas.5-9
El estrés oxidativo puede ser causado por una variedad de insultos tóxicos en el medio ambiente, y cuando se combinan con factores genéticos, pueden producirse procesos patógenos.10 La alteracion de la inmunidad o su exceso, la promoción de la enfermedad neurológica implica los productos tóxicos bacterianos o virales crónicos, que dan lugar a la presencia del exceso de especies reactivas del oxígeno y culminan en cambios patológicos.11, 12
Los agentes infecciosos pueden entrar en el SNC dentro de los macrófagos migratorios infectados, pueden obtener acceso atravesando la barrera hemato-encefálica, o entran en las celulas desde los nervios periféricos.11
Dentro de los germenes responsables o supuestamente responsables, las bacterias alteradas de la pared celular, principalmente especies de Chlamydia (Chlamydophila), Borrelia, Brucella (entre otros), bacterias sin paredes celulares, tales como Mycoplasma especies, y varios virus son los agentes infecciosos candidatos que pueden desempeñar papeles importantes en enfermedades neurodegenerativas y neurobehavoral.12-14 Estas infecciones pueden afectar al sistema inmune y a otros sistemas del órganismo, dando por resultado una variedad de lesiones y síntomas sistémicos.15-18
De forma que prácticamente todos los agentes patógenos que conocemos y muchos que no conocemos de forma arbitraria u organizada son capaces de producir una enfermedad neurodegenerativa
Empezaremos por hacer una revision de los germenes en este tipo de enfermedades.
Una variante de la actuacion de los germenes en la induccin de enfermedades degenerativas, publicacion en El genoma del herpesvirus-6A humano latente se integra específicamente en los telómeros de los cromosomas humanos in vivo e in vitro.
Información del autor
Investigaciones anteriores han sugerido que el herpesvirus-6 humano (HHV-6) puede integrarse en los cromosomas de la célula huésped y transmitirse verticalmente en la línea germinal, pero la evidencia, principalmente la hibridación de fluorescencia in situ (FISH), es indirecta. Buscamos, primero, probar de manera definitiva estas dos hipótesis. Se aislaron células mononucleares de sangre periférica (PBMC, por sus siglas en inglés) de familias en las que varios miembros, incluidos al menos un padre y un niño, tenían números de copias inusualmente altos de ADN de HHV-6 por mililitro de sangre. FISH confirmó que el ADN del HHV-6 se localizó en regiones teloméricas de un alelo en los cromosomas 17p13.3, 18q23 y 22q13.3, y que el sitio de integración era idéntico entre los miembros de la misma familia. La integración del genoma de HHV-6 en las repeticiones de los telómeros TTAGGG se confirmó mediante métodos adicionales y la secuenciación del sitio de integración. La secuenciación parcial del genoma viral identificó la misma cepa HHV-6A integrada dentro de los miembros de las familias, lo que confirma la transmisión vertical del genoma viral. A continuación, preguntamos si la infección por HHV-6A de líneas celulares ingenuas podría conducir a la integración. Tras la infección de las líneas celulares Jjhan y HEK-293 por HHV-6, el virus se integró en los telómeros. La reactivación del virus HHV-6A integrado a partir de las PBMC de los individuos, así como las líneas celulares, se logró con éxito mediante compuestos que se sabe inducen la replicación del virus herpes latente. Finalmente, no se detectaron formas episómicas circulares, ni siquiera mediante PCR. En conjunto, los datos sugieren que el HHV-6 es único entre los herpesvirus humanos: se integra de manera específica y eficiente en los telómeros de los cromosomas durante la latencia en lugar de formar episodios,
Bibliografía
Arbuckle JH 1 , Medveczky MM , Luka J , Hadley SH , Luegmayr A , Ablashi D , Lund TC , Tolar J , De Meirleir K , Montoya JG , Komarto AL , Ambros PF , Medveczky PG . Lancet


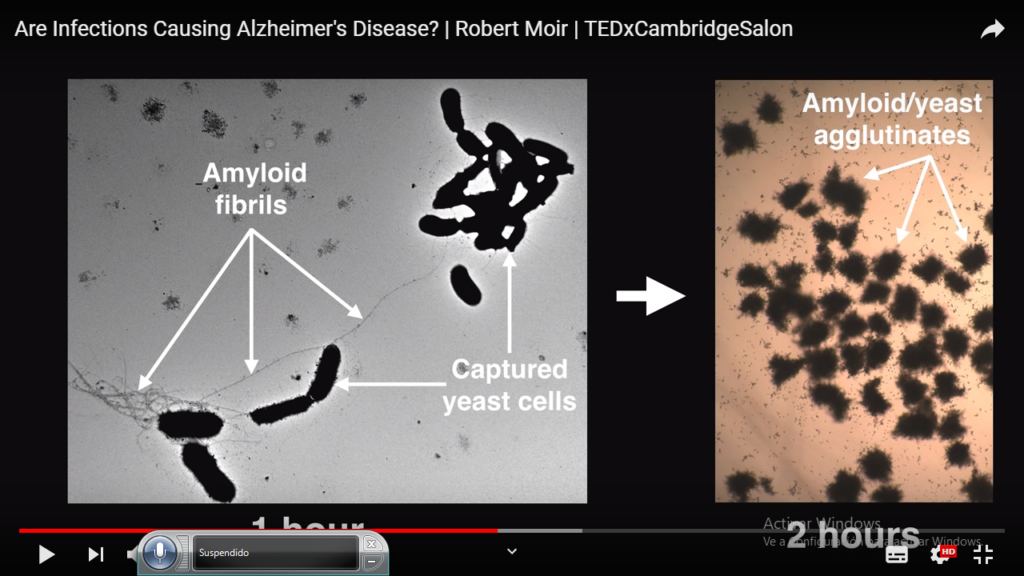
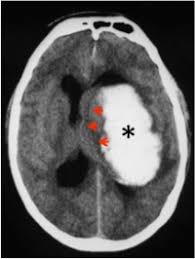 Hemorragia intracerebral y amiloidosis primaria
Hemorragia intracerebral y amiloidosis primaria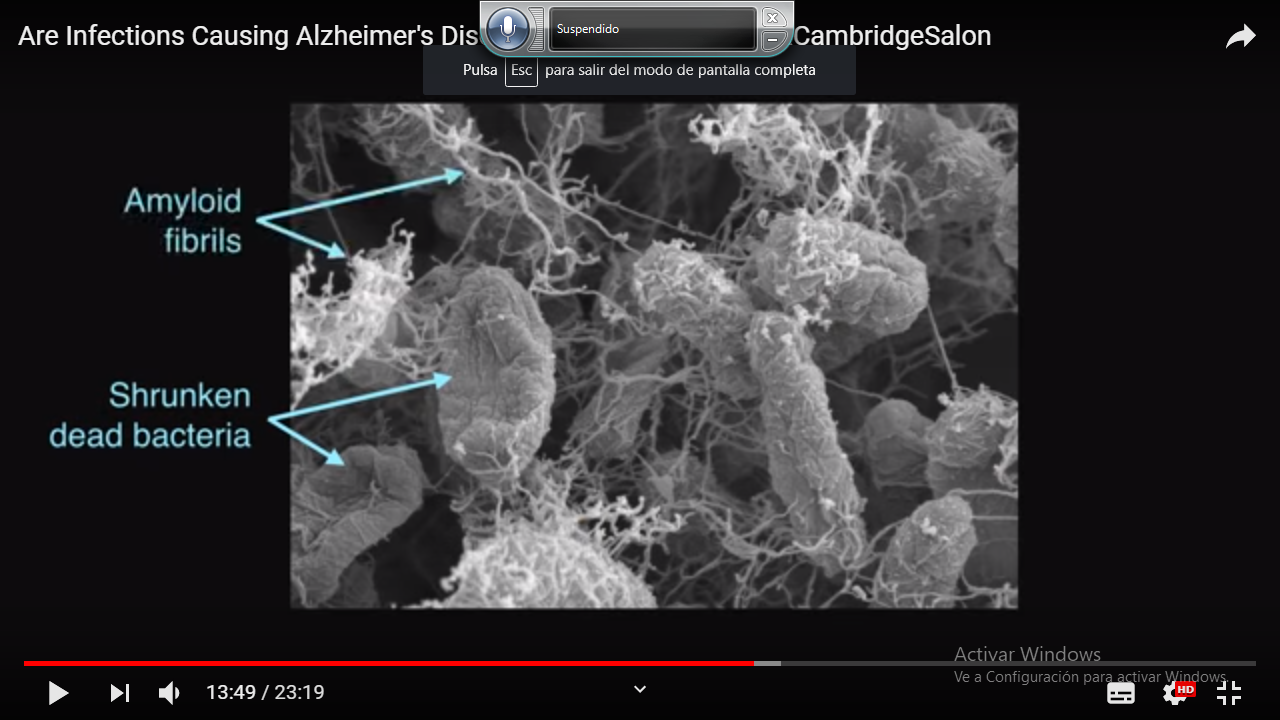
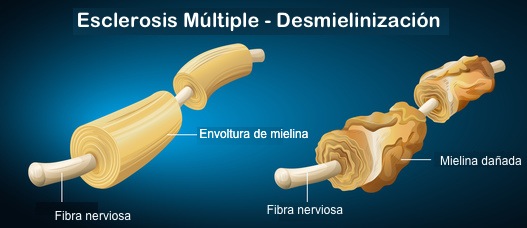
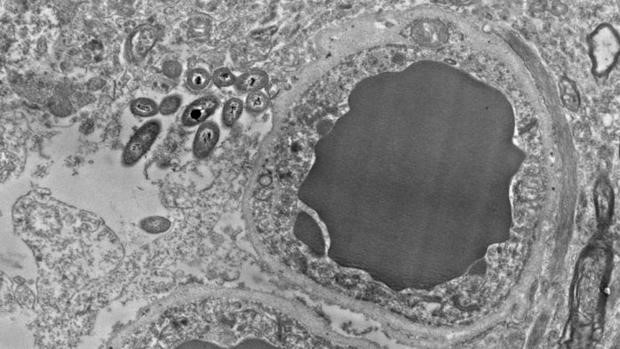 BACTERIAS INTESTINALES DENTRO DEL CEREBRO HUMANO
BACTERIAS INTESTINALES DENTRO DEL CEREBRO HUMANO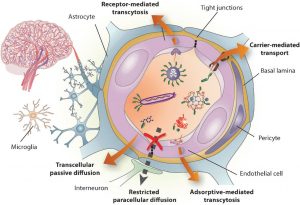 Barrera Hematoencefalica
Barrera Hematoencefalica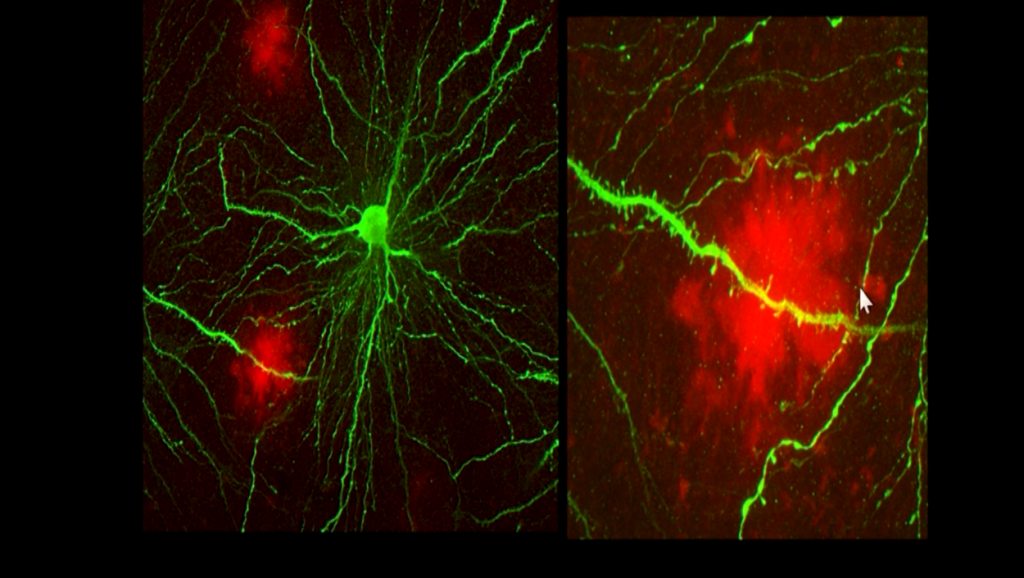
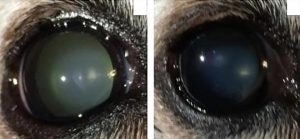 CATARATAS Y AMILOIDE
CATARATAS Y AMILOIDE