e
EL PÉPTIDO, LL-37 EN EL PARKINSON. EL SINDROME DE LA EMPANADA

nvestigadores de la Universitat Autónoma de Barcelona (UAB) y de la Universidad de Zaragoza (UniZar) han identificado una molécula que bloquea las formas tóxicas de la proteína que da paso al Parkinson. Se trata de un péptido humano (un tipo de molécula) presente en el cerebro que bloquea los agregados de alfa-sinucleína (una proteína neuronal) implicados en la enfermedad y que evita su neurotoxicidad.
Este péptido humano se encuentra de forma natural en nuestro organismo.
Representación esquemática de la unión del péptido humano LL-37 a los oligómeros tóxicos de alfa-sinucleína bloqueando su propagación y evitando su neurotoxicidad.irantzu pallarès (ibb)
Los cuerpos de Lewy y el Parkinson
Hasta ahora se pensaba que la difusión de los cuerpos de Lewy reflejaba el curso clínico de la enfermedad de Parkinson, pero estudios recientes sugieren que no son la causa principal de la muerte celular.
En el estudio “Disentangling the Relationship between Lewy Bodies and Nigral Neuronal Loss in Parkinson’s Disease” publicado en Journal of Parkinson’s Disease no se encuentran datos que apoyen un papel patogénico principal de los cuerpos de Lewy, ya que ni su distribución ni su densidad se asociaron con la intensidad de la pérdida celular en la sustancia negra.
El estudio analizó la relación entre la pérdida de células dopaminérgicas en la sustancia negra, la distribución y densidad de cuerpos de Lewy inmunorreactivos a alfa-sinucleína, y la duración de síntomas motores en 97 pacientes con parkinson, 63 hombres y 34 mujeres de edades comprendidas entre 40 y 92 años.
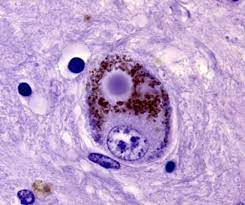
(a) imagen transversal del cerebro medio a nivel del nervio craneal tercero muestra cómo los dos niveles de la substantia nigra pars compacta (SNpc) (dorsal, ventral y SNCD, SNCV) fueron representados (adaptado de Halliday 2004). (b y c) Las microfotografías que representan la heterogeneidad en la cantidad de pigmento neuronas nigral entre dos pacientes con EP y duración de la enfermedad similar. (b) paciente con Parkinson durante 27,5 años recuento de células 7.0/mm2, (c) paciente con Parkinson durante 1 año, con un recuento de células 27.0, 21.8/mm2.
Se apreció que no había correlación significativa entre la duración de la enfermedad de Parkinson y la edad de la muerte (r =- 0.07, p = 0,51), pero sí había una correlación negativa significativa entre la edad de inicio y la duración de la enfermedad (r =- 0.68, p <0,001), es decir, cuando el inicio de la enfermedad era más tardío, la supervivencia era más corta.
A pesar de la correlación razonablemente estrecha entre la densidad neuronal en la sustancia negra y la gravedad de la bradicinesia y la rigidez en los pacientes, los resultados sugieren que la pérdida celular es gradual y muy variable, lo que podría explicar la heterogeneidad clínica.
Investigadores de la Universitat Autónoma de Barcelona (UAB) y de la Universidad de Zaragoza (UniZar) han identificado una molécula que bloquea las formas tóxicas de la proteína que da paso al Parkinson. Se trata de un péptido humano (un tipo de molécula) presente en el cerebro que bloquea los agregados de alfa-sinucleína (una proteína neuronal) implicados en la enfermedad y que evita su neurotoxicidad.
El estudio, publicado en Nature Communications, sugiere que puede ser un mecanismo natural del organismo para combatir la agregación. Según señalan los dos centros universitarios en un comunicado, este hallazgo puede ayudar a desarrollar nuevas estrategias terapéuticas y de diagnóstico para la enfermedad de Parkinson, así como otros sinucleinopatías.
La muerte de las neuronas especializadas en la síntesis de dopamina, uno de los principales neurotransmisores cerebrales, deteriora las capacidades motoras y cognitivas de las personas afectadas por la enfermedad de Parkinson. En la pérdida de estas neuronas está implicada la agregación de la alfa-sinucleína, de la que estudios recientes indican que los oligómeros, los agregados iniciales de esta proteína, son las verdaderas formas patogénicas y los responsables de la propagación de la enfermedad en el cerebro.
En este sentido, neutralizar estos oligómeros y ralentizar su progresión es una de las maneras de detener la enfermedad. Una colaboración científica entre investigadores del Instituto de Biotecnología y de Biomedicina (IBB) de la UAB y el Instituto de Biocomputación y Física de Sistemas Complejos (BIFI) de la UniZar ha identificado ahora un péptido endógeno humano que se une fuerte y específicamente a los oligómeros de alfa-sinucleína, evitando su agregación y bloqueando su neurotoxicida, dos procesos íntimamente ligados al declive neurodegenerativo que ocurre en el Parkinson.
El péptido, llamado LL-37, «se une a los oligómeros tóxicos de alfa-sinucleína de forma selectiva y con una potencia superior a la de cualquier péptido anteriormente descrito, equivalente a la de un anticuerpo. Inhibe la agregación a concentraciones muy bajas y protege totalmente a las células neuronales del daño causado”, señalan los investigadores.
Los péptidos antibióticos de origen eucariótico (PAE) son componentes esenciales de la inmunidad innata. Actúan en secreciones, epitelios y fagocitos profesionales como primera barrera defensiva frente a las invasiones por patógenos. Su interés clínico se debe a dos de sus características generales: amplio rango de patógenos susceptibles y muy baja inducción de resistencias. Ambas se derivan de su mecanismo de acción: la permeabilización de la membrana del patógeno por interacción con los fosfolípidos aniónicos de la cara externa de la membrana
“LL-37 se encuentra de manera natural en nuestro organismo, tanto en el cerebro como en el intestino, órganos donde tiene lugar la agregación de alfa-sinucleína en la enfermedad de Parkinson. Esto sugiere que la actividad de LL-37 puede responder a un mecanismo desarrollado por el propio organismo para luchar de manera natural contra la enfermedad”, añaden.
Por este motivo, los investigadores quieren estudiar ahora cómo se podría regular su expresión y si esta estrategia podría convertirse en una terapia segura con potencial para incidir en el curso de la enfermedad. “Existe la posibilidad de que una terapia para el Parkinson se encuentre ya en nuestro interior y sólo debamos activarla de la manera adecuada”, apunta Salvador Ventura, investigador del IBB y coordinador del estudio.
La identificación de la LL-37 se ha hecho en el marco de una investigación que ha analizado la estructura y características de los oligómeros patogénicos para poder neutralizarlos de manera específica y con alta afinidad.
Los ensayos han permitido a los investigadores identificar tres moléculas con actividad antiagregante, y además de la molécula humana, se ha encontrado un segundo péptido presente en bacterias y un tercero que han construido artificialmente. Estas moléculas son herramientas que consideran prometedoras para el diagnóstico del Parkinson, en discriminar entre las especies de alfa-sinucleína funcionales y las tóxicas.
“Hasta la fecha, no existían moléculas capaces de identificar de manera selectiva y eficiente los agregados tóxicos de alfa-sinucleína; los péptidos que presentamos en este sentido son únicos y, por tanto, tienen un gran potencial como herramientas de diagnóstico y pronóstico”, señala la co-coordinadora del estudio Nunilo Cremades, investigadora del BIFI-UniZar.
En el estudio se han analizado computacionalmente más de 25.000 péptidos humanos y se han aplicado métodos de espectroscopia de molécula única e ingeniería de proteínas. También se han hecho cultivos celulares in vitro utilizando oligómeros tóxicos.
Es decir después de leer esto, sabemos que los cuerpos de Levy y la alfa-sinucleína, son responsables de las lesiones de la sustancia negra en la enfermedad de Parkinson, investigadores del Instituto de Biotecnología y de Biomedicina (IBB) de la UAB y el Instituto de Biocomputación y Física de Sistemas Complejos (BIFI) de la UniZar ha identificado ahora un péptido endógeno humano que se une fuerte y específicamente a los oligómeros de alfa-sinucleína, evitando su agregación y bloqueando su neurotoxicida, dos procesos íntimamente ligados al declive neurodegenerativo que ocurre en el Parkinson.
El péptido, llamado LL-37, «se une a los oligómeros tóxicos de alfa-sinucleína de forma selectiva y con una potencia superior a la de cualquier péptido anteriormente descrito, equivalente a la de un anticuerpo. Inhibe la agregación a concentraciones muy bajas y protege totalmente a las células neuronales del daño causado.
De forma pues que tenemos los cuerpos de Lewy, que están compuestos por la sinucleina, son los que se depositan sobre las células dopaminérgicas de la sustancia Nigra, y las anula y ahora encontramos que el péptido, llamado LL-37, limita a la alfa, sinucleina.
Y que esto puede ser un futuro para el tratamiento de esta enfermedad.
Cabe preguntarse?,
¿Porque se depositan los cuerpos de Lewy y su compuesto la alfa, sinucleina sobre las neuronas dopaminérgicas de la sustancia Nigra y porque sobre esta se deposita el péptido, llamado LL-37.
Estamos formando una empanada, y si esperamos algo de tiempo, veremos como otro macrófago se depòsita sobre el pectido LL-37, y así sucesivamente HASTA FORMAR UNA AMPANADA
La pregunta obvia, es que hay en la sustancia negra que invita a que sobre ellas se depositen sucesivos macrófagos.
La repetida idea de que la rotura de la Microbiota intestinal, hacen que determinados gérmenes invadan el cerebro entre otras estructuras. Invitan a pensar que el causante principal del deposito ulterior de sucesivos macrófagos, son gérmenes, y estos son los responsables de la enfermedad y los causantes de que sobre ellos se depositen macrófagos.
Este esquema seria extrapolable a otras enfermedades neurodegenerativas, como Alzheimer
Es bastante probable que las enfermedades degenerativas y concretamente las neurodegenerativas, tengan un patrón microbiano y desde aquí desarrollen una respuesta inmunitaria que sea responsable de la destrucción cerebral.
Le podríamos llamar a las enfermedades neurodegenerativas en su evolución, que tienen el SÍNDROME DE LA EMPANADA.
Sobre un germen se depositan macrófagos sucesivamenente, como si fuere una empanada
Un germen, la alfa sinucleina y el péptido, llamado LL-37
BIBLIOGRAF??A
Innate immune recognition. Annu Rev Immunol 2002;20:197-216.
Cationic peptides: Effectors in innate immunity and novel antimicrobials. Lancet Infect Dis 2001;1:156-64.
2002. Disponible en: http://www.bbcm.univ.trieste.it/~tossi/pag1.htm. 650 pantallas. Consultada el 30 de julio de 2002.
Animal antimicrobial peptides: An overview. Biopolymers 1998;47:415-33.
Defensins of vertebrate animals. Curr Opin Immunol 2002;14:96-102.
Human b -defensin 4: A novel inducible peptide with a specific salt-sensitive spectrum of antimicrobial activity. FASEB J 2001;15:1819-21.
Retrocyclin: A primate peptide that protects cells from infection by T- and M-tropic strains of HIV-1. Proc Natl Acad Sci USA 2002;99:1813-8.
Cathelicidins: A family of endogenous antimicrobial peptides. Curr Opin Hematol 2002;9:18-22.
Human salivary histatins: promising anti-fungal therapeutic agents. Crit Rev Oral Biol Med 1998;9:480-97.
Dermcidin: A novel human antibiotic peptide secreted by sweat glands. Nat Immunol 2001;2:1133-7.
A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload. J Biol Chem 2001;276:7811-9.
Thrombocidins, microbicidal proteins from human blood platelets, are C-terminal deletion products of CXC chemokines. J Biol Chem 2000;275:20374-81.
Antimicrobial polypeptides in host defense of the respiratory tract. J Clin Invest 2002;109:693-7.
Antimicrobial proteins and peptides of blood: Templates for novel antimicrobial agents. Blood 2000;96:2664-72.
From innate immunity to de novo designed antimicrobial peptides. Curr Pharm Des 2002;8:715-25.
The human salivary peptide histatin 5 exerts its antifungal activity through the formation of reactive oxygen species. Proc Natl Acad Sci USA 2001;98:14637-42.
Deficiency of antibacterial peptides in patients with morbus Kostmann: An observation study. Lancet 2002;360:1144-9.
Human b -defensin-1 is a salt-sensitive antibiotic in lung that is inactivated in cystic fibrosis. Cell 1997;88:553-60.
Innate antimicrobial peptide protects the skin from invasive bacterial infection. Nature 2001;414:454-7.
How do bacteria resist human antimicrobial peptides? Trends Microbiol 2002;10:179-86.
Salmonella typhimurium outer membrane remodeling: Role in resistance to host innate immunity. Microbes Infect 2001; 3:1327-34.
Innate immunity and the normal microflora. Immunol Rev 2000;173:5-16.
Mammalian defensins in immunity: More than just microbicidal. Trends Immunol 2002;23:291-6.
Polymyxin B-resistant Acinetobacter baumanii clinical isolate susceptible to recombinant BPI21 and cecropin P1. Antimicrob. Agents Chemother 2001;44:1035-40.
Activities of polymyxin B and cecropin A-melittin peptide CA(1-8)M(1-18) against a multiresistant strain of Acinetobacter baumannii. Antimicrob Agents Chemother 2002;46:875-8.
A component of innate immunity prevents bacterial biofilm development. Nature 2002;417:552-5.
Synthesis of antibiotic peptides. En: Dutton CJ, Haxell MA, McArthur HIA, Wax RG, editors. Peptide antibiotics: discovery, modes of action and applications. New York: Marcel Dekker, 2002; p. 15-46.
Augmentation of innate host defense by expression of a cathelicidin antimicrobial peptide. Infect Immun 1999;67:6084-9.
99Tc-labeled antimicrobial peptides for detection of bacterial and Candida albicans infections. J Nucl Med 2001;42:788-94.
Discovery of five conserved β-defensin gene clusters using a computational search strategy. Proc Natl Acad Sci USA 2002;99:2129-33.