BIOMARCADORES,
Un biomarcador es una molécula biológica que se encuentra en la sangre, otros líquidos o tejidos del cuerpo, y cuya presencia es un signo de un proceso normal o anormal, de una afección o de una enfermedad. Son indicadores de un estado biológico y deben poder medirse objetivamente y ser evaluado como un indicador de un proceso biológico normal, estado patogénico o de respuesta a un tratamiento farmacológico.1 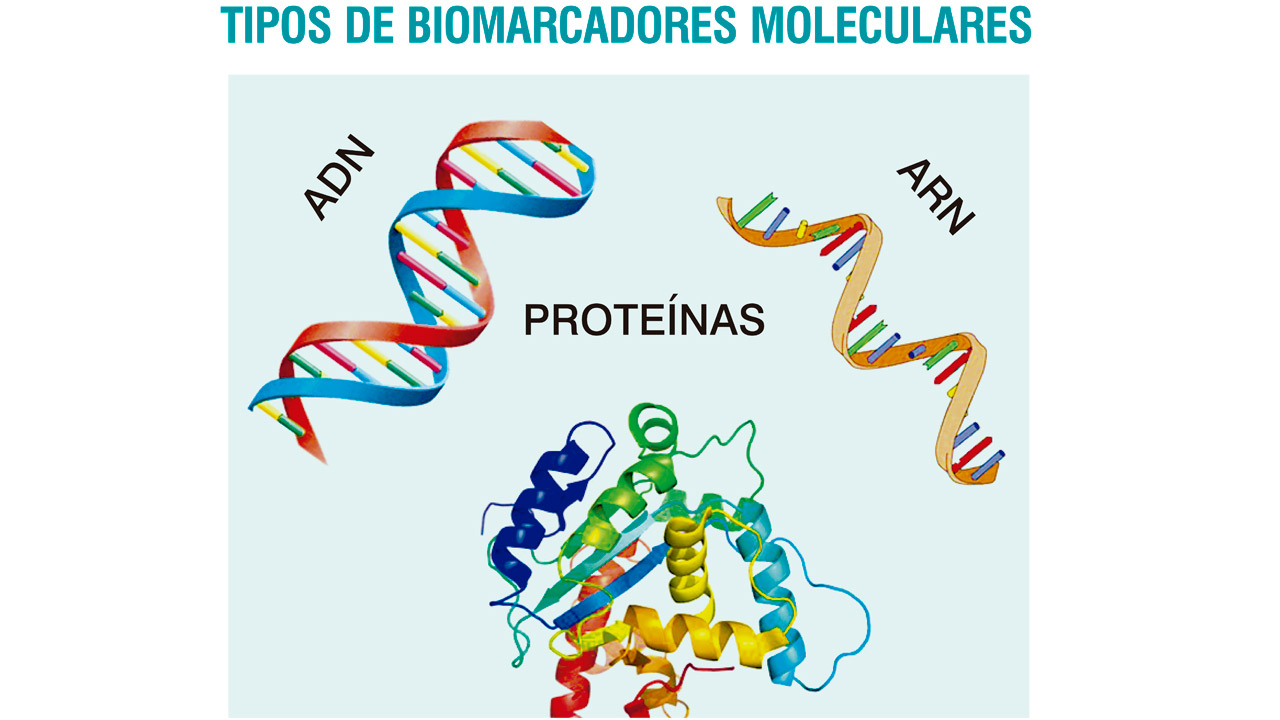
Los biomarcadores son medidas en los niveles molecular, bioquímico o celular, tanto en poblaciones naturales provenientes de hábitats contaminados, como en organismos expuestos experimentalmente a contaminantes. Este indicador señala la exposición del organismo a sustancias tóxicas y la magnitud de la respuesta del organismo al contaminante
El uso de biomarcadores puede servir para poder alcanzar terapias personalizadas. El proceso por el que se encuentran biomarcadores es el siguiente: Un fármaco puede ser aplicado a un grupo heterogéneo de pacientes, entre estos podremos distinguir a los que responden de manera adecuada a dicho tratamiento, y a los que no. Mediante la aplicación de las llamadas «omicas» se puede llegar a obtener un patrón genético que distinga a dichos grupos. De esta manera se obtiene un biomarcador que nos reportará qué individuos responderán bien a dicho tratamiento y podremos así aplicar una terapia personalizada. Pero el mero hecho de descubrir el biomarcador no lo es todo, es decir, hay que validar dicho descubrimiento. Para ello, se escoge a otro grupo heterogéneo de personas y se les hace un perfil genético observando si dicho biomarcador está o no presente y por tanto, prediciendo si responderán bien a dicha terapia. Tras ello, se aplicará el fármaco y si los resultados obtenidos son los esperados, el biomarcador quedará validado. 7
Los biomarcadores son parte de las nuevas herramientas usadas en medicina o medicina de precisión. Se clasifican en 3 formas de acuerdo con sus aplicaciones clínicas. Estas clasificaciones son biomarcadores moleculares, biomarcadores celulares y biomarcadores de imagen. Los tres tipos de marcadores poseen un rol clínico en la precisión o guía de decisiones de tratamientos y son predictivos, pronósticos o diagnósticos. 
Biomarcador predictivo
Los biomarcadores predictivos (celulares, moleculares o de imagen) sirven como métodos para predecir resultados clínicos. Son usados para optimizar tratamientos ideales y usualmente indican la probabilidad de recuperación para una terapia específica. Por ejemplo: biomarcadores moleculares situados en la interfase de la arquitectura de procesos moleculares patológico-específicos y en mecanismos de acción de fármacos son prometedores para capturar aspectos que permiten la evaluación de la respuesta individual al tratamiento.2 Esto ofrece una aproximación dual tanto a la observación de tendencias en estudios retrospectivos como al uso de biomarcadores para predecir resultados. Por ejemplo, los biomarcadores usados en cáncer metastásico colorectal pueden servir como una forma de evaluar y mejorar las tasas de sobrevivencia de pacientes y en el caso individual, pueden servir como una forma de librar a los pacientes de la toxicidad innecesaria de los tratamientos contra el cáncer.3
Algunos ejemplos comunes de biomarcadores predictivos son genes como ER, PR y HER2/neu en cáncer de mama; la fusión proteica BCR-ABL en leucemia crónica mieloidea; mutaciones c-KIT en tumores GIST y mutaciones EGFR1 en NSCLC.4
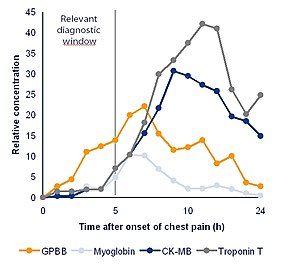
Después de un ataque cardiaco, diferentes biomarcadores cardiacos pueden ser usados para determinar con exactitud la fecha del ataque y su severidad.
Biomarcador diagnóstico
Los biomarcadores diagnósticos sirven para afinar diagnósticos que pueden ser significativamente más específicos para cada paciente.
Un biomarcador puede ser una sustancia medible que se introduce en el organismo como un medio para examinar la función de los órganos u otros aspectos de la salud.5 Por ejemplo, el cloruro de rubidio es usado como un isótopo radioactivo para evaluar la perfusión del músculo cardiaco.
También puede ser una sustancia cuya detección indica un estado particular de la enfermedad, por ejemplo, la presencia de un anticuerpo puede indicar una infección.5 Más específicamente, un biomarcador indica un cambio en la expresión o estado de una proteína que se correlaciona con el riesgo o progresión de una enfermedad o con la susceptibilidad de una enfermedad a un cierto tratamiento.5
Un ejemplo de un marcador comúnmente utilizado es el antígeno prostático específico (PSA en inglés). Este marcador puede ser medido como un indicador del tamaño de la próstata cuyos cambios rápidos son potenciales indicadores de cáncer. En el caso más extremo, la detección de proteínas mutantes mediante el monitoreo de reacción seleccionada puede ser usada como un biomarcador específico de cáncer pues las proteínas mutadas sólo pueden provenir de un tumor existente.6
Biomarcadores pronósticos
Un biomarcador pronóstico provee información acerca de los resultados de un paciente sin importar la terapia.4
Los biomarcadores para medicina de precisión son una parte relativamente nueva de las herramientas utilizadas. En el caso del cáncer metastásico colorectal (mCRC) sólo dos biomarcadores predictivos han sido identificados e implementados clínicamente.3 En este caso, la falta de datos más allá de estudios retrospectivos y de aproximaciones exitosas con biomarcadores han sido señaladas como las causas principales de la necesidad de nuevos estudios sobre biomarcadores dentro del campo médico.
Biomarcadores genéticos
Un biomarcador genético hace referencia a la fracción de ADN que nos indica una característica diferencial entre dos individuos, pudiendo así realizar un cribado gracias a este. También puede ser una secuencia de ADN que causa una enfermedad en concreto o que está relacionada con susceptibilidad a padecerla.
La nueva generación de fármacos inmunoconjugados “marcará un antes y un después en el tratamiento del cáncer por su eficacia y buena tolerabilidad”, según científicos del grupo de investigación Solti. Conscientes del potencial de la síntesis fármaco-anticuerpo (ADC), los laboratorios tienen en marcha más de un centenar de ensayos clínicos sobre 80 medicamentos de este tipo, dirigidos tanto a tumores sólidos como a neoplasias malignas hematológicas, según datos de la agencia oficial estadounidense ClinicalTrials.gov.
Un fármaco inmunoconjugado se compone de un anticuerpo monoclonal ligado químicamente a una sustancia que destruye las células cancerígenas. Se administra por vía intravenosa. La sustancia inmune se dirige por el torrente sanguíneo a las células, identificadas por los receptores que tienen en su exterior, penetra en ellas y libera el medicamento que destruye las células malignas sin dañar los tejidos sanos. La concentración de citotoxinas en el punto exacto multiplica por miles de veces la eficacia de la quimioterapia estándar, de efecto indiscriminado. 
Los ADC localizan las células cancerosas por sus anomalías genéticas y penetran en ellas para destruirlas
Es un ataque selectivo y preciso con la diana fijada en la alteración molecular, el biomarcador que anuncia cómo se va a comportar el tumor y ayuda a los especialistas a seleccionar la terapia más adecuada. Algunas de estas anomalías genéticas están presentes en diferentes tipos de cáncer, lo que abre la puerta al diseño de fármacos dirigidos a actuar contra las alteraciones moleculares independientemente del órgano o tejido en que se produzcan. “El efecto dirigido es mucho más potente que el de la quimioterapia convencional.
Se trata de una terapia del siglo XXI que en la última década ha evolucionado significativamente respecto a la primera generación y existe una decena de ADC aprobados para uso clínico por los reguladores de Europa y EE.UU. El primero, en 2011: Adcetris, lo indico para las recaídas de linfoma de Hodgkin. En estos años, los científicos han ideado mejores formas de conectar las toxinas anticancerígenas y los anticuerpos mediante los linkers para estabilizar la unión en el sistema circulatorio y llegar con precisión al tumor.
Hay una decena de medicamentos autorizados, pero los laboratorios ensayan muchos más
Paradigma de esta evolución es el trastuzumab (anticuerpo) deruxtecan (quimioterapia), un fármaco desarrollado por Daiichi Sankyo y AstraZeneca que ha pasado a ser el nuevo estándar de tratamiento en segunda línea para pacientes con cáncer de mama metastásico HER2 positivo, que representa el 20% de los casos y es uno de los subtipos más agresivos. Un ensayo clínico internacional liderado por Javier Cortés indica que este medicamento (comercializado como Enhertu) mantiene controlada la enfermedad en el 75,8% de las pacientes en 12 meses, cuando su antecesor, el conjugado trastuzumab emtansina (TDM-1) impide la progresión en el 34,1%. En 2012, Josep Baselga, a la sazón jefe del servicio de Oncología y Hematología del hospital General de Massachussetts, definió el hasta ahora tratamiento estándar y ya anticuado TDM-1 como “un misil con cabeza atómica”. 
El último inmunoconjugado autorizado en España contra el cáncer de vejiga metastásico
Enhertu utiliza como puerta de entrada a las células malignas el receptor HER2 (el biomarcador). Se administra en la segunda línea (cuando hay metástasis), aunque otros autores como Cortés cree que también se utilizara en la primera fase del tratamiento. Hay investigaciones en marcha para probar su eficacia en tumores localizados, en tumores con poca expresión (cantidad) de HER2 y en otros tipos de cáncer como el de pulmón y el de colon. Según este especialista, es “una auténtica revolución, una nueva forma de ver la oncología en los próximos años”. Varios especialistas coinciden en que puede tratarse del ADC más evolucionado, pero los laboratorios no se detienen.
“Puede haber un antes y un después en el tratamiento del cáncer porque todos los inmunoconjugados que se están probando son mejores de lo que tenemos hasta ahora; empieza a haber un montón de datos sobre muchos tumores”, según afirma Eva Ciruelos, coordinadora de la unidad de cáncer de mama del 12 de Octubre y de los hospitales HM Madrid. “ los inmunoconjugados acabarán desplazando a la quimioterapia clásica”.
“El tiempo dirá si los ADC pueden ser efectivos en todo tipo de tumores o no (decenas de plataformas anticuerpos, de enlaces y de receptores o biomarcadores están en estos momentos en proceso de investigación).
Enhertu triplica la efectividad de la terapia estándar en un tipo de cáncer de mama metastásico
Hay dianas que son transversales, como la proteína HER2, pero los mecanismos por los cuales el HER2 lleva al desarrollo de tumores son un poco distintos según estemos hablando de cáncer de mama, de pulmón o gástrico. El microambiente tumoral también es diferente en los diversos tipos de cáncer, lo que implica que tenemos que empezar a utilizar combinaciones con otros fármacos para magnificar los beneficios de los ADC”.
Esto incluye estrategias para explorar nuevos antígenos tumorales, formatos de anticuerpos, cargas útiles, enlazadores y tecnologías de conjugación más sofisticadas, cada elemento con el objetivo de mejorar la ventana terapéutica de los ADC.
El precio de la innovación: 7.500 euros por 30 mg de Padcev, contra el cáncer de vejiga
Aunque el horizonte de los inmunoconjugados es francamente prometedor, no está exento de frustraciones. Gemtuzumab ozogamicina fue el primer ADC en recibir aprobación acelerada de la agencia de medicamentos de EE.UU. (FDA) en el 2000. Así, se comercializó de forma previa al ensayo clínico. Pero el estudio no solo no confirmó el beneficio clínico, sino que registró un aumento de las muertes relacionadas con el tratamiento en comparación con el grupo de control que recibió quimioterapia estándar, con lo que Pfizer retiró el producto del mercado en el 2010. Después de ajustes en la dosificación, el fármaco recibió luz verde definitiva en el 2017 para el tratamiento de pacientes con leucemia mieloide aguda.
El Rovalpituzumab Tesirine (Rova-T), que se dirigió a la proteína tipo delta 3 contra el cáncer de pulmón de células pequeñas sin expresión en tejidos normales, fracasó en el ensayo de fase 2 debido a las altas tasas de toxicidad.
Es necesario seleccionar mejor cuáles son los pacientes que más se van a beneficiar de estos fármacos. Después, hay que saber qué pasa cuando estos fármacos dejen de funcionar, qué cosa darle al paciente después de esto y describir mejor los mecanismos de resistencia del tumor. También hay que describir un poco mejor los efectos secundarios; falta un poco de seguimiento y experiencia en la vida real. Por último, falta que se llegue a un precio razonable para que su uso pueda ser sostenible”.
El último fármaco inmuconjugado autorizado, este año, por la Agencia Española de Medicamentos y Productos Sanitarios es el Enfortumab Vedotin (Padcev), indicado para el tratamiento en segunda línea del cáncer de vejiga con metástasis, al entender que “ha mostrado su superioridad en términos de supervivencia global y supervivencia libre de progresión en comparación con quimioterapia”. Al margen de los efectos secundarios, que en general son controlables, el problema de estas terapias avanzadas es el precio para el Sistema Nacional de Salud. Un frasquito de 30 mg de Padcev cuesta en torno a 7.500 euros y la dosis recomendada es de 1,25 mg por cada kilo de peso del paciente, tres veces al mes y hasta que vaya mostrando eficacia.
Es sorprendente los avances y éxitos que se están obteniendo en el tratamiento tumoral que alcanzaran un 20% el crecimiento del mercado general de los inmunoconjugados en los próximos años.
Referencias
Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework». Clinical Pharmacology & Therapeutics (en inglés) 69 (3): 89-95. 2001. ISSN 1532-6535. doi:10.1067/mcp.2001.113989. Consultado el 11 de mayo de 2020.
Lukas, Arno; Heinzel, Andreas; Mayer, Bernd (11 de marzo de 2019). «Biomarkers for capturing disease pathology as molecular process hyperstructure». bioRxiv (en inglés): 573402. doi:10.1101/573402. Consultado el 11 de mayo de 2020.
Saltar a:a b Ruiz-Bañobre, Juan; Kandimalla, Raju; Goel, Ajay (28 de marzo de 2019). «Predictive Biomarkers in Metastatic Colorectal Cancer: A Systematic Review». JCO Precision Oncology (3): 1-17. doi:10.1200/PO.18.00260. Consultado el 11 de mayo de 2020.
Saltar a:a b Oldenhuis, C.N.A.M.; Oosting, S.F.; Gietema, J.A.; de Vries, E.G.E. (2008-05). «Prognostic versus predictive value of biomarkers in oncology». European Journal of Cancer 44 (7): 946-953. ISSN 0959-8049. doi:10.1016/j.ejca.2008.03.006. Consultado el 11 de mayo de 2020.
Saltar a:a b c «NCI Dictionary of Cancer Terms». National Cancer Institute (en inglés). 2 de febrero de 2011. Consultado el 11 de mayo de 2020.
Wang, Qing; Chaerkady, Raghothama; Wu, Jian; Hwang, Hee Jung; Papadopoulos, Nick; Kopelovich, Levy; Maitra, Anirban; Matthaei, Hanno et al. (8 de febrero de 2011). «Mutant proteins as cancer-specific biomarkers». Proceedings of the National Academy of Sciences (en inglés) 108 (6): 2444-2449. ISSN 0027-8424. PMC 3038743. PMID 21248225. doi:10.1073/pnas.1019203108. Consultado el 11 de mayo de 2020.
Dipali Dhawan et al. Omics Approaches in Cancer Biomarker and Targeted Anticancer Drug Discovery.
Xubingruo / Getty. La investigación, clave en el desarrollo de terapias innovadoras contra el cáncer
ANTONI LÓPEZ TOVAR BARCELONA 03/04/2022 07:56