EL APRENDIZAJE Y LA MEMORIA
El control de una severa depresión estimulando regiones de la amigdala, recientemente publicado ha vuelto a poner sobre el tablero la importancia del diencéfalo y concretamente la amígdala en el tratamiento de enfermedades tan crueles y resistentes como la depresión. estudio, Dr. Andrew Krystal, Ph. D., de Weill Institute for Neurosciences, University of California, en San Francisco, Estados Unidos.
Hace falta no solo conocer la función de este órgano, sino que pasa durante las patologías que posiblemente depende de alteraciones anatomo funcionales de esta estructura.
El aprendizaje y la memoria son dos procesos cognitivos trascendentales para la adaptación y la supervivencia de los organismos.
La relación entre la neurogénesis hipocampal y el aprendizaje y la memoria es evidente, las nuevas neuronas generadas en el hipocampo proporcionan el substrato anatómico que procesa y codifica la nueva información adquirida, sin embargo no se sabe si dichas neuronas remplazan a las viejas por ser estás ya no funcionales o bien si las neuronas viejas se mantienen porque conservan información relevante aprendida enteriormente, ambos esquemas tienen que ser investigados para entender si el recambio de neuronas en el hipocampo es un proceso continuo y si todo aquello que aprendemos es condición para inducir neurogenesis
Ambas conductas son procesadas en el sistema nervioso central y su regulación requiere de la participación de diversas estructuras cerebrales. Una de estas estructuras es el hipocampo, el cual está asociado en parte con la memoria declarativa. De manera interesante, el hipocampo es una de las dos regiones del cerebro adulto dónde se producen nuevas neuronas. Estás nuevas neuronas tienen la capacidad de integrarse a las redes neuronales del hipocampo. Resultados recientes sugieren que las nuevas neuronas participan en la regulación de funciones cognitivas asociadas a esta estructura cerebral. Por lo tanto, el objetivo de la presente revisión es describir brevemente las evidencias que muestran el papel funcional de las nuevas neuronas en el contexto del aprendizaje y la memoria. Palabras Clave: Factores de crecimiento; proliferación celular; neuronas; cerebro.
La generación de nuevas neuronas en el cerebro de los mamíferos, incluyendo el cerebro humano, es un fenómeno descrito desde hace ya varios años. Dicho fenómeno se conoce como neurogénesis y ocurre únicamente en dos regiones del cerebro adulto;
la pared de los ventrículos laterales y el giro dentado del hipocampo.
La presencia de neurogénesis se ha asociado a múltiples factores entre los que destaca el aprendizaje y su respectiva consolidación denominada memoria. Un número considerable de trabajos realizados en roedores han mostrado que cuando se aprende una tarea, el número de nuevas neuronas en el giro dentado del hipocampo se incrementa de forma abundante. Lo cual sugiere que el aprendizaje es un factor que estimula la proliferación de nuevas neuronas, muchas de las cuales no sobreviven y pocas se integran al circuito cerebral para ser funcionales. En este sentido, el objetivo de la presente revisión es describir los principales hallazgos experimentales que asocian la generación de nuevas neuronas con adquisición de nueva información, así como los mecanismos celulares implicados en la regulación de dicho fenómeno. Aprendizaje y memoria
Adaptativamente, el aprendizaje y la memoria son procesos cognitivos vitales para los organismos que forman parte del reino animal.
El ambiente es un entorno cambiante, por lo que animales que viven en ambientes que cambian continuamente necesitan de una plasticidad conductual. La plasticidad es una propiedad de los sistemas biológicos que les permite adaptarse a los cambios del medio para sobrevivir, la cual depende de los cambios fisiológicos que ocurran al interior.
El sistema nervioso posee una plasticidad altamente desarrollada y evidente en las primeras etapas del desarrollo, sobre todo en los mamíferos. A nivel neuronal los cambios plásticos pueden ser visualizados a través de un incremento del árbol dendrítico y del número de espinas dendríticas, que mejoran los contactos sinápticos y en consecuencia la comunicación entre las neuronas.
Desde hace tiempo se sabe que el aprendizaje y la memoria son eventos que favorecen la plasticidad, y cuanto más plástico es el sistema nervioso mayor es la capacidad de aprendizaje de los organismos.
El aprendizaje puede considerarse como una modificación estructural y funcional del sistema nervioso que da como resultado un cambio en la conducta relativamente permanente.
La información aprendida es retenida o almacenada en los circuitos neuronales que forman el cerebro y constituye lo que denominamos memoria. La memoria es la consecuencia usual del aprendizaje y difícilmente nos referimos a alguno de estos términos de manera independiente.
En los mamíferos se han descrito diferentes tipos de memoria y cada uno de estos tipos involucra la participación de áreas cerebrales y neurotransmisores específicos. De acuerdo a las características conductuales y las estructuras cerebrales implicadas, se han caracterizado tres tipos de memoria: la de trabajo, la implícita y la explícita
1 . La memoria de trabajo también llamada cognición ejecutiva, consiste en la representación consciente y manipulación temporal de la información necesaria para realizar operaciones cognitivas complejas, como el aprendizaje, la comprensión del lenguaje o el razonamiento
2, 3. La corteza prefrontal podría ser el lugar sede de esta memoria, además se sugiere que esta estructura cerebral podría funcionar como un lugar “on line” durante cortos periodos de tiempo de representaciones de estímulos ausentes
4 . Por otra parte, la memoria implícita, procedimental o no declarativa es la memoria de las cosas que hacemos rutinariamente. Se le considera automática, inconsciente y difícil de verbalizar. Su adquisición es gradual y se perfecciona con la práctica. Este tipo de memoria deriva de tipos de aprendizaje básico, como la habituación y la sensibilización, el aprendizaje perceptivo y motor o el condicionamiento clásico e instrumental 5 . Anatómicamente, la memoria implícita requiere de diferentes estructuras cerebrales que han sido involucradas con el aprendizaje procidemental, por ejemplo, los ganglios basales con el aprendizaje de hábitos y habilidades 6 , el cerebelo con los condicionamientos de respuestas motoras y 7 la amígdala con los condicionamientos emocionales 8 .
Aunque el sitio principal de almacenamiento de esta memoria radica en estructuras subcorticales y en algunos casos depende directamente del neocortex 9 . Finalmente, el sistema de memoria explícita, también conocida como memoria declarativa, relacional o cognitiva es el almacenamiento cerebral de hechos (memoria semántica) y eventos (memoria episódica) 10, 11 ,12. Este tipo de memoria se adquiere en pocos ensayos a diferencia de la memoria implícita y se distingue por expresarse en situaciones y modos diferentes a los del aprendizaje original, por lo que es considerada como una memoria de expresión flexible.
Un tipo de memoria declarativa es la memoria espacial que consiste en múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales 13, 14, 15.
El hipocampo parece ser la estructura cerebral que está críticamente relacionado en este tipo de memoria declarativa 16, 17.
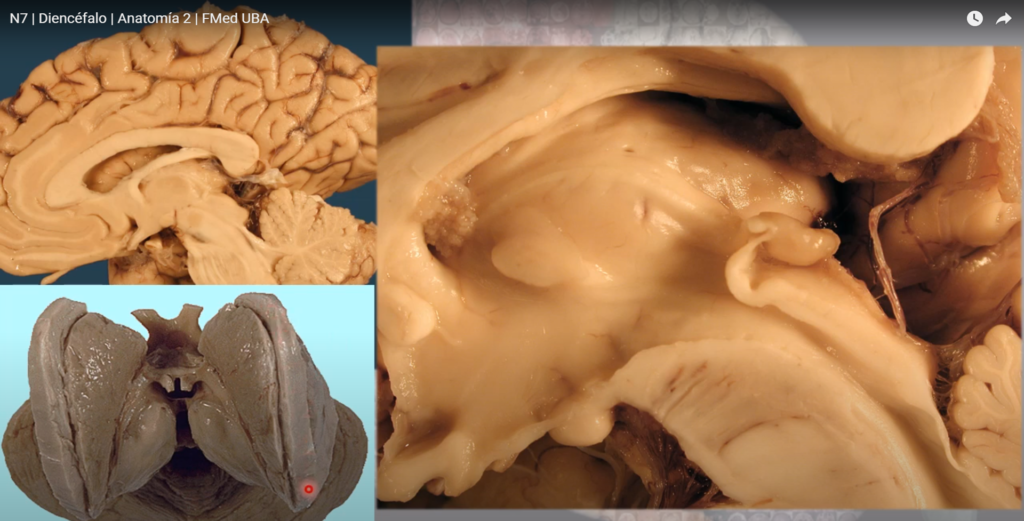
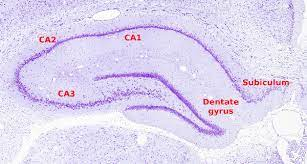
Sustrato anatómico de la memoria declarativa: el hipocampo El hipocampo deriva de la región medial del telencéfalo, forma parte del sistema límbico y tiene un papel importante en la adquisición del aprendizaje espacial y la consolidación de la memoria a largo y corto plazo. Anatómicamente, está organizado en el cuerno de Amón (hipocampo propio) y el giro dentado (separados por la fisura hipocampal); el complejo subicular, 22 www.uv.mx/rm formado por el presubiculum, el subiculum y el parasubiculum; y la corteza entorrinal 18, 19, 20. El cuerno de Amón está dividido en tres áreas: CA1, CA2 y CA3 (figura 1). La mayor entrada de fibras en el hipocampo proviene de la corteza parahipocampal que es la principal vía de entrada de aferencias neocorticales de procesamiento provenientes de distintas áreas dorsales, como la corteza parietal posterior, la corteza retrosplenial, la corteza prefrontal dorsolateral o de la parte dorsal del surco temporal superior estructuras estrechamente asociadas en la codificación de la localización espacial de los estímulos 21, 22.
Estas aferencias son distribuidas hacia la corteza entorrinal. Las células de las capas II y III de esta corteza envían sus axones hasta el giro dentado y el hipocampo a través de la vía perforante, atravesando la capa de células piramidales del subiculum 23, 24. Por otra parte, las neuronas piramidales de la región CA3 proyectan sus axones hacia las dendritas de las neuronas piramidales de las CA1 mediante los colaterales de Schaffer. Así mismo, los axones provenientes de la región CA3 proyectan hacía todo el hipocampo mediante proyecciones comisurales, entre hemisferios y/o asociativas, en el mismo hemisferio 25, 26, 27. Mientras que las neuronas granulares del giro dentado proyectan sus axones o fibras musgosas hacia las dendritas proximales de las neuronas piramidales de la región CA3, atravesando el hilus 28, 29.
El circuito del procesamiento de la información de la memoria declarativa es el llamado circuito trisináptico 30. Este circuito inicia en la vía perforante de la corteza entorrinal. Primeramente, las neuronas de la corteza entorrinal envía sus proyecciones hacía las células granulares del giro dentado. En seguida, estás células proyectan sus axones hacia las neuronas piramidales de la región CA3, las cuales finalmente envían sus axones hasta las neuronas piramidales de la región CA1 mediante los colaterales de Schaffer.
La información procesada mediante este circuito trisináptico permite relacionar diferentes aferencias sensoriales pertenecientes a diversos estímulos gracias a que las células piramidales del hipocampo tienen un alto grado de interconexión, facilitando las relaciones entre las diferentes entradas de información 31. Hipocampo y memoria declarativa
Actualmente existe amplia evidencia del papel crítico que juega el hipocampo en la memoria declarativa. Las lesiones en el hipocampo y sus conexiones subcorticales en pacientes con amnesia producen déficits selectivos en la memoria declarativa, sin embargo la capacidad de distinguir nuevos objetos con base en su familiaridad permanece intacta 32, 33. Además se observó que en estos pacientes el hipocampo tiene la función de mantener la habilidad de asociar objetos en la memoria y recordar asociaciones contextuales en comparación con el recuerdo de objetos únicos con base en su familiaridad 34, 35.
Otros estudios clínicos han mostrado que la corteza parahipocampal se activa durante la presentación de escenas espaciales o durante la memorización de objetos relacionados fuertemente con lugares específicos 36, 37.
El hipocampo es, por tanto, una estructura crítica para procesar y recordar información espacial y contextual. La participación del hipocampo en la memoria explícita ha sido estudiada por medio de la memoria espacial. La memoria espacial consiste en múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales 13, 14, 15. Esta memoria puede ser evaluada en humanos y en modelos animales, en los cuales la solución de la tarea depende de la información disponible. Experimentos con ratas han mostrado que las lesiones hipocampales afectan negativamente la adquisición y retención del aprendizaje espacial cuándo las ratas son entrenadas en la búsqueda de una plataforma oculta pocos centímetros por debajo del agua (laberinto acuático de Morris) 38, 39, 40, 41. De manera interesante, pacientes con lesiones en el Figura 1. Esquema de los circuitos en el hipocampo adulto. La tradicional vía excitatoria trisináptica (Corteza entorrinal (CE)-giro dentado (GD)-CA3-CA1-CE) es descrita por las flechas de colores (flecha azul: vía perforante; flecha naranja: vía de fibras musgosas; flecha verde: colaterales de Schaffer; flecha roja; proyecciones de CA1 ha la CE) . Los axones de las neuronas de la capa II de la corteza entorrinal (CE) proyectan hacía el giro dentado a través de la vía perforante (VP), incluyendo la vía perforante lateral (VPL). El giro dentado envía proyecciones a las células piramidales de CA3 a través de las fibras musgosas. Las neuronas piramidales de CA3 descargan la información a las neuronas piramidales de CA1 a través de los colaterales de Schaffer. A su vez, las neuronas piramidales de CA1 envían las proyecciones dentro de la capa de neuronas de la corteza entorrinal. CA3 también recibe proyecciones directas de la capa II de la corteza entorrinal a través de la vía perforante, mientras que CA1 recibe entradas directas de la capa III de la corteza entorrinal a través de la vía temporoammonica (VP). Las células del giro dentado también proyectan a las células musgosas del hilus e interneuronas hilares que envían proyecciones excitarías e inhibitorias respectivamente, hacías las neuronas granulares. Abreviaturas: CE: corteza entorrinal; GD: giro dentado; Sub:subiculum. El hipocampo: neurogénesis y aprendizaje Rev Med UV, Enero – Junio 2015 23 www.uv.mx/rm hipocampo tienen graves dificultades en un test virtual semejante al laberinto acuático de Morris 42, 43. Las afectaciones en el aprendizaje espacial son proporcionales con el volumen de tejido dañado y dependen de la región anatómica del hipocampo lesionado, ya que las lesiones en el hipocampo dorsal producen un mayor deterioro en el aprendizaje que las lesiones en el hipocampo ventral 44. Las lesiones hipocampales parecen deteriorar específicamente el aprendizaje y la memoria espacial, ya que las ratas con el hipocampo dañado muestran dificultades para aprender tareas espaciales como la localización de una plataforma escondida pero no para adquirir una tarea de discriminación no espacial 44, 45. Entonces, parece claro que el hipocampo juega un papel crítico para procesar y recordar información espacial. Por otro lado, registros de actividad unitaria (registro de potenciales de acción) han reportado la presencia de neuronas denominadas de “lugar” en el hipocampo de la rata, estás células se denominan así porque disparan sus potenciales de acción cuando la rata reconoce un lugar en el que previamente se le había colocado 46, 47.
En conjunto estás evidencias sugieren que el hipocampo es una estructura cerebral implicada en aspectos cognitivos que involucran el reconocimiento de la ubicación espacial, para lo cual los sujetos se ayudan de la estimación de la distancia entre un objeto y los estímulos relacionados que lo llevaron a encontrarlo 48.
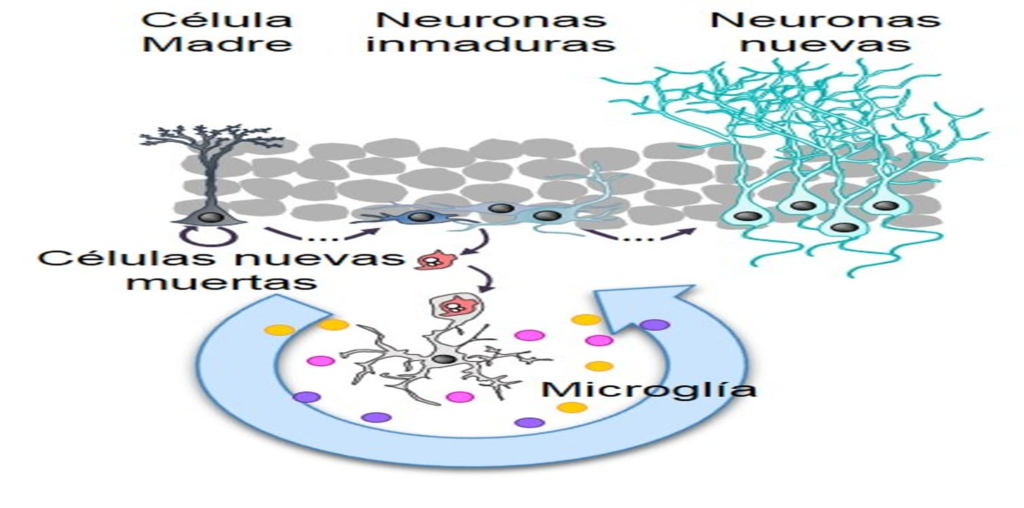
Aunque, es claro que el hipocampo juega un papel crítico en el aprendizaje espacial, el mecanismo es complejo y requiere de la acción coordinada del hipocampo con otras estructuras cerebrales. Hipocampo y neurogénesis El giro dentado del hipocampo junto con la zona subventricular de los ventrículos laterales del cerebro de mamífero son los dos sitios de generación de nuevas neuronas durante la etapa adulta, y se sabe que dichas neuronas tienen un papel importante en varias funciones del sistema nervioso central 49, 50, 51. El fenómeno de producción de nuevas células es conocido con el término de neurogénesis y generalmente se refiere al proceso de proliferación, migración, supervivencia y diferenciación de nuevas células 52, 53, 54 (figura 2).
La neurogénesis ocurre continuamente en el giro dentado del hipocampo adulto y comparte algunas características con la neurogénesis que tiene lugar durante el desarrollo embrionario. Durante el proceso de neurogénesis concurren células troncales y progenitores neurales, en conjunto conocidos como precursores neurales, originados a partir de la división asimétrica de las primeras, las cuales darán lugar a los tres tipos principales de células en el sistema nervioso central: neuronas, glia y oligodendrocitos 55, 56, 57.
La neurogénesis en el giro dentado del hipocampo se demostró hace cuarenta años en autoradiografías tomadas de una zona, la cual en contraste con la zona subventricular, no se localiza cerca de las paredes de los ventrículos laterales; sino que se encuentra localizada por debajo del borde medial del hipocampo y en su profundidad.
Actualmente, esta zona es conocida como zona subgranular 58. En este sitio se localiza una población de células troncales con características de la glía radial 59,60, que tienen filamentos intermedios como la nestina y la proteína acídica fibrilar (GFAP, por sus siglas en inglés). Los progenitores que se originan a partir de esta población, se comprometen a un linaje neural particular entre tres y siete días después de su nacimiento 61. Posteriormente, las nuevas células que logran diferenciarse se clasifican como tipo celular 2a, 2b y 3 dependiendo de los marcadores celulares que expresen. Específicamente, los tipos celulares 2b y 3, expresan la proteína 2.
La neurogénesis se inicia con la proliferación de una célula troncal neural (célula de color azul) localizada en la zona subgranular del giro dentado, que dará origen a progenitores neurales (células de color verde) de los cuales se originarán las nuevas neuronas. Los progenitores neuronales inician la migración hacía la capa de células granulares del giro dentado, sitio dónde alcanzarán su madurez. Una etapa crítica de la neurogénesis es el mantenimiento de la supervivencia de las nuevas neuronas, ya que esto permitirá su integración a los circuitos neuronales del hipocampo. Durante la neurogénesis los progenitores neuronales expresan proteínas específicas a lo largo de su maduración. Estas proteínas pueden ser detectadas por técnicas de inmunohistoquímica utilizando anticuerpos específicos. Por ejemplo, una célula inmadura puede identificarse por la detección de la proteína nestina, mientras que una neurona madura por la presencia de la proteína NeuN (para detalles vea el texto).
Abreviaturas: zona subgranular (ZSG), capa de células granulares (CCG), capa molecular (CM). 24 www.uv.mx/rm doblecortina, una proteína que se une a los microtúbulos y que es un marcador de neuronas inmaduras 62, 63, entre uno y catorce días después de su generación. Estas células muestran características de células progenitoras ya que algunas de ellas co-expresan Ki-67 (un marcador de proliferación celular) y por lo tanto son capaces de dividirse 64,65. El tipo 2b expresa el marcador neuronal NeuN 72 horas después de su generación. Por otra parte, este mismo tipo puede dividirse una vez más y dar origen al tipo celular 3, el cual expresa doblecortina y NeuN. Los tres tipos celulares expresan la proteína polisializada de NCAM (PSA-NCAM) 66. La mayoría de la progenie de las células precursoras neurales dará origen a neuronas granulosas dentadas. Durante su proceso de madurez estas células reciben estímulos gabaérgicos ocho días después de su nacimiento y estímulos glutamatérgicos por un periodo de 18 días, además tienen un bajo umbral para la inducción de la potenciación a largo plazo (LTP por sus siglas en inglés) y una mejor plasticidad sináptica 67, 68, 69, 70. Estas nuevas células migran, se diferencian y se integran a la capa subgranular del giro dentado del hipocampo entre una y cuatro semanas después de su generación. Posteriormente, desarrollan un axón y generan procesos neuríticos que les permite integrarse sinápticamente entre dos y cuatro semanas después de su nacimiento 71. Las nuevas neuronas envían sus proyecciones axonales hacia CA3 y arborizaciones dendríticas hacia la capa granular, lo que sugiere que hacen sinapsis antes de ser completamente maduras 72. De las nuevas células generadas, un bajo porcentaje se diferencia en astrocitos (positivos a los marcadores GFAP/S100B). Experimentos en monos, han demostrado que un alto porcentaje de las nuevas células generadas se comprometen a ser neuronas, expresando marcadores neuronales como: TuJ1, TOAD-64, NeuN, y calbindina y raramente marcadores de astrocitos (GFAP) u oligodendrocitos (CNP) 73, 74.
Neurogénesis hipocampal y aprendizaje espacial Una de las preguntas frecuentes en la investigación de la neurogénesis hipocampal es si la producción de nuevas neuronas en el giro dentado podría ser relevante en el aprendizaje espacial asociado al hipocampo. La posible implicación de la neurogénesis hipocampal en el aprendizaje espacial, podría explicarse considerando que la neurogénesis es estimulada por el aprendizaje y este a su vez por la neurogénesis 75, 76. Estudios previos han demostrado que algunas experiencias como el aprendizaje espacial, el ambiente enriquecido y el ejercicio físico voluntario incrementan las tasas de neurogénesis en el giro dentado 77, 78, 79, 80. Estas experiencias están asociadas con un aumento en el rendimiento cognitivo, probablemente a través de la incorporación de las nuevas neuronas a las redes neurales del hipocampo.
El aprendizaje espacial dependiente de hipocampo es uno de los principales reguladores de la neurogénesis hipocampal. Específicamente, la neurogénesis en el giro dentado se incrementa por el aprendizaje de tareas dependientes de hipocampo como son: el condicionamiento de traza de la respuesta de parpadeo, aprendizaje espacial en el laberinto acuático de Morris y la preferencia de comida condicionada 81, 82.
Por el contrario, el aprendizaje no dependiente del hipocampo, como el condicionamiento demorado de la respuesta de parpadeo y la evitación activa no favorecen la neurogénesis en el giro dentado. Se ha reportado que el aprendizaje per se, y no el entrenamiento, es el factor que induce la activación y la regulación de la neurogénesis hipocampal 83.
Por ejemplo, el aprendizaje espacial en el laberinto acuático de Morris produce efectos diferenciales sobre el desarrollo de los precursores neurales del giro dentado 84, 85. En este sentido, se ha reportado que el aprendizaje induce apoptósis de las nuevas células durante la fase inicial del aprendizaje, aquellas células nacidas tres días antes de iniciar el entrenamiento, y la supervivencia de aquellas neuronas maduras, nacidas siete días antes de comenzar el entrenamiento 86, 87, 88, 89, 90. La muerte celular inducida por el aprendizaje es específica para la zona subgranular del giro dentado, ya que no se observó en CA1 y CA3
En contraste, la inhibición de la apoptosis en ratas que comienzan a aprender una tarea muestra un deterioro del recuerdo de la posición de la plataforma oculta, así como una disminución de la proliferación celular, característica de la fase inicial del aprendizaje. En conjunto, estas evidencias sugieren que el aprendizaje espacial activa un mecanismo similar al proceso de estabilización selectiva que se observa durante el desarrollo embrionario del cerebro, donde la neurogénesis se regula por la selección activa de algunas nuevas neuronas y la eliminación de otras 91, 92,93. Por tanto, es razonable proponer que tanto la supervivencia y la apoptosis de las nuevas células son eventos de selección que dependen directamente del periodo de aprendizaje. Otro factor que regula la neurogénesis y que a su vez promueve el aprendizaje espacial es el ambiente enriquecido. Un ambiente enriquecido consiste en colocar un grupo de roedores (n ≥ 8) en una caja más grande que la caja estándar, esta caja contiene objetos de diferentes formas, texturas y tamaños, lo cual permite una estimulación sensorial y motora que impacta fuertemente el desarrollo del cerebro 94,96. En este contexto, colocar a roedores por una semana en un ambiente enriquecido favorece la supervivencia de las nuevas células en el giro dentado, tres semanas posteriores a su nacimiento 95. Adicionalmente, el ambiente enriquecido incrementa la neurogénesis en el hipocampo y favorece el desempeño de los roedores en pruebas de aprendizaje y memoria espacial El hipocampo: neurogénesis y aprendizaje Rev Med UV, Enero – Junio 2015 25 www.uv.mx/rm dependientes de hipocampo 96.
Por otra parte, el ejercicio aeróbico además de contribuir positivamente a la salud integral de los individuos, también tiene efectos positivos sobre la neurogénesis y el aprendizaje 97, 98, 99,100. En roedores, el ejercicio voluntario (correr en un rueda) incrementa la proliferación de nuevas neuronas en el giro dentado 93. El ejercicio además favorece la eficacia sináptica en neuronas del giro dentado y mejora el aprendizaje espacial de los roedores en el laberinto acuático de Morris 101,102. Estos resultados sugieren que la mejora en el aprendizaje debido al ejercicio se debe en parte a la inducción de neurogénesis en el hipocampo. El ejercicico favorece la sintesís y liberación de neurotransmisores, hormonas y péptidos que seguramente inducen la proliferación de nuevas neuronas (figura 3). Particularmente, se ha mostrado que los niveles de RNAm del factor de crecimiento derivado del cerebro (BDNF por su siglas en inglés) se incrementa en el hipocampo del ratón después de ejercicio 103. En resumen, el ambiente enriquecido y el ejercicio como factores inductores de neurogénesis pueden tener mediadores químicos comunues que facilitan la proliferación de nuevas neuronas y entre los que se destacan los factores de crecimiento, las hormonas y neurotransmisores (figura 3).
Conclusiones La relación entre la neurogénesis hipocampal y el aprendizaje y la memoria es evidente, las nuevas neuronas generadas en el hipocampo proporcionan el substrato anatómico que procesa y codifica la nueva información adquirida, sin embargo no se sabe si dichas neuronas remplazan a las viejas por ser estás ya no funcionales o bien si las neuronas viejas se mantienen porque conservan información relevante aprendida enteriormente, ambos esquemas tienen que ser investigados para entender si el recambio de neuronas en el hipocampo es un proceso continuo y si todo aquello que aprendemos es condición para inducir neurogenesis. En este sentido la inducción de neurogénesis asociada al aprendizaje depende de varios factores: i) del tipo de tarea de aprendizaje, ii) de las demandas específicas que requiera la ejecución de la tarea y iii) del momento en que se ejecuta la tarea. En este contexto, la neurogénesis asociada a la adquisición de tareas nuevas, que tiempo después se traducen en memoria, es un proceso complejo, multifactorial y con interrogantes que aún deben ser resultas.
Bibliografía
1. Roediger HL, McDermott KB. Two types of event memory. Proc Natl Acad Sci 2013; 110: 20856-857. 2. Kandel, ER, Dudai Y, Mayford MR. The molecular and systems biology of memory. Cell 2014; 157:163–186. 3. Griffin AL. Role of the thalamic nucleus reuniens in mediating interactions between the hippocampus and medial prefrontal cortex during spatial working memory. Front Syst Neurosci 2015 10; 9:29. 4. Zanto TP, Rubens MT, Thangavel A, Gazzaley A. Causal role of the prefrontal cortex in top-down modulation of visual processing and working memory. Nat Neurosci 2011; 14: 656-61. 5. Squire LR, Dede AJ. Conscious and Unconscious Memory Systems. Cold Spring Harb Perspect Biol 2015 Mar 2;7(3) 6. Ashby FG1, Turner BO, Horvitz JC. Cortical and basal ganglia contributions to habit learning and automaticity. Trends Cogn Sci. 2010; 14:208-15. 7. Timmann D, y col. The human cerebellum contributes to motor, Figura 3. Mecanismos sugeridos que regulan la neurogénesis y su efecto sobre el aprendizaje y la memoria espacial. El ambiente enriquecido, el ejercicio físico y nuevas experiencias son factores externos que inducen la liberación de factores de crecimiento como la Neurotrofina-3 (NT3), el factor cerebral derivado del cerebro (BDNF), el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento parecido a la insulina 1 (IGF-1) o la hormona de crecimiento (GH), dichas moléculas producen efectos diferenciales sobre las distintas etapas de la neurogénesis. La estimulación en la neurogénesis favorece el aprendizaje y la memoria espacial. De forma paralela los factores de crecimiento regulan la liberación de neurotransmisores y la expresión de sus receptores, los cuales a su vez participan en la regulación de la neurogénesis. Algunos de estos neurotransmisores facilitan la potenciación a largo plazo (LTP), fenómeno involucrado directamente con la adquisición de nueva información. En contraste, el estrés y el envejecimiento tienen un efecto negativo sobre la producción de factores de crecimiento, inhibiendo por lo tanto la respuesta en la neurogénesis y en consecuencia en el aprendizaje y la memoria. Zona subgranular (ZSG), capa de células granulares (CCG), capa molecular (CM), 5-hidroxitriptamina (5-HT), dopamina (DA), glutamato (Glu), ácido gamma-aminobutírico (GABA), N-metil-D-aspartato (NMDA), ácido α-amino-3-hidroxi-5-metil-4- isoxazolpropiónico (AMPA). 26 www.uv.mx/rm emotional and cognitive associative learning. A review. Cortex. 2010; 46: 845-57 8. Duvarci S. Pare D. Amygdala microcircuits controlling learned fear. Neuron 2014; 482: 966–80. 9. Sharon T, Moscovitch M, Gilboa A. Rapid neocortical acquisition of long-term arbitrary associations independent of the hippocampus. Proc Natl Acad Sci 2011; 108: 1146-51. 10. Squire LR, Wixted JT. The cognitive neuroscience of human memory since HM. Annu Rev Neurosci 2011; 34: 259–88. 11. Eichenbaum H. The cognitive neuroscience of memory: an introduction. Oxford University Press. 2011 12. Ullman MT. Contributions of memory circuits to language: The declarative/procedural model. Cognition 2004; 92: 231-70. 13. Keefe JO, Nadel L. The hippocampus as a cognitive map. Oxford: Clarendon Press. 1978. 14. Burgess N, Maguire EA, O’Keefe J. The human hippocampus and spatial and episodic memory. Neuron 2002; 35:625–41. 15. Buzsáki G, Moser EI. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat Neurosci 2013; 16:130–38. 16. Morris RGM, y col. Memory reconsolidation: sensitivity of spatialmemory to inhibition of protein synthesis in dorsal hippocampus during encoding and retrieval. Neuron 2006; 50, 479– 89 17. Quiroga RQ. Concept cells: the building blocks of declarative memory functions. Nat Rev Neurosci 2012; 13: 587-97. 18. Amaral DG, Witter MP. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neurosci 1989; 31:571-91. 19. Lavenex P, Banta LP, Amaral DG: Postnatal development of the primate hippocampal formation. Dev Neurosci 2007; 29:179–19. 20. Kivisaari SL, Probst A, Taylor KI. The Perirhinal, Entorhinal, and Parahippocampal Cortices and Hippocampus: An Overview of Functional Anatomy and Protocol for Their Segmentation in MR Images In fMRI. Springer Berlin Heidelberg 2013. p. 239-67. 21. Witter MP, Wouterlood FG, Naber PA, Van Haeften T: Anatomical organization of the parahippocampal-hippocampal network. Ann NY Acad Sci 2000 Jun; 911:1-24. 22. Lavenex P, Suzuki WA, Amaral DG. Perirhinal and parahippocampal cortices of the macaque monkey: Intrinsic projections and interconnections. J Comp Neurol. 2004; 472:371-94. 23. Witter MP, Amaral DG. Entorhinal cortex of the monkey: V projections to the dentate gyrus, hippocampus, and subicular complex. J Comp Neurol 1991; 307:437-59. 24. Khalaf-Nazzal R, Francis F. Hippocampal development – old and new findings. Neurosci 2013; 248:225-42. 25. Laurberg S, Sorensen KE. Associational and commissural collaterals of neurons in the hippocampal formation (hilus fasciae dentate and subfield CA3. Brain Res 1981; 212:287–00. 26. Ishizuka N, Weber J, Amaral DG. Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. J Comp Neurol 1990; 295:580–23. 27. Frotscher M, Seress L, Schwerdtfeger WK, Buhl E. The mossy cells of the fascia dentate: a comparative study of their fine structure and synaptic connections in rodents and primates. J Comp Neurol 1991; 312:145–63. 28. Chicurel ME, Harris KM Three-dimensional analysis of the structure and composition of CA3 branched dendritic spines and their synaptic relationships with mossy fiber boutons in the rat hippocampus. J Comp Neurol 1999; 325: 169-82. 29. Suzuki W, Amaral DG: Perirhinal and parahippocampal cortices of the macaque monkey: cytoarchitectonic and chemoarchitectonic organization. J Comp Neurol 2003; 463:67–91 30. Kim SM, Ganguli S, Frank LM. Spatial information outflow from the hippocampal circuit: distributed spatial coding and phase precession in the subiculum. J Neurosci 2012; 32: 11539-58. 31. Zhang SJ, y col. Functional connectivity of the entorhinal– hippocampal space circuit. Philos Trans R Soc Lond B Biol Sci 2013 Dec 23; 369(1635):20120516. 32. Eichenbaum H, Cohen NJ. Can we reconcile the declarative memory and spatial navigation views on hippocampal function? Neuron 2014; 83: 764-70. 33. Giovanello KS, Verfaille M, Keane MM. Disproportionate deficit in associative recognition relative to item recognition in global amnesia. Cogn Affect Behav Neurosci 2003; 3: 186-94. 34. Addis DR, y col. Characterizing spatial and temporal features of autobiographical memory retrieval networks: a partial least squares approach. Neuroimage 2004; 23: 1460-71. 35. Bartsch T, Schönfeld R, Müller FJ, Alfke K, Leplow B, Aldenhoff J, Koch JM. Focal lesions of human hippocampal CA1 neurons in transient global amnesia impair place memory. Science 2010; 328: 1412-15. 36. Churchwell JC, Morris AM, Musso ND, Kesner RP. Prefrontal and hippocampal contributions to encoding and retrieval of spatial memory. Neurobiol Learn Mem 2010; 93: 415-21. 37. Stone SS, y col. Stimulation of entorhinal cortex promotes adult neurogenesis and facilitates spatial memory. J Neurosci 2011; 31: 13469-84. 38. Morris RG. Developments of a water-maze procedure for studying spatial learning in the rat. J Neurosci Methods1984; 11: 47-60. 39. Moser E, Moser MB, Andersen P. Spatial learning impairment parallels the magnitude of dorsal hippocampal lesions, but is hardly present following ventral lesions. J Neurosci 1993; 13: 3916-25. 40. Laursen B, y col. Impaired hippocampal acetylcholine release parallels spatial memory deficits in Tg2576 mice subjected to basal forebrain cholinergic degeneration. Brain Res 2014; 1543: 253-62. 41. Hales JB, Ocampo AC, Broadbent NJ, Clark RE. Hippocampal Infusion of Zeta Inhibitory Peptide Impairs Recent, but Not Remote, Recognition Memory in Rats. Neural Plasticity 2015; 501, 847136. 42. Astur RS, Taylor LB, Mamelak AN, Philpott L, Sutherland RJ. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res 2005; 132: 77-84. 43. Cornwell BR, Johnson LL, Holroyd T, Carver FW, Grillon C. Human hippocampal and parahippocampal theta during goal-directed spatial navigation predicts performance on a virtual Morris water maze. J Neurosci 2008; 28:5983-90. 44. Strange BA, Witter MP, Lein ES, Moser EI. Functional organization of the hippocampal longitudinal axis. Nature Rev Neurosci 2014; 15: 655-69. 45. Hales JB, y col. Medial entorhinal cortex lesions only partially disrupt hippocampal place cells and hippocampus-dependent place memory. Cell Rep 2014; 9: 893-01. 46. O´Keefe JA, Dostrovski J. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Res 1971 34: 171-5. 47. Hartley T, Lever C, Burgess N, O’Keefe J. Space in the brain: how the hippocampal formation supports spatial cognition. Philos Trans R Soc Lond B Biol Sci 2014; 369: 20120510. 48. Moser MB, Rowland DC, Moser EI. Place cells, grid cells, and memory. Cold Spring Harb Perspect Med 2015; 7: a021808. 49. Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ. Learning enhances adult neurogenesis in the hippocampal formation. Nature Neurosci 1999; 2: 260–5. 50. Clemenson GD, Deng W, Gage FH. Environmental enrichment and neurogenesis: from mice to humans. Curr Opin Beh Sci 2015; 4: 56- 62. 51. Cameron HA, Glover LR. Adult Neurogenesis: Beyond Learning and Memory. Annu Rev Psychol 2015; 66: 53-81. 52. Cameron HA, Mckay RD. Adult neurogenesis produces a large pool El hipocampo: neurogénesis y aprendizaje Rev Med UV, Enero – Junio 2015 27 www.uv.mx/rm of new granule cells in the dentate gyrus. J Comp Neurol 2001; 435: 406-17. 53. Fernandes C, y col. Detrimental role of prolonged sleep deprivation on adult neurogenesis. Front Cell Neurosci, 2015; 9:140. 54. Aimone JB, Deng W, Gage FH. Adult neurogenesis in the dentate gyrus. In Space, Time and Memory in the Hippocampal Formation. Springer Vienna 2015; pp. 409-429. 55. Eriksson PS, y col. Neurogenesis in the adult human hippocampus. Nature Medicine 1998; 4: 1313-1317. 56. Gage FH. Mammalian neural stem cells. Science 2000; 287: 1433–38. 57. Drew LJ, Fusi S, Hen R. Adult neurogenesis in the mammalian hippocampus: Why the dentate gyrus? Learn Mem 2013; 20: 710-29. 58. De La Rosa Prieto C, De Moya Pinilla M, Saiz-Sanchez D, Ubeda-banon I, Arzate DM, Flores-Cuadrado A, Martinez-Marcos A. Olfactory and cortical projections to bulbar and hippocampal adult-born neurons. Front Neuroanat. 2015; 9:4. 59. Kempermann G, Jessberger S, Steiner B, Kronenberg G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci 2004; 27:447-52. 60. Duan L Peng CY, Pan L Kessler JA. Human Pluripotent Stem CellDerived Radial Glia Recapitulate Developmental Events and Provide Real-Time Access to Cortical Neurons and Astrocytes. Stem Cells Transl Med. 2015 Apr 1. pii: sctm.2014-0137. 61. Kirby ED, Kuwahara AA, Messer RL, Wyss-Coray T. Adult hippocampal neural stem and progenitor cells regulate the neurogenic niche by secreting VEGF. Proc Natl Acad Sci U S A 2015; 112: 4128-33. 62. Toriyama M, y col. Phosphorylation of doublecortin by protein kinase A orchestrates microtubule and actin dynamics to promote neuronal progenitor cell migration. J Biol Chem. 2012; 287:12691-702. 63. Vukovic J1, Borlikova GG, Ruitenberg MJ, Robinson GJ, Sullivan RK, Walker TL, Bartlett PF. Immature doublecortin-positive hippocampal neurons are important for learning but not for remembering. J Neurosci. 2013; 33: 6603-13. 64. Espósito MS, Piatti VC, Laplagne DA, Morgenstern NA, Ferrari CC, Pitossi FJ, Schinder AF. Neuronal differentiation in the adult hippocampus recapitulates embryonic development. J Neurosci 2005; 25:1007486. 65. Cimadamore F, Amador-Arjona A, Chen C, Huang CT, Terskikh AV. SOX2–LIN28/let-7 pathway regulates proliferation and neurogenesis in neural precursors. Proc Natl Acad Sci U S A 2013; 110: E3017-E26. 66. Kim HS, y col. PSA-NCAM+ Neural Precursor Cells from Human Embryonic Stem Cells Promote Neural Tissue Integrity and Behavioral Performance in a Rat Stroke Model. Stem Cell Rev 2014; 10: 761-771. 67. Schmidt-Hieber C, Jonas P, Bischofberger J. Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus. Nature 2004; 429:184–87. 68. Ge S, y col. GABA regulates synaptic integration of newly generated neurons in the adult brain. Nature 2006; 439:589–93. 69. Lledo MP, Alononso M, Grubb MS. Adult neurogenesis and functional plasticity in neuronal circuits. Nat Rev Neurosci 2006; 7:179-93. 70. Kim WR, Christian K, Ming GL, Song H. Time-dependent involvement of adult-born dentate granule cells in behavior. Behav Brain Res 2012; 227: 470-79. 71. Benarroch EE. Adult neurogenesis in the dentate gyrus general concepts and potential implications. Neurology 2013; 81: 1443-52. 72. Song J, M Christian K, Ming GL, Song H. Modification of hippocampal circuitry by adult neurogenesis. Dev Neurobiol 2012; 72: 1032-43. 73. Imayoshi I, Kageyama R. The role of Notch signaling in adult neurogenesis. Mol Neurobiol 2011; 44: 7-12. 74. Mu L, y col. SoxC transcription factors are required for neuronal differentiation in adult hippocampal neurogenesis. J Neurosci 2012; 32: 3067-80. 75. Gould E, Vail N, Wagers M, Gross CG. Adult-generated hippocampal and neocortical neurons in macaques have a transient existence. Proc Natl Acad Sci U S A 2001; 98:10910-17. 76. Fabel K, y col. Additive effects of physical exercise and environmental enrichment on adult hippocampal neurogenesis in mice. Front Neurosci 2009; 3:50. 77. Kempermann, G. Activity-Based Maintenance of Adult Hippocampal Neurogenesis: Maintaining a Potential for Lifelong Plasticity. In Neural Stem Cells in Development, Adulthood and Disease 2015 (pp. 119-123). Springer New York. 78. Zhao C, Deng W, Gage FH. Mechanisms and functional implications of adult neurogenesis. Cell 2008;132: 645–60 79. Clelland D, y col. A functional role for adult hippocampal neurogenesis in spatial pattern separation. Science 2009; 325: 210-13. 80. Speisman RB, y col. Environmental enrichment restores neurogenesis and rapid acquisition in aged rats. Neurobiol Aging 2013; 34: 263-74. 81. Merritt JR, Rhodes JS. Mouse genetic differences in voluntary wheel running, adult hippocampal neurogenesis and learning on the multistrain-adapted plus water maze. Behav Brain Res 2015; 280: 62-71. 82. Deng W, Gage FH. The effect of immature adult-born dentate granule cells on hyponeophagial behavior is related to their roles in learning and memory. Front Syst Neurosci 2015; 9. 83. Opendak M, Gould E. Adult neurogenesis: a substrate for experiencedependent change. Trends Cogn Sci 2015; 19: 151-61. 84. Trinchero MF, y col. Effects of spaced learning in the water maze on development of dentate granule cells generated in adult mice. Hippocampus 2015. doi: 10.1002/hipo.22438. 85. Jamal AL, y col. Transplanted dentate progenitor cells show increased survival in an enriched environment, but do not exert a neurotrophic effect on spatial memory within 2 weeks of engraftment. Cell Transplan 2015. http://dx.doi.org/10.3727/096368915X687011 86. Peters M, Muñoz-López M, Morris RG. Spatial memory and hippocampal enhancement. Current Opinion in Behavioral Sciences 2015. http://dx.doi.org/10.1016/j.cobeha.2015.03.005 87. Dobrossy MD, y col. Differential effects of learning on neurogenesis: Learning increases or decreases the number of newly born cells depending on their birth date. Mol Psychiatry 2003; 8: 974-82. 88. Leuner B, Mendolia-Loffredo S, Kozorovitskiy Y, Samburg D, Gould E, Shors TJ. Learning enhances the survival of new neurons beyond the time when the hippocampus is required for memory. J Neurosci 2004; 24: 7477-81. 89. Dupret D, y col. Spatial learning depends on both the addition and removal of new hippocampal neurons. PLoS biology 2007; 5: e214. 90. Dupret D, y col. Spatial relational memory requires hippocampal adult neurogenesis. PloS one 2008; 3: e1959. 91. Epp JR, Haack AK., Galea LA. Activation and survival of immature neurons in the dentate gyrus with spatial memory is dependent on time of exposure to spatial learning and age of cells at examination. Neurobiol Learn Mem 2011; 95: 316-25. 92. Lacefield CO, y col. Effects of adult‐generated granule cells on coordinated network activity in the dentate gyrus. Hippocampus 2012; 22: 106-16. 93. van Praag H, Kempermann G, Gage FH. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nature Neuroscience 1999; 2: 266-70. 94. Birch AM, McGarry NB, Kelly ÁM. Short‐term environmental enrichment, in the absence of exercise, improves memory, and increases NGF concentration, early neuronal survival, and synaptogenesis in the dentate gyrus in a time‐dependent manner. Hippocampus 2013; 23: 437-50. 95. Kempermann G, Kuhn HG, Gage FH. More hippocampal neurons in adult mice living in an enriched environment. Nature 1997; 386: 493–95. 96. Nilsson M, Perfilieva E, Johansson U, Orwar O, Eriksson PS. Enriched environment increases neurogenesis in the adult rat dentate gyrus and improves spatial memory. J Neurobi 1999; 39: 569-78. 28 www.uv.mx/rm 97. Hillman CH, Erickson KI, Kramer AF. Be smart, exercise your heart: exercise effects on brain and cognition. Nature Rev Neurosci 2008; 9:58–65. 98. Erickson KI, y col. Exercise training increases size of hippocampus and improves memory. Proc Natl Acad Sci U S A. 2011; 108: 3017-22. 99. Muotri AR, Zhao C, Marchetto MC, Gage FH. Environmental influence on L1 retrotransposons in the adult hippocampus. Hippocampus 2009; 19:1002–07. 100. Kempermann, G. New neurons for’survival of the fittest’. Nat Rev Neurosci. 2012; 13:727-36. 101. Liu HL, Zhao G, Cai K, Zhao HH, Shi LD. Treadmill exercise prevents decline in spatial learning and memory in APP/PS1 transgenic mice through improvement of hippocampal long-term potentiation. Behav Brain Res. 2011;218:308-14. 102. O’Callaghan RM, Ohle R, Kelly AM. The effects of forced exercise on hippocampal plasticity in the rat: A comparison of LTP, spatial- and non-spatial learning. Behav Brain Res. 2007; 176:362-6. 103. Leraci A, Mallei A, Musazzi L, Popoli M. Physical exercise and acute restraint stress differentially modulate hippocampal brain-derived neurotrophic factor transcripts and epigenetic mechanisms in mice. Hippocampus. 2015 Mar 26. doi: 10.1002/hipo.22458