¿QUÉ ES EL DOLOR NEUROPÁTICO?
El dolor neuropático aparece por la lesión, enfermedad o sección completa («Desaferenciación’) del sistema nervioso periférico o central, en la ausencia de un estímulo nocivo periférico.
El dolor Neuropático es uno de los mayores desafíos en el manejo del dolor crónico y una de las áreas más prometedoras en la investigación de dolor.
El dolor neuropático es uno de los problemas importantes en el campo del dolor crónico no neoplásico y también del dolor de cáncer. Es muy importante la comprensión de que la neuropatía puede existir sin dolor y de que el dolor puede existir sin evidencia de lesión del nervio. El dolor neuropático, por lo tanto, puede ser definido como una sensación o experiencia emocional desagradable asociada con la disfunción o lesión del sistema nervioso.
Su reconocimiento como un factor importante en el dolor de cáncer ha sido tardío y el diagnóstico es complicado frecuentemente por el hecho de que ese dolor de cáncer puede comenzar como un problema sobre todo nociceptivo y luego progresivamente puede convertirse en algunos casos en una mezcla de dolor nociceptivo y neuropático.
El dolor neuropático se diferencia de la nocicepción normal en que las vías nociceptivas normales están alteradas por respuestas prefijadas a la lesión neural o por procesos patológicos. Así, en lugar de generar un potencial de acción iniciado después de una suficiente sumación, se genera un potencial de acción aberrante desde un estímulo normalmente inocuo.
Se propone actualmente que el dolor neuropático sea dividido en tres distintas grandes categorías: dolor desaferentivo, dolor mediado por el simpático y neuropatía periférica. La diferenciación entre estos grupos de dolor neuropático es a veces difícil por la combinación de procesos patológicos y las variaciones de las manifestaciones clínicas.
Conviene entender una serie de términos que aparecen frecuentemente al hablar de dolor neuropático:
Alodinia
Dolor debido a un estímulo que no provoca normalmente dolor.
Hiperalgesia
Respuesta aumentada a un estímulo doloroso.
Anestesia Dolorosa
Dolor en una superficie o región anestésica.
Causalgia
Un síndrome de mantenido dolor quemante, alodinia e hiperpatía después de una lesión traumática de nervio, frecuentemente combinada con disfunción vasomotora y sudomotora y luego cambios tróficos.
Disestesia
Una sensación anormal desagradable, espontánea o evocada.
Parestesia
Sensación anormal, de tipo «calambre» u «hormigueo»
Hiperpatia
Un síndrome doloroso, caracterizado por la reacción aumentada a los estímulos, especialmente un estímulo repetitivo.
Hipoalgesia
El dolor disminuido con respecto al estímulo normalmente doloroso.
Neuralgia
Dolor en la distribución de un nervio o nervios.
Neuritis
La inflamación de un nervio o nervios
Fisiología de la Nocicepción Normal
La fisiología de la conducción nerviosa implica cuatro componentes funcionales que pueden transformar las señales de entrada en liberación de neurotransmisor.
Primer Componente
El primer componente es una señal de entrada (input) que, tras contactar con receptor dendrítico a suficiente intensidad, induce la generación de un potencial receptor, que transforma un estímulo sensorial en una señal eléctrica local.
Segundo Componente
El segundo componente funcional es la señal de integración. Debido a que el potencial receptor local no puede por él mismo generar un potencial de acción, debe ser modificado por una transmisión activa adicional. Si los potenciales del receptor desarrollan una suma integrada lo suficientemente excitatoria, se iniciará el potencial de acción. Si no se genera ese potencial de acción, la señal de entrada se disipa sin una respuesta perceptible.
Tercer Componente
El tercer componente funcional de la conducción nerviosa es la propagación continuada del potencial de acción a la médula espinal. El axon nervioso es el componente anatómico del sistema nervioso responsable de la propagación del potencial de acción. La lesión traumática al axón es común, debido a la frecuentemente larga y tortuosa ruta hacia la médula espinal que convierte al axón vulnerable a la lesión.
Cuarto Componente
El cuarto componente funcional es el relevo del estímulo a las estructuras cerebrales del sistema nervioso central. El asta dorsal es la región de la médula espinal cuyo propósito principal es recibir el estímulo aferente de la periferia, modificar la señal de entrada de acuerdo a las influencias descendentes de los centros cerebrales superiores, y relevar la información resultante a los centros cerebrales superiores para continuar el proceso. alto umbral.
Cuando este sistema funciona correctamente, se produce la nocicepción normal; sin embargo, cuando alguna alteración ocurre, el mensaje es distorsionado, inadecuado, o prolongado y tiene consecuencias patofisiológicas anormales. Este fenómeno puede ser descrito como dolor neuropático.
Mecanismos del Dolor Neuropático
Lesiones de Codificación Neuronal
El final distal de la neurona aferente somatosensorial es un especializado transductor que codifica un apropiado estímulo en impulsos eléctricos. La sensibilización de estos terminales periféricos se considera que es un componente vital de la hiperalgesia.
Lesiones de Conducción Neuronal
La lesión de un axón puede alterar las propiedades normales de conducción pasivas del axón y inducir una fuente ectópica, química o mecánica, de aberrantes potenciales de acción.
La actividad eléctrica es una propiedad de todos los neuromas. Se cree que factores como la isquemia tisular, infección, inflamación, presión mecánica, y agonistas adrenérgicos pueden excitar el brote de axones y provocarlos a generar actividad eléctrica anormal, que puede ser percibida como dolorosa.
Parece demostrada la capacidad del neuroma en generar sensaciones dolorosas al aliviar el dolor mediante la excisión de dicho neuroma. Desafortunadamente, el dolor reaparece con la inevitable regeneración del neuroma. Además, la analgesia mediante el bloqueo de la conducción y bloqueo simpático demuestra el efecto del medio extracelular sobre el neuroma doloroso.
La generación de picos axonales, un anormal tipo de conducción resultante de las variadas velocidades de conducción enun simple axón debido a la alteración del diámetro axonal o de la mielinización, puede conducir a un autopropagado estado de excitación a partir de un único estímulo. El efecto de tal actividad eléctrica podría terminar en la percepción de dolor desde un estímulo inocuo, un fenómeno llamado alodinia.
El denominado «cross-talk» ha sido también implicado como un posible mecanismo de dolor neuropático. Obedece a la presencia de conexiones eléctricas entre axones en el neuroma, además de en segmentos axonales degenerados y regenerados. Estas conexiones han sido también observadas en axones desmielinizados. Si un aferente mecánico de bajo umbral es unido a un axón nociceptivo, la estimulación por un simple contacto suave podría ser interpretada clínicamente como dolor o hiperestesia.
Hiperactividad de los Nociceptores Aferentes Primarios
Cualquier proceso patológico que conduzca a aumento de descarga de los nociceptores aferentes primarios (PANs) puede producir dolor, dado que sus conexiones centrales están intactas.
Hay dos clases de patología nerviosa que podrían causar incremento de la actividad de los (PANs): la activación fisiológica de los nociceptores nervi nervorum y la actividad anormal en los nociceptores aferentes primarios lesionados.
Los nervios periféricos tienen una inervación derivada extrínsecamente vía haz neurovascular y parte de la inervación es por nociceptores desmielinizados. Un proceso inflamatorio que implique al nervio podría, por ejemplo, activar a los PANs quimiosensitivos que normalmente inervan a los tejidos conectivos de la vaina; aunque no hay evidencia directa que soporte este mecanismo, la neuropatía aguda inflamatoria desmielinizante (Guillain-Barré) es un ejemplo de una condición que podría provocar dolor a través de la actividad en el nervi nervorum. Debido a que la patología es de desmielinización, los axones no mielinizados están relativamente reservados y la sensación de dolor en estos pacientes es típicamente normal en los tests clínicos. Esto indica que los axones de PANs que corren con los nervios están intactos.
Síndrome de Guillain Barré
El Guillain Barre es doloroso. El dolor es usualmente profundo y tiene una cualidad de tipo dolorimiento más propio de los dolores musculoesqueléticos.
Un segundo tipo de mecanismos para la activación de nociceptores se presenta cuando los axones PAN en el tronco nervioso son directamente dañados. Aunque la evidencia de lesión clínica a los PANs es una de las más ubicuas características de los pacientes con dolor neuropático, esta correlación no prueba que la actividad en los disfuncionantes PANs genere la señal de dolor. La evidencia que favorece esta idea viene de estudios animales que muestran que los axones PAN dañados exhiben actividad espontánea, sensibilización y aumentada sensibilidad mecánica.
Se ha demostrado que los PANs disfuncionantes pueden generar una señal de dolor en ausencia de estímulo nocivo. Se propone que el dolor y calor es debido a actividad espontánea en PANs sensibilizados con liberación periférica de péptidos vasodilatadores como la substancia P. Estas tres observaciones apoyan la idea de que en algunos pacientes con dolor neuropático, la actividad espontánea que surge en los terminales periféricos de los PANs disfuncionantes es crítica para la generación de una señal dolorosa.
El hecho de que impulsos ectópicos espontáneos en aferentes primarios lesionados sean sensibles al bloqueo por bloqueantes de los canales del sodio, es el mecanismo de la probada eficacia de los anestésicos locales y sus derivados en neuropatía diabética (mexiletina), neuropatía traumática (mexiletina), y neuralgia postherpética (lidocaína) en los que hay actividad ectópica espontánea en PANs dañados. Además, el uso parenteral de anestésicos locales parece tener una amplia eficacia analgésica incluyendo condiciones de dolor asociadas con la lesión de PANs.
Lesiones de transmisión neuronal
Las lesiones de sistema de transmisión del asta dorsal incluyen cambios en el sistema nervioso central que suceden como respuesta a la enfermedad o lesión del sistema nervioso central o periférico.
La presencia de eléctricamente silentes sinapsis entre las células del asta dorsal puede aparentemente ser desenmascarado súbitamente por la lesión axonal, por eso cuando una neurona es seccionada la célula recibe el influjo de un axón diferente y adopta su campo receptivo. Este suceso podría permitir que un estímulo aferente inocuo sea recibido por la neurona axonotomizada y sea interpretado como dolor.
Lesión Espinal
Frecuentemente pacientes con lesiones en la médula espinal (LME) sentirán dolor en superficies por debajo del nivel de la lesión. Una razón posible para estos es el brote de neuronas aferentes primarias intactas en la región denervada. Se ha demostrado, en animales experimentales, que cuando un nervio periférico se corta, los nervios que están en el área cutánea adyacente envían ramas colaterales dentro del área denervada. Además, el área ahora inervada por el nervio colateral genera una hiperrespuesta a estímulos levemente nocivos.
El sistema nervioso simpático puede contribuir también a la sensibilización de neuronas aferentes primarias. Además, el bloqueo simpático puede, en algunos casos, aliviar el dolor asociado con lesiones del SNC. La activación de neuronas simpáticas postganglionares aumenta la excitabilidad de neuronas aferentes primarias colaterales. La sensibilización simpática se cree que está mediada por la liberación de noradrenalina que luego actúa por medio del receptor alpha2-adrenergico.
Otro mecanismo, en LME, que se cree puede ser causante de dolor neuropático es la pérdida de mecanismos inhibitorios normalmente activos. Las fibras posteriores de la médula ejercen una influencia inhibitoria sobre los aferentes del dolor en la vía lateral y la evidencia clínica sugiere que la integridad de esta vía es importante en la expresión de hiperalgesia, por lo tanto es posible que este equilibrio sea destruido con lesiones de la médula espinal y este mecanismo sólo o en combinación con el otro descrito arriba provoque dolor continuo.
Activación de Vías Alternativas Fuera de la Médula Espinal
El concepto de «plasticidad» del sistema nervioso origina la posibilidad del desarrollo de vías sensitivas alternativas. Esto puede ocurrir mediante el rebrote de aferentes viscerales nociceptivos que unen la médula espinal a un nivel más alto, a través de la activación de aferentes vagales silentes o a través de la activación de una respuesta sistémica general que sigue a una reacción neurohumoral generada localmente. Hay evidencia reciente que incluso aun las neuronas espinales pueden regenerar a veces bajo la influencia de cantidades y tipos apropiados de neuropéptidos espinales. La involucración del sistema nervioso simpático es sugerida también por los cambios vasomotores y otros autonómicos cambios vistos en casos de LME.
Activación de Vías Alternativas dentro de la Médula Espinal
En pacientes con lesiones incompletas, el dolor puede también ser resultado de la conducción a través de vías alternativas dentro de la médula espinal. La vía dorsal de la columna, tracto espinocervicotalámico, espinoparabraquial, espinohipotalámico y sistema ascendente multisináptico se sugieren como candidatos de esta vía. Estas vías normalmente subsidiarias o latentes pueden llegar a ser activadas con lesiones de las vías espinotalámicas laterales.
Mecanismos Centrales
Otro concepto importante en la investigación de los mecanismos de dolor neuropático es que la lesión del sistema nervioso periférico puede provocar una profunda reorganización neuro-anatómica, patofisiológica y incluso muerte celular en el neuroaxis central.
Parece que la actividad del receptor N-metil-d-aspartato (NMDA) juega una parte importante en muchos de estos cambios. Así una nueva vía de investigación ahora se centra alrededor del NMDA y asociados receptores en la médula espinal y quizás a niveles más altos del neuroaxis.
La activación de aferentes mielinizados tiene un significado efecto inhibitorio sobre la intensidad de dolor producido por los PANs activos.
Algunos estímulos inocuos son capaces de producir dolor mediado por axones aferentes no mielinizados cuando los aferentes mielinizados que inervan la misma región cutánea están bloqueados. Hipótesis como esta contribuyen a la hipótesis de control de la puerta de entrada de Melzack y Wall(1965) que postularon que los aferentes mielinizados activan una interneurona inhibitoria en la sustancia gelatinosa («la puerta») que modula la transmisión neuronal de dolor a través de las no mielinizadas.
A pesar de todo este mecanismo no se ha visto totalmente corroborado por los resultados clínicos. Los métodos más aplicados han sido la estimulación eléctrica transcutánea (TENS) y la estimulación de raíces posteriores de columna dorsal o lumbar.
Excitabilidad Aumentada de Neuronas Transmisoras de Dolor Central
La lesión de las neuronas aferentes primarias es fuente de varios cambios que ocurren en las neuronas somato-sensoriales centrales. Dos de estos mecanismos son:
Hiperactividad por desaferenciación
Estudios experimentales han demostrado que algunas neuronas desaferenciadas del asta dorsal, desarrollan altos niveles de actividad espontánea tras la rizotomía dorsal. Uno de los ejemplos más claros de esto es el síndrome de desaferenciación por avulsión del plexo braquial. La mayoría de estos enfermos tienen gran dolor.
Excitación central prolongada por inducción de nociceptor
La prolongada o repetitiva entrada de PANs no mielinizados produce un progresivo incremento en la descarga neuronal en el asta dorsal y respuesta subjetiva al posterior estímulo cutáneo.
El wind up es un ejemplo de esto. El wind up se refiere a la observación en neuronas nociceptivas del cuerno dorsal de que entradas idénticas repetidas de PANs no mielinizados están asociadas a un incremento progresivo en la descarga producida por cada estímulo. El wind up puede ser suprimido por opioides, antagonistas receptor substancia P, y bloqueantes de los canales iónicos del receptor NMDA.
La incrementada excitabilidad de neuronas del cuerno dorsal por descargas en PANs no mielinizados puede representar una prolongada despolarización debido a entrada de péptidos y calcio a través del receptor NMDA. Si la substancia P y los aminoácidos que actúan sobre el receptor NMDA contribuyen significativamente al dolor neuropático, los antagonistas de estas acciones podrían representar otro avance terapéutico.
La ketamina tiene un efecto bloqueante sobre los canales iónicos del receptor NMDA, además de tener otros efectos analgésicos.
Características del Dolor Neuropático
Dolor en ausencia de lesión tisular continua.
La iniciación demorada después de la cirugía o trauma: Disestesias, descritas como quemazón o eléctricas.
Frecuentemente paroxismos, disparando o apuñalando.
Dolor en superficie de pérdida sensitiva.
Alodinia, sumación y after-reacción son comunes.
Diagnóstico del Dolor Neuropático
El diagnóstico puede también ser ayudado por ensayos objetivos tales como velocidades de conducción de nervio, electromielogramas y diversos estudios de imágenes, incluyendo TC, mielograma y RNM. Sin embargo, la interpretación de los lo anteriores ensayos no puede hacerse en ausencia de la historia y examen clínico. Una asistencia diagnóstica adicional para determinar la involucración posible de hiperactividad simpática es el test de fentolamina EV.
Manifestaciones Clínicas
Neuropatías Periféricas Difusas
Las manifestaciones más comunes de este tipo de neuropatía vienen causada por diabetes, AIDS, estados de déficits relacionados con el alcohol y exposición a tóxicos.
Neuropatía diabética
Es la causa más frecuente de neuropatía. Una alta proporción de pacientes de diabéticos. Durante algunos años sufrirá ligera o moderada neuropatía difusa sensorial. Se acompaña frecuentemente de parestesias dolorosas y quemante y lancinante dolor. La presencia de dolor indicará la afectación de fibras de pequeño calibre.
Existe una clara relación entre el grado de hiperglicemia y la hemoglobina glicosilada y la presencia de neuropatía.
La diabetes puede ocasionar: Neuropatías craneales, Mononeuropatías de tronco y extremidades, Neuropatía motora proximal (amiotrofia diabética), Neuropatía autonómica, Polineuropatía sensitiva o sensitivo-motora.
Neuropatía por AIDS
Hasta un 90% de pacientes con AIDS desarrollan una neuropatía. La forma más común de dolor que presentan es una neuropatía sensitiva distal y simétrica.
Debe tenerse en cuenta que los fármacos administrados a estos enfermos para el tratamiento de las infecciones oportunistas pueden provocar neuropatías periféricas y complicar el diagnóstico diferencial.
Neuropatías relacionadas con alcohol y estados deficitarios
El alcohol sólo no causa una neuropatía periférica. La causa más probable se cree que es la deficiencia nutricional. Y es la eliminación del consumo de alcohol, la buena nutrición y los suplementos de vitaminas los que pueden conducir a una mejora de la neuropatía.
Neuropatías tóxicas
El dolor es frecuente en neuropatías inducidas por talio y arsénico. Otras sustancias como el plomo y mercurio usualmente causan neuropatías no dolorosas.
Neuropatías Focales
Síndrome de túnel carpiano
Es uno de las más comunes neuropatías por atrapamiento y a menudo ocurre sin ningún trauma externo. Una causa frecuente del síndrome es la acción repetida o mantenida de flexión o hiperextensión de la muñeca. Predisponen también a este síndrome el embarazo, hipotiroidismo, acromegalia, artritis reumatoide y diabetes. Y la autoinmunidad
La sintomatología es una parestesia dolorosa que afecta a los tres primeros dedos. Al progresar la compresión del mediano, el dolor aumenta y se extiende a todos los dedos, la muñeca y el antebrazo. Tardíamente puede haber atrofia de la eminencia tenar.
Meralgia parestésica
A menudo ocurre tras rápidas ganancias o pérdidas de peso. En muchos pacientes sin embargo no hay ninguna causa aparente. A menudo el problema se resuelve espontáneamente en pocas semanas o meses. Síntomas característicos son parestesias y dolor en la cara anterolateral del muslo. Se presenta pérdida sensitiva o hiperestesia en esa zona. La bipedestación y la deambulación a menudo agravan el cuadro. La causa es el atrapamiento del fémorocutáneo lateral en el músculo psoas, en la pelvis y más comúnmente en el punto de unión del ligamento inguinal a la espina ilíaca anterosuperior.
Neuralgia postherpética
Alto grado de incidencia en el dolor neuropático.
Patologías Diversas
Finalmente podemos colocar en un gran grupo las siguientes entidades patológicas como causantes también de dolor neuropático: CRPS I, CRPS II, Dolor de miembro fantasma, Neuralgias, Dolor post-toracotomía, Dolor post-AVC, Síndrome talámico, Aracnoiditis, Dolor facial atípico, Avulsión plexo braquial.
Tratamientos del Dolor Neuropático
Bloqueos simpáticos, Procedimientos quirúrgicos, Descompresión, transposición, Técnicas neuroestimulativas, TNS, estimuladores medulares, Preparados tópicos, Capsaicina, EMLA,Fármacos sistémicos.
Tratamiento Farmacológico
Antidepresivos tricíclicos
amitriptilina(NAdr,serotonina), desipramina(NAdr), paroxetina (serotonina), fluoxetina (seroto)
Anticonvulsivantes
carbamazepina, clonazepam, valproato, gabapentina
Anestésicos locales
lidocaína, mexiletina Opioides (tramadol)
Bloqueantes receptores NMDA
Ketamina Capsaicina Corticoesteroides
Adrenérgicos a 2
clonidina
CRIOTALAMOTOMIA ESTEREOTÁCTICA DE LOS NÚCLEOS CM, PF Y DM EN EL DOLOR.
Tesisi doctoral de ENRIQUE RUBIO GARCIA.
La lesión bilateral y simétrica de los núcleos del tálamo, Centro Mediano, (CM), Parafascicular (PF) y Dorso Medial (DM), produce una analgesia en los dolores intratables por procedimientos medicos y quirurgicos.
Es conocido desde los años 1960 por los trabajos de Hassler, que la lesión de los núcleos somatosensoriales del talamo. Ventral Postero Lateral (VPL) y Ventral Postero Medial (VPM), producían dos tipos de alteraciones:
a.- Una dramática perdida de todas las sensibilidades contralaterales y la aparición en un alto porcentaje de los enfermos de disestesias contralaterales insufribles para el enfermo.
b.- Rara vez desaparecía el dolor y cuando lo hacia era por breves periodos de tiempo (109.102). Estas caracteristicas se correspondían con el conocido síndrome de Dejerine-Roussy.
La observación animal permite ver dos tipos sistemas de conducción. Uno primitivo grueso, de representación bilateral y con estancia previa e el tronco del encéfalo que constituye el Paleoespinotalamico, que conduce casi exclusivamente sensaciones dolorosas y es mas propio de las aves . Otro sistema de conducción filogenéticamente de aparición posterior , que es el Neoespinotalamico , propio de mamíferos y mas aun de primates que recoge las proyecciones contralaterales de las vías sensitivas.
Por el sistema Paleoespinotalamnico, caminan las vías sensitivas que tras hacer estancia en el tronco del encefalo y mezclarse con el sistema reticular, pasan bilateralmente hacia ambos talamos, por dentro de la lamina medular interna y son conocidos como núcleos intralaminares de tálamo y forman lo que se conoce como vías extralemniscales de las sensibilidades (43,150,174,198,).
Esto demostraba que no todos los estímulos sensitivos pasan por los núcleos somatosensoriales de ambos talamos, sino que muchos de ellos eran extralemniscales , constituyendo las fibras retículo-talamicas de disposición medial al tracto espino talamico que terminan en los núcleos intralaminares del tálamo: Paracentral, Lateral Central, Centro Mediano y Parafascicular. Este sistema de transporte sensitivo es primitivo, de sensaciones profundas, dolorosas y mal localizadas . Mientras que las sensaciones que desembocan en los núcleos VPM y VPL también de ambos talamos son mas concretas superficiales y escasamente dolorosas .
De forma que la lesión de los núcleos VPL y VPM; solo rompía el equilibrio de los relés de las sensaciones no dolorosas que no conseguían accion terapéutica ( 8174,201,224).
Nauta demostró que las vías extralenniscales del dolor eran multipless tanto en animales como en el hombre y sus proyecciones colaterales terminaban en los núcleos intralaminares del talamo (184,185).
En los años 1960 se demostró por varios autores, que las lesiones de los núcleos intralaminares se seguían de la desaparición del dolor crónico
La lesión tenia que ser bilateral y simetrica y por dentro de la lamina medular interna y en ambos talamos para que fuera efectiva y esto se había demostrado en necropsias (223,227).
El componente emocional del dolor desembocaba en el lóbulo prefrontal através de las proyecciones sensitivas que llegaban al núcleo DM, lo que permitía al Telencefalo el análisis de la sensación dolorosa Se sabia desde las celebres Leucotomias practicadas por el premio Nobel Egas Moniz en 1927, que se modificaba la personalidad del paciente que la recibia pero ademas aumentaba el umbral del dolor y era frecuente escuchar al paciente decir que el dolor ya no le importaba. Este mismo efecto se obtenia con las lesiones del Cingulo Rostral ,del nucleo DM y del nucleo anterior del talamo asi como lesiones practicas en el lobulo prefrontal (40,60,236).
De forma que las lesiones propuestas para analgesias los dolores cronicos eran, CM, PF y DM, que se extendian a los núcleos reticulares que recibian el dolor extralemniscal y el DM, que vehiculaba el dolor a los lóbulos prefrontales informándoles del componente emocional del dolor.
Material y Método.
Desde los años comprendidos entre 1969 y 1980, se operaron 50 pacientes que sufrirán dolor resistente a todos los procedimientos médicos y quirúrgicos conocidos.
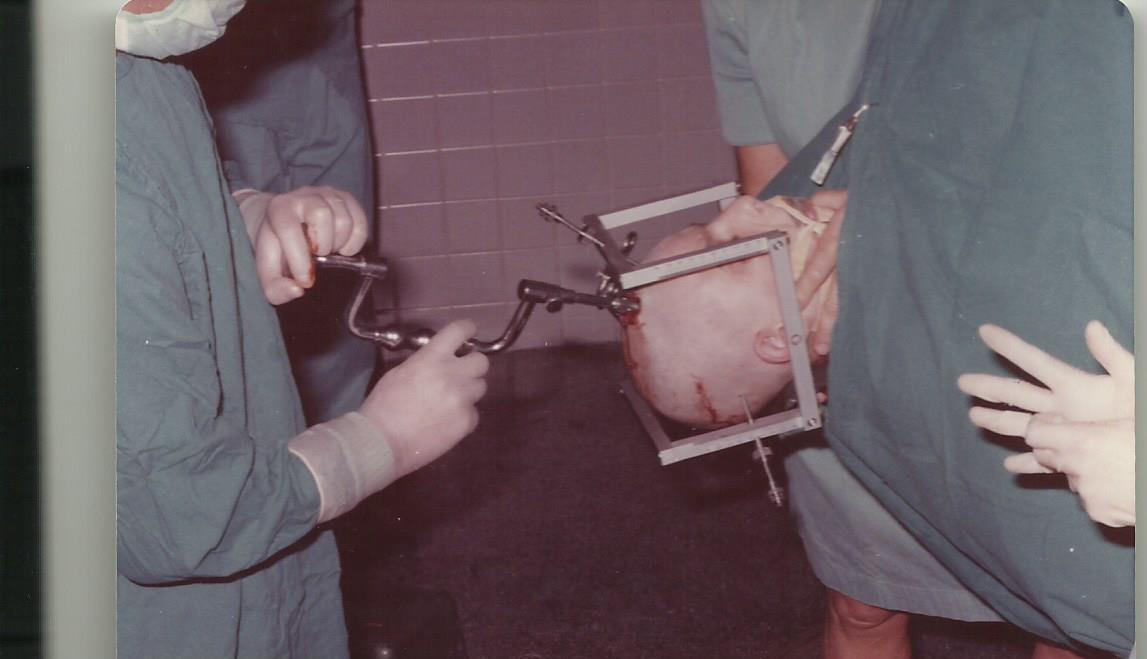
La intervención se hacia colocando con anestesia local un marco estereotaxico diseñado por Leksell, que se colocaba en el craneo sujeto con tres fijadores que entraban en el cráneo hasta la tabla interna previa inyección de anestesia local
La localización de los núcleos se hacia previa ventriculografía a través de un agujero de trepano bilateral y simétrico a nivel de la sutura coronal y a 2,5 cm de la linea media. El contraste que se introducía en el sistema ventricular era una mezcla de aire y Dimer X. La cantidad total era de 8 cc. Era de capital importancia practicar la lesión en el agujero de Monro, para que al rellenar el III ventriculo pudieramos ver las comisuras grises anterior y posterior (CA y CP) con claridad..
Los núcleos a lesionar se localizan inmediatamente por fuera del III ventriculo con la siguiente localización, extraidas del Atlas de Schatelbram y Bayley.
X.- 6mm por delante de la CP
Y.- 2mm por encima del plano CA-CP
Z.- Paret lateral externa de lII ventriculo.
Las lesiones se hacian con nitrogeno liquido que circulaba por dentro de una canula metalica de 2,4 mm de diametro y diseñada por Cooper. (Cooper Criosurgery Systen)
El volumen total de la lesión es un cilindro de 6 mm. de diámetro por 12 mm de generatriz.
La lesión se empezaba enfriando progresivamente la punta de la canula hasta llegar a 200º bajo cero.
Terminada la criotalamotomia, se cerraban las heridas craneales y se trasladaba el paciente a su habitación, totalmente despierto
Tiempo de observación entre 1 y 6 meses. Resultados según la Etiología del Dolor
DOLOR TUMORAL. 39 PACIENTES
Resultado inmediato
39 pacientes Sin dolor 100%
Resultados tardios
36 sin dolor 92,3%.
2 el dolor residual fue moderado 5.1%
1 paciente el dolor siguió igual 2.5%
Un paciente sigue sin dolor y curado de su linfoma abdominal 30 años después
Linfoma abdominal
DOLOR POR DESAFERENTIZACION. 11 PACIENTES
Resultado inmediato
11 sin dolor 100%s
Resultados tardios
2 sin dolor 18,18%
6 moderado 63.6%
3 igual 27,27 %
Complicaciones.
1 paciente con muy mal estado fallecio los 3 dias bruscamente
3 crisis convulsivas
1 sindrome de de Parinaud transitorio
31 paciente presentaron Sindrome frontal, indiferencia afectiva entre 2 y 7 semanas de duracion .
Discusión.
Esta tesis esta hecha en tiempos donde los métodos analgesicos eran escasos y los de utilización quirurugica en la analgesia eran mutilante proporcionando en el postoperatorio mas desaferentizacion que analgesia.
Los resultados fueron mejores en los pacientes con dolor de origen tumoral, donde un 92,3 5 murió sin dolor. Muy posiblemente la menor duración de su vida después de la intervención fue responsable de estos resultados
En los pacientes con dolor de desaferentizacion los resultados fueron pobres ya que solo un 18,18% vivieron y murieron sin dolor. Estos pacientes vivieron mas tiempo y ello condiciona los resultados.
Las complicaciones son escasas, ya que el paciente que murió tenia muy mal estado, como la mayoría de los pacientes tumorales operados.
El síndrome frontal que presentaron muchos pacientes, era beneficioso por que el dolor era entonces un hecho que dejaba de preocuparles y les permitía vivir con cierto bienestar.
Conclusiones
1.- La lesion de los núcleos intralaminaares del talamo con criotalamotomia produce un alto porcentaje de analegesia. Inmediata< a la cirugía. 2.- Pasadas dos semnas los buenos resultados se reducen al 70%. 3.- En los enfermo portadores de neoplasia los resultados fueron superiores. La indiferencia del sindrome frontal les permitio vivir mas bondadosamente. 4.- Los pacientes con lesiones cutaneas, (ULCERAS TROFICAS) mejoraban de ellas marcadamente 5.- Un alto porcentaje de pacientes dejaron de ser adictos a los fármacos , esto fue menor en los pacientes que sufrian dolores por desaferentizacion. 6.- En pacientes con dolores por desaferentizacion y que vivieron marcadamente mas tiempo después de la intervención los resultados fueron claramente peores. Los pacientes con disestesias previas a la intervenion rara vez mejoraron de ellas (neuralgias Posherpeticas, Arrancamiento plexo braquial). 7.- Se pueden considerar escasas las complicaciones. Un paciente fallecio bruscamente