Las células STAb son “una evolución del concepto de CAR-T, Al igual que las CAR-T, que se forman a partir de linfocitos T de los pacientes a los que se inserta receptor antigénico quimérico (CAR), las STAb también parten de linfocitos autólogos pero se modifican mediante vector lentiviral para que puedan secretar un anticuerpo biespecifico (CD19/CD3), similar a los anticuerpos BiTE que se administran por vía sistémica.
Todos estamos compuestos de billones de células que a través del transcurso de nuestras vidas crecen y se reproducen de la manera en que corresponda. Cuando una célula presenta alguna anomalía o ha envejecido, por lo general la célula perece (muere). El cáncer surge cuando algo sale mal en este proceso, ocasionando que las células anormales se reproduzcan y las células viejas no perecen como debería suceder. A medida las células cancerosas se reproducen de forma descontrolada, eventualmente pueden superar en número a las células sanas, Esto hace que al cuerpo le resulte difícil funcionar de la manera que debería hacerlo.
Para muchas personas, los resultados pueden ser exitosos al someterse a los tratamientos contra el cáncer. De hecho, ahora más que nunca hay un mayor número de personas que tienen una vida plena después de haber recibido su tratamiento contra el cáncer.
Existen dos categoría principales de cáncer:
Los cánceres hematológicos (cánceres de la sangre) son tipos de cáncer en los glóbulos sanguíneos, como es el caso con la leucemia, el linfoma y el mieloma múltiple.
Los cánceres de tumor sólido son aquellos tipos que se desarrollan en cualquier órgano, tejido o parte el cuerpo. Los tipos más comunes de cáncer con tumor sólido son el de seno, próstata, pulmón y el colorrectal.
Estos tipos de cáncer puede que presenten algunas similitudes entre sí, pero pueden que sean muy diferentes en la forma que se desarrollan, propagan y responden al tratamiento. Algunos tipos de cáncer crecen y se propagan rápidamente mientras que otros crecen más lentamente. Unos son propensos a propagarse hacia otras partes del cuerpo; otros suelen permanecer confinados en el sitio que se originan.
Algunos tipos de cáncer se tratan mejor con cirugía; otros responden mejor a los medicamentos como la quimioterapia. A menudo se administran dos o más tratamientos para obtener los mejores resultados
Un tumor consiste de una masa o protuberancia (crecimiento). Mientras que algunas de estas masas o tumores son cancerosos, hay muchos que no.
Las masas que no son cancerosas se denominan tumores benignos
Las masas que sí contienen células cancerosas se denominan tumores malignos
Lo que hace que un cáncer sea diferente es por su habilidad de propagarse hacia otras partes del cuerpo mientras que los tumores que no son cáncer (benignos) no lo hacen. Las células cancerosas pueden desprenderse del sitio en donde surgió el tumor. Estas células pueden desplazarse hacia otras partes del cuerpo y terminar en los ganglios linfáticos u otros órganos dificultando que funcionen con normalidad.
Las células cancerosas se desarrollan a raíz de múltiples cambios en su genética. Estos cambios pueden surgir a raíz de muchas causas diversas. El estilo de vida y los genes que heredamos de nuestros padres, así como la exposición a ciertos agentes cancerígenos en el entorno (sustancias o elementos causantes de cáncer) pueden estar entre las causas. Y en muchos de los casos, no hay una causa que sea evidentemente atribuible.
Cuando se detecta cáncer, se hacen estudios o pruebas médicas para su grado de desarrollo y si se ha propagado desde el punto en el que se originó a otros sitios. Esto se llama clasificación de la etapa del cáncer (o estadificación).
Las clasificaciones más bajas de la etapa (como 1 o 2), significa que el cáncer no se ha propagado tanto. Un número mayor (como 3 o 4) significa una mayor propagación. La etapa 4 es la mayor.
La etapa de un cáncer es muy importante para determinar cuál sería el mejor plan de tratamiento para una persona. Consulte con su médico sobre la etapa del cáncer y lo que esto significa en su caso.
El cáncer se puede propagar del lugar en el que surgió (el sitio primario) a otras partes del cuerpo. Cuando las células cancerosas se desprenden de un tumor, éstas pueden viajar a otras áreas del cuerpo a través del torrente sanguíneo o el sistema linfático. Las células cancerosas pueden desplazarse a través del torrente sanguíneo y así llegar a partes u órganos distantes. En caso de que las células cancerosas de desplacen a través del sistema linfático, las células cancerosas puede que se establezcan en los ganglios linfáticos.
Lla mayoría de las células cancerosas que se fugaron del sitio primario perecen o son combatidas antes de que puedan desarrollarse en otro sitio. Pero es posible que un par de estas células se asienten en un lugar en el que podrán desarrollarse y reproducirse formando así nuevos tumores. Esta propagación del cáncer a una nueva parte del cuerpo se denomina metástasis.
Para que las células cancerosas se propaguen a nuevas partes del cuerpo, éstas tienen que pasar por varios cambios. Primero es necesario que puedan desprenderse del sitio del tumor primario y luego que se pueda establecer o adherir a la capa o pared exterior de algún vaso linfático o sanguíneo. Luego tendrían que poder traspasar esta pared o capa para así entrar al torrente sanguíneo o al sistema linfático, alcanzando otros órganos o ganglios en el cuerpo.
Células STAb: la evolución de la terapia CAR que ‘apuñala’ al cáncer
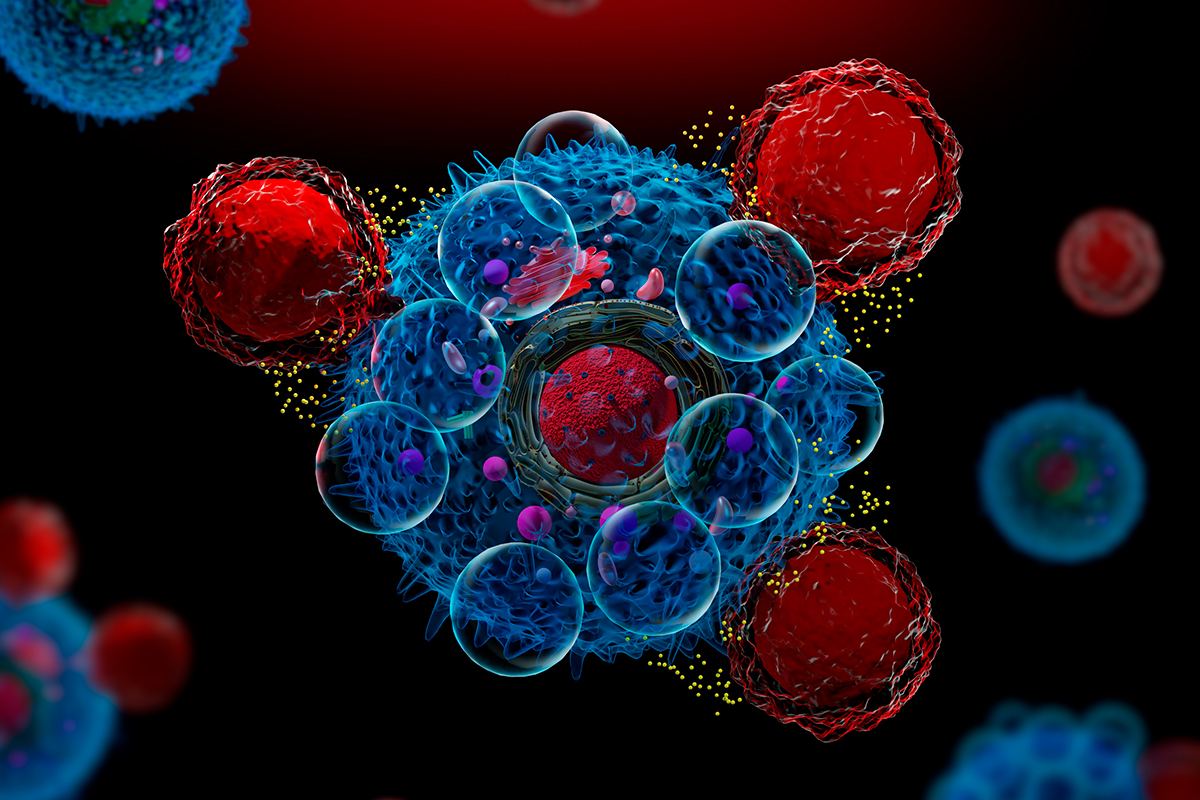
Las terapias CAR-T han supuesto una revolución en el tratamiento de ciertos cánceres de la sangre; las células STAb podrían optimizar esta estrategia.
Su nombre deja bien clara la vocación con la que nacen: las células STAb (acrónimo inglés que significa puñalada y se obtiene de Secreting a targeting bispecific T-cell engager Antibody) están diseñadas para ‘apuñalar’ al cáncer. Esta pionera estrategia ha sido ideada y desarrollada por científicos de la Unidad CRIS de Inmuno-Oncología del Hospital Universitario 12 de Octubre (cofinanciada por la Fundación CRIS contra el cáncer, con el apoyo de Andbank). Esta potencial inmunoterapia celular que supone una vuelta de tuerca de la terapia CAR-T cuenta incluso con patente.
Los datos en modelo experimental de esta nueva inmunoterapia celular son prometedores, como se desprende de uno de los últimos estudios publicados por este grupo, en Cancer Inmunology Research.
Y ahora es el momento de dar el paso hacia el ensayo clínico, que estos científicos esperan poder iniciar a lo largo de este año. Así lo ha confirmado a Diario Médico Luis Álvarez-Vallina, director de la Unidad CRIS, quien cataloga como “absolutamente vertebrador” el impacto de esta Fundación en la investigación.
Evolución de una terapia revolucionaria
Las células STAb son “una evolución del concepto de CAR-T, que ya está obteniendo resultados espectaculares en diversos tumores hematológicos, sobre todo los dirigidos frente a CD19 y BCMA”, comenta Álvarez-Vallina. Al igual que las CAR-T, que se forman a partir de linfocitos T de los pacientes a los que se inserta receptor antigénico quimérico (CAR), las STAb también parten de linfocitos autólogos pero se modifican mediante vector lentiviral para que puedan secretar un anticuerpo biespecifico (CD19/CD3), similar a los anticuerpos BiTE que se administran por vía sistémica.
Equipo de la Unidad CRIS de Inmuno-Oncología del Hospital Universitario 12 de Octubre de Madrid.
“La principal ventaja que ofrece nuestra estrategia es una respuesta inmune muy potente. Las CAR-T solo redirigen a las células que expresan el receptor quimérico, mientras que las STAb redirigen a todo el conjunto de células de T que se encuentren en el entorno tumoral. En modelos in vitro hemos comprobado que producen un efecto bystander por el que se reclutan células T normales, lo que consigue una respuesta citotóxica más efectiva, y con dosis más bajas”, explica el director de la Unidad. Así, de forma metafórica, a células STAb arman, a modo de puñales a otras células del sistema inmunitario, reclutando a más linfocitos para la causa antitumoral y amplificando su efecto.
En el laboratorio también han comprobado que la sinapsis inmunológica -estructura que se forma siempre que una célula inmune interacciona con una célula diana- creada por las STAb es más parecida a la fisiológica que la generada por las CAR-T (menos organizada, considerada no canónica).
Más allá de este revelador detalle del mecanismo del proceso, los científicos han comprobado en modelos experimentales in vitro e in vivo que la terapia con STAB reduce la recaída, “al resultar más eficiente en evitar el escape tumoral” que la inmunoterapia CAR.
Álvarez-Vallina recuerda que la tasa de respuesta a las CAR es muy alta, pero sigue habiendo un subgrupo de pacientes que recaen al cabo de un tiempo. “Pensamos que con nuestra estrategia evitaríamos recaídas, que pueden ser uno de los grandes problemas en las estrategias actuales de inmunoterapia de base celular“.
Indicaciones actuales de las CAR-T en el cáncer hematológico
Un potencial por explorar en las CAR: fibrosis cardíaca, lupus y hepatitis B
Las CAR pisan el acelerador y se adelantan a la segunda línea terapéutica
El proyecto STAb nace en esta unidad, con la colaboración de investigadores de otros centros como el Centro de Biología Molecular, el Hospital Clínic de Barcelona (que aporta el anticuerpo anti CD19 desarrollado allí y que sirvió de base para su CAR-T académico ARI-0001)y el Instituto Josep Carreras, entre otros.
Un ensayo ‘first-in-human’
 Luis Álvarez Vallina.
Luis Álvarez Vallina.
“Esperamos iniciar la fase I del ensayo clínico en los próximos meses. En colaboración con el Servicio de Hematología del 12 de Octubre, y también con la participación del Clínic y el ICO de Barcelona, y el Hospital La Fe de Valencia, incluiremos a pacientes con diferentes patologías, tanto leucemias, como linfomas. También consideraremos a determinados enfermos que estén en recaída tras recibir CAR-T», detalla sobre lo que será el primer estudio clínico en evaluar un concepto totalmente pionero a nivel mundial.
La investigadora Belén Blanco, que forma parte del equipo de la Unidad CRIS de Inmuno-Oncología, subraya la importancia del proyecto: “Vemos la cercanía de llevarlo a la clínica y curar a pacientes. Las células CAR-T y otras opciones de inmunoterapia han tenido éxito en los últimos años para curar a un porcentaje de pacientes, pero queda otro alto porcentaje que no logra beneficiarse de estas terapias y por eso es tan importante seguir avanzando en nuevas estrategias. Creemos que la estrategia STAb puede tener un efecto muy importante en pacientes en los que la terapia CAR-T no es efectiva”, y añade: “el papel de CRIS en este proyecto es muy fundamental al dotar de fondos para llevar a cabo la investigación y porque permite financiar la contratación de investigadores muy formados que, desafortunadamente en muchas ocasiones, no son financiados en nuestro país por agencias públicas”.
Junto a este proyecto, el director de la unidad destaca otra investigación que están llevando a cabo con tecnología ARNm, la misma que se ha empleado exitosamente con las vacunas de la covid. “Trabajamos en modificar los linfocitos T para introducir el anticuerpo biespecífico mediante ARN y generar así las células STAb”.
Sonia Moreno. MadridDom, 20/03/2022 – 08:00