‘NATURAL KILLER’ SU APLICACIÓN
La célula NK (del inglés Natural Killer), asesina natural o célula asesina es un linfocito, y un componente importante del sistema inmunitario innato para la defensa del organismo. Su función es la destrucción de las células infectadas y de las células cancerosas, además de regular las respuestas inmunitarias. No son células fagocíticas, destruyen las células a través del ataque a su membrana plasmática causando la citolisis.
Se cree que estas células detectan a la célula diana por reconocimiento del glicocálix anómalo. También se cree que las reconocen cuando las células infectadas o tumorales pierden la MHC de clase I, las cuales inhiben la acción de las células NK.
Anatomía microscópica
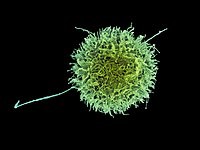
Linfocito NK mostrando su superficie vellosa típica. Microscopio electrónico de barrido.
Con el microscopio óptico se ven como linfocitos llenos de gránulos citoplasmáticos por lo que se conocían como células LGG (Linfocito Grande Granuloso). Morfológicamente son casi indistinguibles a los linfocitos grandes excepto por los gránulos que contienen.

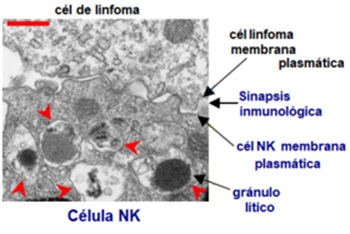
Célula NK (en la mitad inferior) con sus gránulos líticos característicos. Unión de membranas plasmáticas de la célula NK con su célula blanco (en el tercio medio). Microscopio electrónico de transmisión.
Con el microscopio electrónico se caracterizan por sus gránulos y la estructura de los mismos. Los gránulos líticos que se encuentran en el citoplasma de la célula NK, son lisosomas secretores. Esto significa que presentan características tanto del compartimento celular lisosómico, como de la maquinaria secretora especializada de la célula NK. El resultado es un orgánulo de doble función, una función especializada en actividades destructivas debido a sus propiedades lisosómicas y además una función secretora asociada.1
Fisiología
No expresan un receptor de membrana especial de los linfocitos, el receptor de linfocito T (TCR) que es el receptor de membrana característico de los linfocitos T, tampoco expresan el BCR (receptor característico de los linfocitos B), ni CD3 (que es una molécula que hace parte del complejo del receptor TCR), etc. También se las conoce como célula nula. Además, no madura en el timo, como lo hacen los linfocitos T. Se desarrolla en la médula ósea y como ya se había mencionado, no posee los marcadores de superficie característicos de los linfocitos B y T.
Tampoco expresan marcadores celulares fenotípicos que tradicionalmente identifican al resto de las subpoblaciones de linfocitos. En sus membranas sólo expresan CD2, CD16 y LFA-1, diferenciándolas de los linfocitos T que siempre son CD3+ y CD16–. Se localizan principalmente circulando en sangre y en el bazo, rara vez en otros tejidos. Otro marcador usado para identificar a las células NK es el CD56.
Funciones]
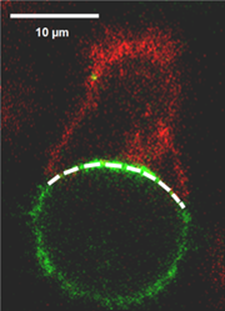
Sinapsis inmunológica entre un linfocito NK arriba en rojo y su célula objetivo en verde.
Esquema que muestra la interacción del patógeno con los Linfocitos T CD8+ y las células NK (en inglés)
Los linfocitos granulares NK, son identificados por su habilidad para reconocer y matar células tumorales o infectadas por virus y bacterias, sin necesidad de antígeno sensibilizante.2
Las células asesinas NK, tienen la capacidad de diferenciar las células infectadas por un virus, o las células tumorales que han sufrido transformaciones malignas. Son capaces de identificar qué células son propias del hospedador y cuales son foráneas.
Esto pasa gracias a que los receptores de membrana de la célula asesina detectan la presencia de las MHC de clase 1 en este tipo de células dañadas y receptores inhibidores en células sanas. Este sistema sencillo de reconocimiento de las células sanas y de las células dañadas es muy eficaz.
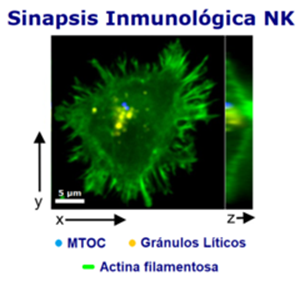
Sinapsis inmunológica NK
Sinapsis inmunológica NK, vista desde la célula objetivo. Ubicación de las diferentes dominios supramoleculares. El eje Z muestra el espesor completo de la célula NK, con la disposición cortical del centro organizador de microtúbulos o MTOC (en azul) y de los gránulos líticos. Microscopio confocal.
La citotoxicidad requieren de una zona de contacto intercelular estrecho, entre la célula NK y su célula objetivo; esta zona es la sinapsis inmunitaria, a través de la cual pueden liberarse moléculas para desencadenar la citolisis.3
Esta interfase NK especializada, está finamente regulada, porque es crítica para el proceso de citotoxicidad, pero también para la inhibición, la regulación y la co-estimulación inmunológicas.4
Receptores activadores
Los receptores de activación de células NK se acumulan mediante un proceso dependiente de actina en las sinapsis inmunes citotóxicas, donde proporcionan señales sinérgicas que desencadenan las funciones efectoras de células NK.
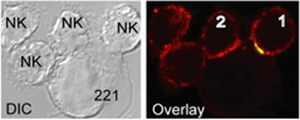
Sinapsis inmunitaria NK, pueden ser tanto activadoras (célula NK#2), como inhibidoras (célula NK#1) con sus células blanco (221). Imagen izquierda contraste de fase; imagen derecha: inmunofluorescencia las diferencia por colores.
Receptores inhibidores
En contraste, los receptores inhibidores de las células NK, la familia de receptores MHC tipo I (KIR), se acumulan en las sinapsis inmunes inhibitorias, bloquean la dinámica de actina y evitan la fosforilación dependiente de actina de los receptores de activación. De esa manera la capacidad citotóxica queda bloqueada.5
Además de este sistema liberan interferón y otras citocinas para desencadenar su respuesta inespecífica y destruir la célula que ha expulsado dicha sustancia, al verse atacada por una acción vírica. El reconocimiento de células diana induce a la movilización de gránulos hacia el sitio de contacto, los cuales contienen granzimas y perforinas. Estas proteínas forman un complejo, junto con una tercera proteína que actúa como carrier, el cual es endocitado por la bacteria. Esta endocitosis esta mediada por el receptor manosa 3-fosfato. Las perforinas desestabilizan la membrana del endosoma, liberando a las granzimas, que inducen apoptosis celular
Activación

La célula NK (en rojo), provoca la citolisis de una célula de cáncer de mama. En este ejemplo el proceso dura 6 horas (360 minutos).
Las células NK se activan por interferones, los cuales son producidos por las células infectadas por virus (es un proceso feed-back). También se activan por otras citocinas: las interleucinas-2, las cuales se forman en los linfocitos T activados.2
Una vez que el sistema inmunitario específico se ha activado, los anticuerpos tienen un papel de activación de las células NK, pues éstas también tienen función citotóxica (tóxicas para la célula). Las células NK poseen receptores específicos para la región Fc de la inmunoglobulina G (FcγRIII). Cuando una célula está infectada por virus, los antígenos de éstos, se presentan en la superficie de la célula infectada y los anticuerpos unidos a la NK, a su vez se unen a la célula infectada.
A las células NK activadas por interleucinas-2 en laboratorio, se las denomina células LAK.
Una nueva aplicación de estas células, amplian su utilidad.
‘NATURAL KILLER’ PERMITIRÍA ELIMINAR LA INFECCIÓN POR VIH
Un estudio liderado por los grupos de investigación en Enfermedades Infecciosas y CIBBIM-Nanomedicina. Nanopartículas Farmacocinéticas del Valle de Hebrón Instituto de Investigación (VHIR) ha demostrado, mediante una nueva técnica que utiliza nanopartículas, que la activación de las células natural killer (NK) del sistema inmunitario ayudaría a eliminar los reservorios del virus del VIH en las células infectadas.
En el trabajo, publicado en la revista Nano Today, colaboran el Servicio de Otorrinolaringología del Hospital Universitario Valle de Hebrón, el grupo de investigación Nanopartículas Inorgánicas del Instituto Catalán de Nanociencia y Nanotecnología (ICN2), la Universidad Autónoma de Barcelona, el IrsiCaixa y el Instituto de Investigación Germans Trias i Pujol (IGTP).
En el caso de las células infectadas por VIH (virus de la inmunodeficiencia humana), «las NK juegan un papel clave en su eliminación y se encuentran especialmente activas al inicio de la infección. Sin embargo, al tratarse de una infección crónica, con el paso del tiempo, las células NK dejan de responder bien, se agotan».
“Sabemos que las natural killer son muy importantes en la lucha contra el VIH, así que nuestro objetivo es encontrar nuevas terapias que potencien su actividad para que vuelvan a actuar como en el inicio de la infección”,. En concreto, los investigadores se focalizan en la actividad citotóxica de las NK que es dependiente de anticuerpos, es decir, utilizan anticuerpos para dirigir a las NK hacia las células infectadas y que las eliminen.
Para reactivar las células natural killer, los investigadores han desarrollado nanopartículas que contienen dos tipos de anticuerpos. Uno de los tipos reconoce la proteína CD16, que se encuentra en la superficie d las células NK, y el otro tipo reconoce la proteína gp120 que expresan las células infectadas y ayudan a que las NK se activen de forma más eficaz y eliminen la infección.
“Como novedad, hemos conseguido diseñar unas nanopartículas polarizadas, es decir, los anticuerpos que son iguales se agrupan en dominios concretos encima de la superficie de la partícula (por un lado, los anti-CD16 y, por el otro, los anti-gp120). Esto favorece la unión a las proteínas que nos interesan y dirigimos mejor la respuesta inmunitaria”, destaca Víctor Puntes, jefe del grupo CIBBIM-Nanomedicina y Nanopartículas Farmacocinéticas del VHIR, jefe del grupo de Nanopartículas Inorgánicas del ICN2 e investigador ICREA.
Mediante esta tecnología, los resultados del estudio muestran que las células natural killer son capaces de poner en marcha un respuesta citotóxica hacia las células infectadas y eliminar los reservorios celulares de VIH en cultivos de células sanguíneas y de tejido linfoide humano.
“Las NK, permiten eliminar las células infectadas con VIH”.
De cara a investigar su potencial uso en la clínica, ahora el grupo de Enfermedades Infecciosas del VHIR trabaja en la búsqueda de anticuerpos biespecíficos, capaces de reconocer a la vez tanto las células infectadas como las natural killer para facilitar esta unión. En este caso no se utilizarán nanopartículas para facilitar el proceso de traslado hacia la clínica, y se probará la eficacia para eliminar las células infectadas por parte de estos anticuerpos tanto en cultivos celulares como en ratones.
Innovación en nanotecnología
Valle de Hebrón explica que «en los últimos años, el interés en la investigación sobre las aplicaciones médicas de la nanotecnología ha crecido exponencialmente. Desde los años 80, los investigadores han trabajado para conseguir nanopartículas donde unir diferentes tipos de anticuerpos que reconozcan proteínas concretas. Sin embargo, hasta ahora no se había demostrado que era posible crear nanopartículas de oro polarizadas con dominios de anticuerpos diferenciados, es decir, donde cada tipo de anticuerpo se agregue con los que son iguales a él. Es lo que se llama adsorción cooperativa. Hasta ahora, los anticuerpos se colocaban al azar sobre la partícula».
“La adsorción cooperativa, que permite crear nanopartículas polarizadas, se había visto en partículas y superficies más grandes. En el caso de partículas tan pequeñas, creíamos que era posible, pero es la primera vez que se demuestra en la práctica”,.
Para hacerlo posible, los investigadores han diseñado una metodología de formación de las nanopartículas que requiere unas condiciones muy concretas y controladas. Así, han conseguido tener nanopartículas polarizadas con dos tipos de anticuerpos separados en el espacio que permitan aumentar la eficacia de las uniones a las células de interés.
Las nanopartículas polarizadas se han utilizado, en este caso, para el estudio de la unión entre las células natural killer y las células infectadas por VIH. Sin embargo, esta tecnología podría convertirse en una nueva plataforma de investigación con un gran abanico de aplicaciones, como por ejemplo el cáncer. En este caso sería, por lo tanto, una estrategia de inmunoterapia que dirigiría las células del sistema inmunitario hacia las células tumorales.
Referencias
Orange, JS (2008). «Formation and function of the lytic NK-cell immunological synapse». Nat Rev Immunol. 8 (9): 713-725. Consultado el 5 de marzo de 2018.
Xu Y, Zhou S, Lam YW, Pang S W (2017). «Dynamics of Natural Killer Cells Cytotoxicity in Microwell Arrays with Connecting Channels». Front. Immunol. Consultado el 5 de marzo de 2018.
↑ Alice CN, Brown ACN, Oddos S, Dobbie IM, Alakoskela J-M, Parton RM, Eissmann P, et al. (2011). «Remodelling of Cortical Actin Where Lytic Granules Dock at Natural Killer Cell Immune Synapses Revealed by Super-Resolution Microscopy.». PLoS Biol 9 (9): e1001152. Consultado el 10 de marzo de 2018.
↑ Mace ME, Dongre P, Hsu H-T, SinhaP, James AM, Mann SS, Forbes LR, Watkin LB, Orange JS (2014). «Cell biological steps and checkpoints in accessing NK cell cytotoxicity». Immunology and Cell Biology (Revisión) 92: 245-255. doi:10.1038/icb.2013.96.
↑ Schleinitz N, March ME, Long EO. (2008). «Recruitment of Activation Receptors at Inhibitory NK Cell Immune Synapses». PLoS ONE 3 (9): e3278.
«