Mecanismo de control de la inflamación
El estudio se publica hoy en Science.18 octubre, 2018
La inflamación salva y mata. Un equilibrio en su acción es necesario y el deficits nos enferma y el exceso nos conduce a enfemedades crónicas degenerativas.
Este trabajo del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han descubierto un nuevo mecanismo de control de la inflamación que permite manejar el daño asociado a la respuesta inmunitaria.
Cuando se produce una infección o un daño en los tejidos el organismo reacciona activando la respuesta inmune inflamatoria que rechaza la infección y/o repara el tejido dañado. Sin embargo, en ocasiones un exceso de inflamación puede causar el efecto contrario y provocar un daño mayor o inmunopatología.
Las células inmunitarias eliminan el daño causante de la inflamación y contribuyen a la reparación del tejido dañado en situaciones diversas como al páncreas durante una pancreatitis, al riñón tras una infección en sangre con el hongo Candida albicans o al corazón en un infarto.
“Los neutrófilos son las primeras células inmunitarias que llegan al foco infeccioso o inflamatorio, con el objetivo de eliminar la agresión. Sin embargo, son muy destructores y no actúan únicamente sobre la infección, sino también sobre el tejido al que llegan; de esta forma, la eliminación de la lesión conlleva un daño a los propios tejidos. Este proceso se conoce como inmunopatología, ya que se trata de un daño en el tejido causado por nuestro propio sistema inmunitario”, explica David Sancho, que dirige el laboratorio de Inmunobiología del CNIC que ha realizado el estudio. Por ello, afirma, “resulta importante caracterizar cómo nuestro sistema inmunitario puede controlar la respuesta inflamatoria de los neutrófilos para que no resulte dañina para nuestro organismo. Este trabajo –añade- ha identificado que las células dendríticas, además de ser esenciales para dirigir la respuesta específica de los linfocitos T, también pueden controlar la infiltración de los neutrófilos en los tejidos y atenuar así la inflamación para evitar un daño excesivo en los tejidos”.
Neutrófilos
Las células dendríticas, “producen factores que atraen a los neutrófilos al foco inflamatorio, como es el caso de la quimiocina Mip-2. Y, al mismo tiempo, estas células dendríticas también expresan en su superficie un receptor llamado DNGR-1, capaz de reconocer el daño en los tejidos. Esto se debe a que identifica componentes del interior de las células, que sólo son accesibles cuando la célula está dañada o rota. Así, cuando DNGR-1 detecta dicha lesión –aclara del Fresno-, detiene la capacidad de las células dendríticas de producir Mip-2 y, por tanto, reduce la llegada de neutrófilos al órgano dañado. De esta forma se evita que se genere una lesión mayor, que puede llegar incluso a comprometer la integridad del organismo”.
Entender cómo funciona la regulación del sistema inmunitario, tanto en su lado positivo de lucha contra la infección o el cáncer o favoreciendo la reparación de tejidos, como en su lado negativo en el que puede provocar exceso de daño inflamatorio durante una infección, reacciones alérgicas o enfermedades autoinmunes es muy importante, subraya Paula Saz, co-primera autora del trabajo. “En el sistema inmunitario siempre se produce este equilibrio, y aprender a controlarlo es la clave para poder luchar contra muchas enfermedades que tienen un componente inmunitario”.
La investigación se ha realizado en modelos de ratón, único sistema que reproduce la complejidad de las infecciones y procesos inflamatorios estudiados, y permite entender mejor cómo se regulan respuestas inmunopatológicas generadas por nuestras propias defensas. Según los investigadores del CNIC, este conocimiento podría aplicarse a enfermedades en las que la llegada masiva de neutrófilos contribuye al desarrollo de la patología, tanto durante procesos infecciosos como en el daño de tejidos como consecuencia, por ejemplo, de un infarto de miocardio.
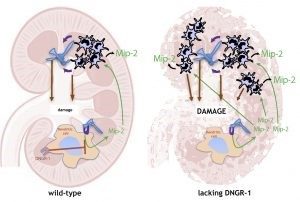
Riñón tras una infección en sangre con Candida albicans
El hongo ‘Candida albicans’ llega al riñón donde causa daño. En ratones de tipo salvaje, DNGR-1 en células dendríticas reconoce ese daño, lo que hace que produzcan niveles regulados de Mip-2, una quimiocina que produce la atracción de neutrófilos al tejido. Sin embargo, los ratones deficientes en DNGR-1 no reconocen el daño, no reducen la producción de Mip-2 y esto hace que lleguen demasiados neutrófilos al riñón, causando inmunopatología.