Las terapias con células CAR-T se están investigando y utilizando cada vez más para tratar cánceres hematológicos , incluida la leucemia linfocítica aguda (LLA), la leucemia mieloide aguda (LMA), el linfoma y el mieloma múltiple (MM). 1
Este tipo de terapia celular utiliza células T extraídas de un paciente o de un donante y modifica genéticamente las células para que expresen un receptor de antígeno quimérico (CAR).
El CAR es un receptor de células T sintético que consiste en un fragmento variable de cadena única (scFv) derivado de un anticuerpo extracelular que se une a un antígeno diana específico, unido a una o más secuencias de señalización intracelular que promueven la activación de las células T después de la unión de scFv.
Una vez que las células T modificadas con CAR se expanden, se vuelven a infundir en el paciente, donde se unen a su antígeno específico en la superficie de las células tumorales del paciente y se activan, lo que les permite atacar y destruir las células tumorales.
Evaluar la expresión de CAR después de la transducción retroviral o lentiviral de las células T del paciente es un paso importante para comprender la dosis de CAR+ Células T que se transfieren nuevamente al paciente. Las proteínas marcadas con un colorante fluorescente permiten que las células diana que expresan el CAR correspondiente se tiñen y detectan directamente mediante citometría de flujo .

La capacidad de evaluar la expresión de un receptor de antígeno quimérico (CAR) después de la transducción de células T es un paso fundamental en la producción de células CAR-T para la inmunoterapia contra el cáncer. Las fluorocinas de R&D Systems están diseñadas para simplificar la detección de un receptor de antígeno quimérico (CAR) específico en las células CAR-T u otro tipo de célula de interés. Los fluoróforos se conjugan con la proteína bioactiva a través del marcaje con amina y las fluorocinas resultantes se prueban rigurosamente para garantizar un marcaje consistente en cada lote. Todo el proceso de fabricación se controla para reducir la variabilidad de lote a lote y garantiza una relación F/P constante. Finalmente, cada proteína se somete a pruebas de control de calidad mediante citometría de flujo.
La principal ventaja de las fluorocinas es que las células diana que expresan el CAR correspondiente pueden teñirse y detectarse directamente mediante citometría de flujo. Este método de evaluación de la expresión de CAR es altamente específico, reduce el tiempo de procesamiento y elimina la tinción de fondo que puede ocurrir mediante la detección indirecta de CAR usando un antígeno diana marcado con epítopo y un anticuerpo secundario marcado con fluoróforo. Dado que la detección directa de un CAR con un antígeno diana marcado es actualmente el método de elección para evaluar la expresión de CAR, estamos trabajando diligentemente para ampliar nuestra selección de proteínas marcadas con fluorocinas fluorescentes. Como método alternativo, también ofrecemos proteínas biotiniladas Avi-tag , que se pueden detectar usando estreptavidina marcada con fluorocromo. Además, si no puede encontrar la proteína marcada con fluorescencia o biotinilada que necesita en nuestro sitio web, nuestro equipo de Servicios de proteínas personalizadas puede trabajar con usted para crear una solución de proteína personalizada que satisfaga sus necesidades de investigación específicas.
Proteínas marcadas con fluorocinas fluorescentes para detectar células CAR-T
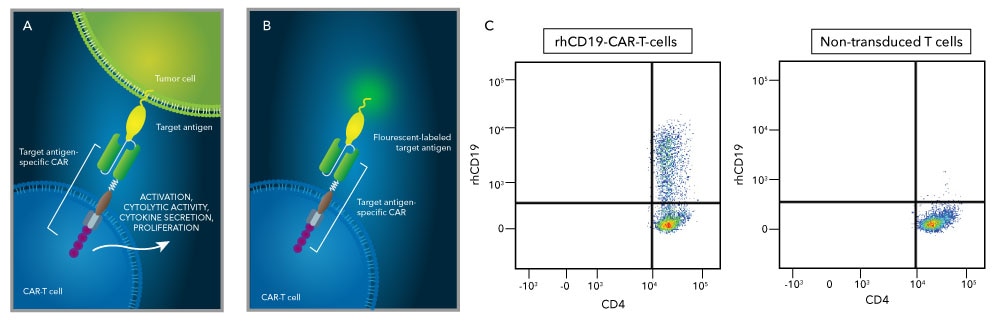
Demostración de la utilidad de una fluorocina para evaluar la expresión de CAR. (A) La terapia con células CAR-T se basa en el principio de que las células T extraídas de un paciente o donante pueden modificarse genéticamente para expresar un receptor de antígeno quimérico específico (CAR). Una vez que estas células CAR-T se vuelven a infundir en el paciente, CAR se unirá a su antígeno objetivo específico en la superficie de las células tumorales del paciente, activando las células T y permitiéndoles atacar y destruir las células tumorales. (B) La capacidad de evaluar la expresión de CAR después de la transducción de células T es un paso importante en la producción de células CAR-T. Las células T que expresan CAR se pueden teñir directamente usando una fluoroquina (antígeno diana) y el porcentaje de células que expresan CAR se puede detectar mediante citometría de flujo. (C) Las células T CD4+CD8+ se transdujeron con un hCD19-CAR (izquierda) o no se transdujeron (derecha) y luego se cultivaron durante 11 días. Las células se tiñeron con PE-Cy7-CD4 y proteína recombinante humana CD19 Fc quimera Atto 488 (n.º de catálogo ATJ9269), y se detectaron mediante citometría de flujo.
Ventajas de las proteínas marcadas con fluorocinas fluorescentes para evaluar la expresión de CAR:
Las células diana que expresan un receptor de antígeno quimérico específico (CAR) se pueden teñir directamente con la fluoroquina adecuada
La tinción directa con una fluoroquina reduce el tiempo de procesamiento y elimina la tinción de fondo que puede ocurrir mediante la detección indirecta de CAR utilizando un antígeno diana marcado con epítopo y un anticuerpo secundario marcado con fluoróforo.
Las fluorocinas están validadas para unirse a perlas conjugadas con el anticuerpo monoclonal correspondiente
Algunas fluoroquinas también se prueban para garantizar que tiñen las células CAR-T apropiadas mediante citometría de flujo.
Las fluoroquinas muestran una consistencia de lote a lote y retienen el mismo alto nivel de actividad que la proteína recombinante etiquetada con Fc sin marcar
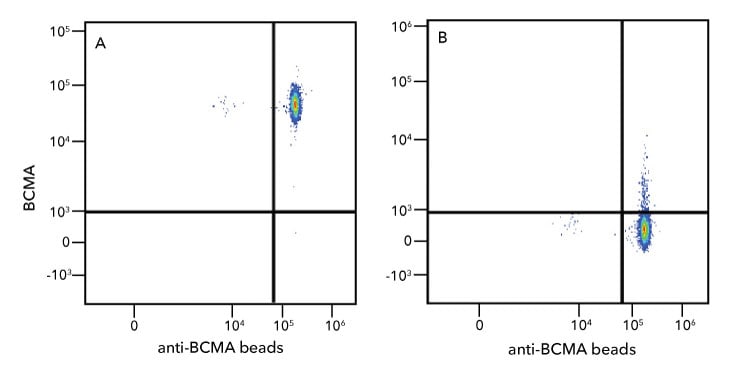
Detección de perlas fluorescentes conjugadas con BCMA antihumano con proteína recombinante humana BCMA/TNFRSF17 Fc Chimera Atto 488 . Las perlas fluorescentes conjugadas con anticuerpo monoclonal anti-BCMA humano se tiñeron con (A) proteína recombinante humana BCMA/TNFRSF17 Fc quimera Atto 488 (n.º de catálogo ATJ193) o (B) sin teñir y se detectaron mediante citometría de flujo.
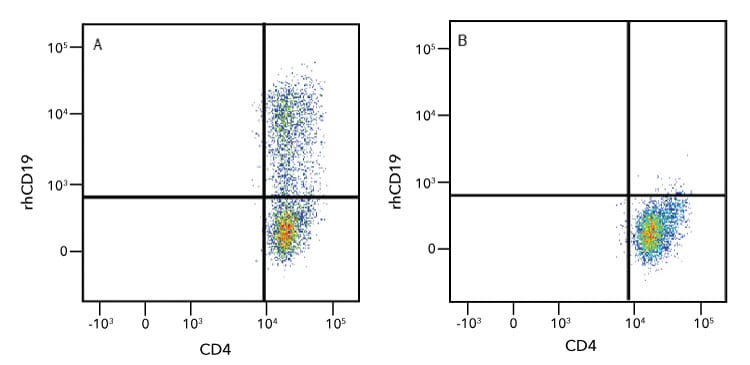
Detección de células CD19-CAR-T con proteína recombinante humana CD19 Fc Chimera Atto 647N. Las células T CD4 + CD8 + se transdujeron (A) con un hCD19-CAR o (B) no se transdujeron y luego se cultivaron durante 11 días. Las células se tiñeron con PE-Cy7-CD4 y proteína recombinante humana CD19 Fc quimera Atto 647N (n.º de catálogo ATM9269), y se detectaron mediante citometría de flujo.
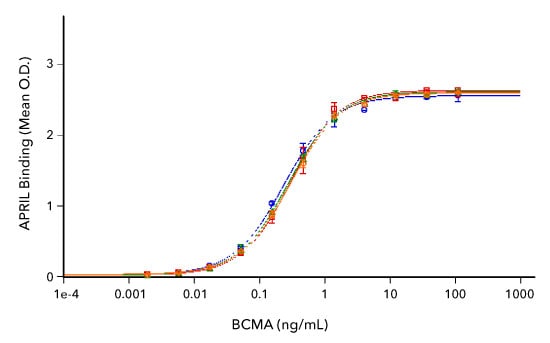
Pruebas de bioactividad y consistencia lote a lote de proteína recombinante humana BCMA Fc Chimera Atto 647N. Se inmovilizó APRIL/TNFSF13 humano recombinante (n.° de catálogo 5860-AP) a 0,1 ug/mL, 100 ul/pocillo, y se inmovilizaron las concentraciones indicadas de tres lotes independientes de BCMA Fc Chimera Atto 647N humano recombinante (n.° de catálogo ATM193; rojo, verde, líneas naranjas) o Quimera Fc BCMA Humana Recombinante sin marcar (Catálogo # 193-BC; línea azul). Los datos demuestran una bioactividad consistente entre las proteínas marcadas con fluorescencia y las no marcadas y una consistencia de lote a lote en la bioactividad de los tres lotes diferentes de la proteína marcada con fluorescencia.
Pico de SARS-CoV-2 marcado con fluorescencia y proteínas ACE-2
Con Alexa Fluor Dyes con brillo y fotoestabilidad insuperables Proteínas de pico de SARS-CoV-2 de Alexa Fluor®
Alexa Fluor es una marca registrada de Molecular Probes, Inc., Eugene, OR.
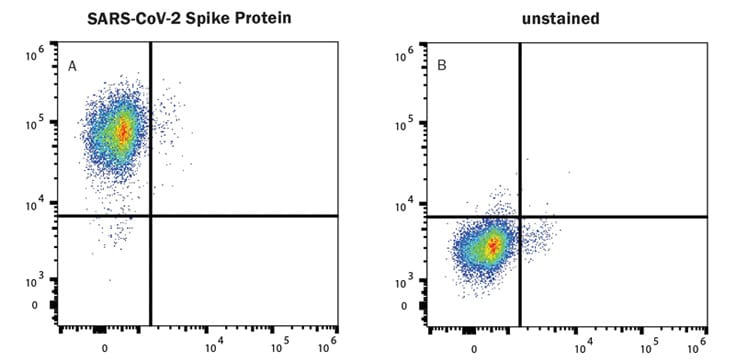
Alexa Fluor® Spike Proteins detecta la expresión de ACE-2 en células HEK293 . Las células HEK293 transfectadas con ACE-2 humano se tiñeron con (A) 1 µg/mL (100 µL/pocillo) Pico de SARS-CoV-2 recombinante (GCN4-IZ) Su-tag Proteína Alexa Fluor® 488 (n.º de catálogo AFG10561) o (B) sin teñir. Casi todas las células fueron positivas para la expresión de ACE-2 en comparación con el control no teñido.
Se han generado células CAR-T que expresan CAR específicas para diferentes moléculas de superficie, incluidas CD19 y BCMA , y se están evaluando como terapias contra el cáncer. CD19 es un antígeno que se expresa ampliamente en los cánceres derivados de células B y es uno de los objetivos más populares para las terapias con células CAR-T. 1 La Administración de Drogas y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) aprobó dos terapias de células anti-CD19-CAR-T. Tisagenlecleucel (KYMRIAH) fue aprobado en agosto de 2017 para el tratamiento de la leucemia linfoblástica aguda de precursores de células B refractaria o en recaída.(ALL), y axicabtagene ciloleucel (Yescarta) fue aprobado en octubre de 2017 para el tratamiento de pacientes adultos con linfoma difuso de células B grandes (DLBCL) en recaída o refractario. Aunque se ha observado una remisión clínica notable usando células CAR-T anti-CD19, también se han producido recaídas debido al escape y proliferación de células tumorales CD19-, o factores que pueden contribuir a la pérdida de células CAR-T o CAR-T. la función celular, incluida la pérdida de la persistencia de las células CAR-T, la muerte o senescencia celular inducida por la activación, o un microambiente tumoral inmunosupresor. 2 Se están aplicando estrategias de focalización dual para tratar de superar estos obstáculos.
El segundo antígeno tumoral más diana para la terapia con células CAR-T es el antígeno de maduración de células B (BCMA). 1 La BCMA participa en la regulación de la maduración y diferenciación de las células B en células plasmáticas y, por lo general, se expresa en niveles más altos en las células plasmáticas malignas que en las células plasmáticas normales. 3, 4 La terapia de células CAR-T anti-BCMA se está buscando actualmente para el tratamiento del mieloma múltiple y hasta ahora ha mostrado resultados prometedores. 3, 4 Otros objetivos principales que se están investigando en ensayos clínicos para terapias con células CAR-T incluyen GD2, EGF R , HER2 , mesotelina , CD20 , CD22 , CD30 , CD33, CD123 , Glipicano-3 y NKG2D . 1
Referencias
Yu, JX et al. (2019) Nacional. Rvdo. Descubrimiento de drogas 18 : 821.
Hay, KA & CJ Turtle (2017) Drogas 77 :237.
Mikkilineni, L y JN Kochenderfer (2017) Sangre 130 : 2594.
D’Agostino, M. & N. Raje (2020) Leucemia 34:21 .