 GLIOMAS TRATADOS CON INMUNIDAD
GLIOMAS TRATADOS CON INMUNIDAD
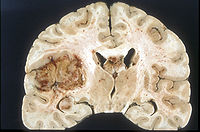
Los glioblastomas son tumores astrocíticos malignos (de grado IV según la clasificación de la Organización Mundial de la Salud (OMS)).
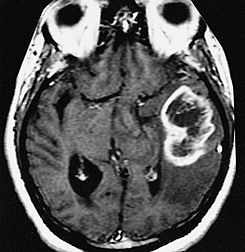
El glioblastoma es el tipo de tumor cerebral más frecuente, con una prevalencia anual de 3 de cada 100.000. Pueden presentarse a cualquier edad, pero el 70% de los casos se dan en pacientes con edades comprendidas entre los 45 y los 70 años. Estos tumores acostumbran a localizarse en los hemisferios cerebrales pero pueden encontrarse en cualquier lugar del sistema nervioso central. La enfermedad suele progresar muy rápidamente entre 2 y 3 meses,
Se desarrollan de novo o desde de un astrocitoma de bajo grado preexistente (glioblastoma secundario).
Los signos neurológicos no son específicos, como hipertensión intracraneal, se asocia frecuentemente con cambios de comportamiento o déficits neurológicos focales.
Se desconoce la causa de esta enfermedad, excepto cuando se presenta tras una irradiación terapeutica del cerebro en el tratamiento de otra enfermedad. Y alguna vez se asocia a un trauma
Las anomalías genéticas varían dependiendo de la casuística: de novo (glioblastoma primario) o en pacientes con una historia de tumor astrocítico benigno (glioblastoma secundario).
La tomografía computarizada y la resonancia magnética muestran tumor infiltrante asociado que se colorea de forma heterogénea con el contraste y con áreas de necrosis.
Las variantes histológicas incluyen gliosarcoma, glioblastoma gigantocelular, ganglioglioma maligno o tumor neuroglial. Estas variantes suelen tener mejor pronostico con el tratamiento.
.
Un factor importante que contribuye al desarrollo y la progresión del glioma es su capacidad para evadir el sistema inmunológico. los mecanismos utilizados por el glioma para mediar en la inmunosupresión y la evasión inmune. Estos incluyen mecanismos intrínsecos vinculados a su ubicación dentro del cerebro e interacciones entre las células del glioma y las células inmunes. La falta de reclutamiento de células inmunes efectoras ingenuas quizás explica la mayor parte de la supresión inmunitaria mediada por estas células tumorales. Esto se ve reforzado por un mayor reclutamiento de microglia que se asemejan a células presentadoras de antígenos inmaduros que son incapaces de soportar la inmunidad mediada por células T. Además, factores secretados como TGF-β, COX-2 e IL-10, moléculas coestimuladoras alteradas e inhibición de STAT-3 contribuyen al reclutamiento y expansión de las células T reguladoras. que modulan aún más el entorno inmunosupresor del glioma. A la luz de estos hallazgos, actualmente se están explorando múltiples modalidades de tratamiento inmunoterapéutico.
La cirugía suele ser el tratamiento de primera línea, para confirmar el diagnóstico para la mayor citorreduccion posible. La eliminación completa es imposible, ya que infiltra amplias regiones cerebrales.
El tratamiento actual tras la cirugía es; quimioterapia y radioterapia. Los fármacos más eficientes son las nitrosoureas y la temozolomida, que mejoran ligeramente la supervivencia. El pronóstico es malo, sobre todo en cirugía parcial, para los pacientes de más edad y para los que sufren déficits neurológicos avanzados. La recidiva del tumor, se combate con mucha dificultad, con quimioterapia de segunda línea o se puede volver a operar dependiendo del estado del paciente.
El receptor del factor de crecimiento epidérmico (EGFR); derivado de las plaquetas (PDGFR)) esta aumentado y es una de las dianas en investigación y se utilizan para desarrollar nuevas terapias dirigidas.
La inmunoterapia, se nos presenta como una terapia prometedora, como ocurre con otros tipos de tumores.
Francisco Martínez Ricarte, del grupo de Investigación de Neurotraumatología y Neurocirugía del Vall d’Hebron Institut de Recerca (VHIR) Hospital Vall d’Hebron en un estudio clínico internacional, intenta un tratamiento nuevo en humanos, que consiste en usar la inmunoterapia personalizada y adaptada a las peculiaridades de cada tumores hace que el que el sistema inmunitario sólo ataca a pocos neoantígenos. Eso ha hecho que los pacientes no hayan podido beneficiarse bastante de los últimos avances en inhibidores tumorales específicos.
El tratamiento, consiste en inyectar a los pacientes dos vacunas de inmunoterapia -vía subcutánea- adaptadas a las características específicas de los tumores ayuda ha mejorar las expectativas terapéuticas.
Los pacientes con glioblastoma actualmente no se benefician lo suficiente de los avances recientes en el tratamiento del cáncer que utilizan inhibidores de punto de control 1 , 2 . Para que los tratamientos que usan inhibidores de punto de control tengan éxito, se considera que una alta carga mutacional y las respuestas a los neoepítopos son esenciales 3 . Hay una infiltración intratumoral limitada de células inmunes 4 en el glioblastoma y estos tumores contienen solo 30–50 mutaciones no sinónimos 5. La explotación del repertorio completo de antígenos tumorales, es decir, tanto los antígenos no mutados como los neoepítopos, puede ofrecer inmunoterapias más eficaces, especialmente para los tumores con una carga mutacional baja. En el ensayo de fase I GAPVAC-101 del Consorcio de Vacunas Personalizadas Glioma (GAPVAC), integramos vacunas altamente individualizadas con ambos tipos de antígenos tumorales en la atención estándar para explotar de manera óptima el espacio objetivo limitado para pacientes con glioblastoma recién diagnosticado. Quince pacientes con glioblastomas positivos para el antígeno leucocitario humano (HLA) -A * 02: 01 o HLA-A * 24: 02 fueron tratados con una vacuna (APVAC1) derivada de una biblioteca prefabricada de antígenos no mutados, seguida de un tratamiento con APVAC2, que es preferencial en neoepitopes dirigidos. La personalización se basó en mutaciones y análisis de los transcriptomas e inmunopeptidomas de los tumores individuales. El enfoque GAPVAC fue factible y las vacunas que tenían poli-ICLC (poli (ácido polibobibinosínico-poliribocitidílico) el factor estimulante de colonias de granulocitos-macrófagos y la lisina-carboximetilcelulosa) como adyuvantes mostraron una seguridad favorable y una fuerte inmunogenicidad. Los antígenos APVAC1 no mutados provocaron respuestas sostenidas de células T CD8 +, de la memoria central . APVAC2 indujo predominantemente respuestas de células T CD4 + de tipo T helper 1 frente a neoepítopos predichos.
En el estudio, dirigido por el doctor Wolfgang Wick, de la Universidad de Heidelberg (Alemania) y el doctor Pierre-Yves Dietrich, de la Universidad de Ginebra (Suiza) desde 2014, y han participado 15 pacientes de seis hospitales europeos, uno de ellos aportado por el hospital barcelonés.
Los pacientes seleccionados habían sido recientemente diagnosticados de glioblastoma y no presentaban ninguna otra enfermedad asociada.
En la actualidad para tratar este tipo de tumores, se indica, cirugía; transcurridos 40 días varias sesiones de radioterapia (durante un mes y medio aproximadamente) y, finalmente, cerrar el procedimiento con la administración de quimioterápicos (cinco pastillas al mes durante seis meses.
La nueva terapia se aplica en dos fases. Tras extraer el tumor dar al paciente radioterapia, aunque en la fase de la quimioterapia se inyecta vía subcutánea en diferentes fases del proceso se trata a los enfermosa con dos vacunas terapéuticas; una más genérica, basada en los antígenos más frecuentes presentes en este cáncer, y otra más específica diseñada en base a las peculiaridades del tumor.
La primera vacuna, que contiene antígenos de los glioblastomas obtenidos, se administra en unas diez dosis y a partir de la segunda semana de tratamiento con quimioterapia, se suministra la vacuna específica, la personalizada, que contiene antígenos propios del tumor del paciente, y se inyecta, también en varias dosis, a partir de los tres meses. La vida media de los pacientes con glioblastoma es de unos 14,6 meses, mientras que la de los participantes en este estudio, alcanza los 29 meses.
Fran Martínez Ricarte es prudente, y precisa que «no hay grupo de control que nos permita concluir que con este tratamiento se alarga la vida media de estos pacientes, lo que sí podemos afirmar en base a los resultados es que este tratamiento.
El tratamiento es bien tolerado
El nuevo tratamiento aprovecha los de antígenos tumorales, incluidos los antígenos no mutados y junto con antioxidantes, puede ofrecer inmunoterapias más efectivas, sobre todo para tumores con baja carga mutacional».
Los autores consiguen un grado tan alto de personalización del tratamiento gracias a la capacidad de realizar, técnicas sofisticadas, tales como espectrometría de masas, secuenciación de última generación, microarrays de ARN, análisis del repertorio inmunológico y fabricación de medicamentos individualizados para cada paciente».
Además del Hospital Universitario Vall d’Hebron, en el estudio participaron del Hospital Universitario de Heidelberg (Alemania), el Hospital Universitario de Tuebingen (Alemania), el Hospital Universitario de Ginebra (Suiza), el Centro médico de la Universidad de Leiden (Países Bajos)), el Ringhospitalet (Copenhague, Dinamarca), así como los BCN Peptides (Barcelona, España), la Asociación de Inmunoterapia del Cáncer (CIMT), la Universidad de California San Francisco (EE. UU.), la Universidad de Southampton (Reino Unido) y el Instituto Technion (Haifa, Israel).
Mi amigo Fran Martinez, es un joven encantador con una cabeza diferente que se aparta del paradigma de que el neurocirujano solo tiene que operar, el investiga, llega al concepto de humanismo deseado por lo médicos.
Tengo que curar pacientes, pero saber que estoy haciendo y que puedo hacer con el menor daño posible y los mejores resultados
Bibliogrfia
Mecanismos de evasión inmune por gliomas. Rolle CE , Sengupta S , Lesniak MS
Francisco Martínez Ricarte, inmunidad en glioma fran martinez nature