 FRENAR LA PÉRDIDA DE SINAPSIS EN EL ALZHEIMER
FRENAR LA PÉRDIDA DE SINAPSIS EN EL ALZHEIMER
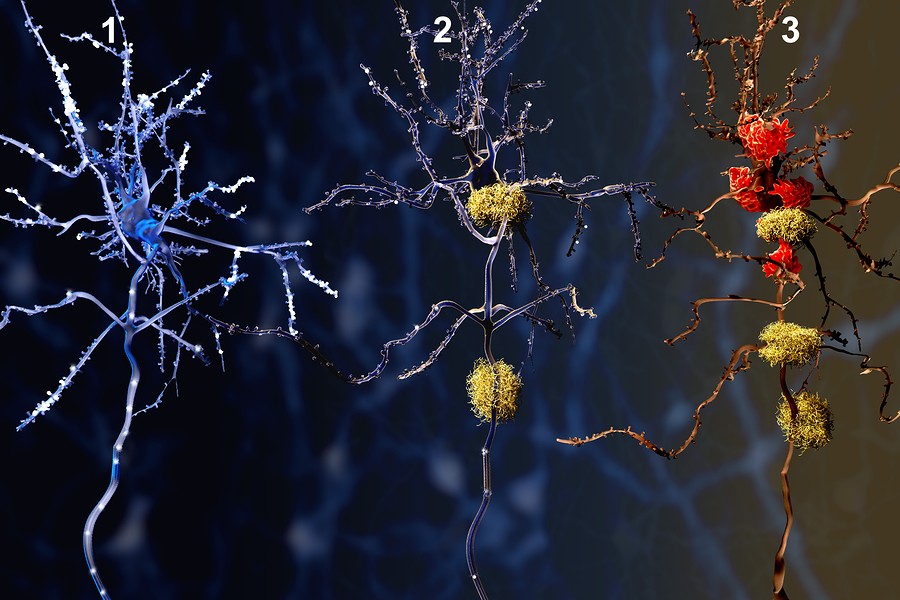
En los cerebros de personas afectas de demencia por enfermedad de Alzheimer se han identificado depósitos anormales de dos proteínas que forman agregados e inclusiones, desestructurando la arquitectura cerebral. Estas proteínas se denominan beta-amiloide y proteína tau.
Un equipo del CSIC encuentra un procedimiento para alterar la molécula Abeta42, causante del Alzheimer, y permitir que se exprese una enzima que ‘rescata’ las sinapsis deterioradas.
Este intento aunque simple, teóricamente ayudaría a desbloquear las sinapsis afectadas
A la izquierda, imagen del cerebro de una mosca (Drosophila) en el que la molécula identificada provoca la pérdida de sinapsis. A la derecha, cuando se altera la molécula para que el gen pueda expresarse, el número de sinapsis se mantiene.
Un equipo liderado por científicos del Instituto Cajal, del Consejo Superior de Investigaciones Científicas (CSIC), ha revelado un mecanismo que causa pérdida de sinapsis en las neuronas en el Alzheimer:
Una molécula bloquea un gen y ocasiona la pérdida de conexiones entre neuronas.
En un estudio con moscas (Drosophila melanogaster), han observado que alterando la composición química de la molécula patológica, el péptido Aß42, se logra que esta permita al gen PI3K expresarse y “rescatar” las sinapsis deterioradas.
El estudio, publicado en la revista Molecular Biology of the Cell, ha reproducido los resultados en una línea celular humana (células de neuroblastoma humano SH-SY5Y). Esto permitiría diseñar una nueva estrategia para combatir el Alzheimer.
“La transmisión de información entre neuronas ocurre en la sinapsis. En el caso de pacientes afectados por enfermedades neurodegenerativas –como el Alzheimer–, estas conexiones funcionan de manera incorrecta y disminuyen en número. Los cerebros dañados tienen como característica la acumulación de niveles tóxicos de dicha molécula.
Los científicos han expresado la molécula patológica humana en moscas para estudiar los mecanismos que causan esa pérdida de conexiones sinápticas. “El estudio ha demostrado que la molécula patológica silencia la expresión de un gen que codifica una enzima clave. Esta enzima es una especie de factor de supervivencia para todas las células del cuerpo y su reducción en las neuronas conlleva la pérdida de sinapsis, la cual se acelera con la edad
Cuando se alteraron la composición química de la molécula, lograron que el gen se expresase, y observaron que las sinapsis se mantenían en cantidades normales, así como el tráfico interno en las neuronas, la capacidad de movimiento, la olfacción y longevidad de los cerebros.
En concreto, han mostrado que el síndrome de toxicidad Aβ42 incluye el cierre transcripcional de la expresión de PI3K. Los resultados descubren una nueva estrategia farmacológica potencial contra esta enfermedad a través de la restauración de la actividad PI3K.
“El mecanismo de esta alteración está basado en la introducción de un grupo fosfato en la molécula patológica, lo que en química se denomina fosforilación, un procedimiento que reduce la cantidad relativa de monómeros y oligómeros de dicha molécula, que son tóxicos para la célula.
De esa manera las neuronas no pierden sinapsis. Es decir, el gen identificado rescata las neuronas que expresan la molécula humana, alterada químicamente para no ser patológica”.
Tratamiento de alzhéimer reduce depósitos de proteínas en el cerebro se había intentado desde en otras ocasiones
Intentando con anticuerpos reducir los depósitos de proteínas que se producen en el cerebro de los pacientes de alzhéimer y parece ralentizar el deterioro de las capacidades mentales, informaron científicos estadounidenses y suizos en un artículo publicado este miércoles 31 de agosto de 2016 por la revista Nature.
Muchos autores creen. que los sedimentos son la causa principal de la enfermedad y que destruyen las neuronas, provocan reacciones inflamatorias e impiden la transmisión de señales en el cerebro.
El hecho de que haya personas que tienen ese tipo de depósitos pero que no muestren síntomas de la enfermedad contradice esta teoría. Además, la disolución de las placas no conlleva necesariamente la mejora del estado mental.
Por otra parte existen pacientes que sin tener depósitos proteicos, tienen la clínica de la enfermedad . Es decir el precipitado de la proteína necesita un acontecimiento previo, como puede ser una llegada previa de gérmenes
El equipo dirigido por Alfred Sandrock en la empresa estadounidense de biotecnología Biogen trataron una vez al mes a 165 pacientes con síntomas leves de alzhéimer con el anticuerpo Aducanumab o con un placebo.
El anticuerpo ataca las proteínas típicas del alzhéimer y reduce su cantidad. «Este es un estudio es muy valioso por muchas razones, por ejemplo porque consigue por primera vez reducir con un anticuerpo los agregados de proteínas, tanto en animales como en humanos»,.
Este algoritmo de precipitado de proteína tales como la alfa sinucleína o la proteína tau. Y la lesión determinante de la enfermedad, es insuficiente, si no se agrega a un precipitante de los macrófagos
En la práctica el alzhéimer se diagnostica mucho más tarde, en un punto en el que ya hay grandes partes del cerebro afectadas. Al parecer, los medicamentos que hasta ahora están disponibles no actúan especialmente bien por esta razón, porque llegan demasiado tarde.
«Lo que realmente necesitamos es un diagnóstico precoz. Y entonces unos anticuerpos destruiría las placas. Esto lo habían demostrado investigadores, procedentes de Suiza y Estados Unidos, mostraron primero con ensayos con ratones que el anticuerpo penetra en el cerebro y ataca los depósitos de proteínas.
Después realizaron el estudio con 165 pacientes y vieron que el anticuerpo actúa contra la proteína beta-amiloide ya sea en su estado soluble o insoluble. Los pacientes del estudio presentaban al principio del ensayo solo leves síntomas del alzhéimer, es decir, desde los primeros trastornos cognitivos hasta leve demencia y los típicos sedimentos en el cerebro.
Un año después estos depósitos se habían reducido considerablemente. Esta reducción fue mayor cuanto más tiempo fueron tratados los pacientes y cuanto mayor era la dosis de anticuerpos que recibieron.
Además, la capacidad cognitiva de los pacientes que recibieron el tratamiento se redujo menos que la de los que recibieron el placebo. Los investigadores encontraron una relación entre el retroceso de las placas y el estado mental del paciente.
La proteína amiloide y el desarrollo del anticuerpo para el tratamiento de alzhéimer, no ha demostrado efectividad hace falta modificar el algoritmo introduciendo un elementos previo. Con un germen y siempre los gérmenes.
Redacción
27 febrero, 2020
Estudio del Instituto Cajal en línea celular humana
Científicos estadounidenses y suizos en un artículo publicado este miércoles 31 de agosto de 2016 por la revista Nature.