CITOQUINAS, QUIMIOQUINAS Y FACTORES DE CRECIMIENTO
Para un neurocirujano entrar en este campo de la biología es una heroicidad. Es tan compleja que ya el retener su nombre cuesta un gran esfuerzo.
Pero es imprescindible saber con qué estamos tratando. Sin embargo, creo que en el futuro muy próximo se abreviará esta multiplicidad de moléculas imprescindible para la vida y qué no siempre hacen lo mismo pero siempre son vitales.
Y además su comportamiento puede ser contrapuesto dependiendo de la situación.
Estas moléculas desempeñan funciones tanto beneficiosas como perjudiciales según su contexto.
Las citocinas y los factores de crecimiento son moléculas de señalización que participan en la mayoría de los procesos biológicos, incluido el desarrollo embrionario, la proliferación y supervivencia celular, la diferenciación y la patogénesis de enfermedades. (1). La capacidad de estas moléculas para desempeñar funciones tanto beneficiosas como perjudiciales según su contexto es una característica importante de las citocinas y los factores de crecimiento.
La IFN-gamma ayuda a proteger el cuerpo contra los microorganismos intracelulares, pero también juega un papel en las enfermedades autoinmunes.
Las primeras investigaciones sobre citoquinas comenzaron en la década de 1940 con estudios de «factores solubles» que eran producidos por una célula y actuaban sobre ellos (1). A Stanley Cohen y Rita Levi-Montalcini se les atribuye el descubrimiento del primer factor de crecimiento, el factor de crecimiento nervioso (NGF), en 1952. Avance rápido hasta 1986, cuando R&D Systems purificó y vendió por primera vez el TGF-beta natural, seguido del lanzamiento de nuestras primeras citoquinas recombinantes y factores de crecimiento en 1988.
Rita Levi-Montalcini
Hace ya algún tiempo que lei su libro y me entusiasmo su tesón y amor a lo nuevo.
NI Musolini ni su grupo la detuvo, pero tuvo que marcharse a los Estados Unidos , para realizarse
Descripción
Rita Levi-Montalcini fue una neuróloga italiana. Descubrió el primer factor de crecimiento conocido en el sistema nervioso, investigación por la que obtuvo el Premio Nobel de Fisiología o Medicina en 1986, compartido con Stanley Cohen.
Citocinas GMP y factores de crecimiento 
Las interleucinas son citoquinas secretadas que tienen funciones inmunomoduladoras complejas que incluyen la proliferación celular, maduración, migración, adhesión, diferenciación y activación (2).
Se subdividen en varias familias según la homología de secuencia, la relación evolutiva, la cadena receptora común o la función principal.
Las familias conocidas incluyen la familia
IL-1, las familias de cadenas beta y gamma comunes, IL-6, la familia IL-10, la familia IL-12, la familia IL-17, las interleucinas con actividad de quimiocinas y otras interleucinas. 3).
Vías de señalización de interleucina
Superfamilia TGF-beta: activina , BMP , GDF , GDNF , TGF-beta
Los miembros de la superfamilia del factor de crecimiento transformante beta (TGF-beta) son importantes para el desarrollo de organismos multicelulares. La superfamilia TGF-beta emite señales a través de complejos heteroméricos de receptores de serina/treonina quinasa tipo 1 y tipo 2. Las proteínas de esta familia están implicadas en procesos celulares como la autorrenovación de células madre embrionarias, la gastrulación, la diferenciación, la morfogénesis de órganos y la homeostasis de tejidos adultos (4). Además, TGF-beta tiene funciones tanto protumorales como antitumorales.
Vías de señalización de TGF-Beta
Las citocinas quimiotácticas (quimiocinas) desempeñan funciones importantes en la migración celular, el desarrollo del sistema inmunitario y la homeostasis. También participan en las respuestas inmunitarias e inflamatorias protectoras y destructivas (5). Las quimiocinas se organizan en cuatro subfamilias: CC, CXC, CX3C y XC, que indican la variación en la configuración de las cisteínas más cercanas al extremo N terminal. Las quimioquinas interactúan con los glicosaminoglicanos (GAGS), lo cual es importante para la inmovilización en las superficies celulares y la matriz extracelular. Las quimioquinas son activas como monómeros, homodímeros y heterodímeros. Otras modificaciones postraduccionales que afectan a las quimiocinas incluyen la citrulinación, la nitración/nitrosilación y la escisión por una amplia variedad de enzimas.
Vías de señalización de quimioquinas 
Sistema inmunitario reaccionando ante la infección por el coronavirus / Pixabay.co
Los factores de crecimiento de fibroblastos (FGF) se identificaron originalmente en el contexto de la promoción de la proliferación de fibroblastos. Hay 22 miembros de la familia FGF en humanos, de los cuales solo 18 son ligandos para receptores de FGF (FGFR) (6). Al igual que otros factores de crecimiento, los FGF inician numerosas vías de señalización, incluida la señalización RAS/MAPK, PI3-Kinase/AKT y PLCγ. Muchos miembros de la familia FGF se han relacionado con varias aplicaciones terapéuticas, incluidas las de enfermedades cardiovasculares, cáncer, crecimiento del cabello, osteoartritis, diabetes y enfermedad de Parkinson, entre otras. La función de varios otros FGF permanece sin identificar.
Los investigadores se dieron cuenta por primera vez del factor de crecimiento epidérmico (EGF) durante la investigación fundamental del factor de crecimiento nervioso (NGF) recientemente descubierto. Pronto se demostró que EGF era un ligando para el receptor de EGF unido a la membrana (EGFR), el receptor de tirosina quinasa descrito por primera vez (7). EGF y otros ligandos de EGFR (factor de crecimiento transformante alfa, anfirregulina, epirregulina, betacelulina, factor de crecimiento similar a EGF que se une a heparaína y epígeno) inducen la internalización y el tráfico de EGFR a los endosomas tempranos. EGFR está regulado al alza en una variedad de cánceres, incluidos el cáncer de células no pequeñas, el cáncer colorrectal metastásico, el glioblastoma, el cáncer de páncreas y el cáncer de mama, entre otros.
La familia Wnt de factores de crecimiento secretados son proteínas hidrófobas que median en la comunicación célula-célula dependiente del contacto o de corta distancia (8). Las vías de señalización de Wnt se dividen en vías canónicas, no canónicas y de polaridad celular. Usando una amplia variedad de sistemas modelo, los investigadores han demostrado que la señalización de Wnt es importante para muchos procesos celulares, incluida la proliferación, la especificación del destino celular, la diferenciación y la migración. Aunque los Wnt se asocian comúnmente con procesos de desarrollo, el primer gen Wnt de mamíferos (wnt) se identificó como un oncogén. El papel de la señalización de Wnt en el cáncer se ve reforzado por los datos in silico que demuestran alteraciones frecuentes (mutaciones, amplificaciones, deleciones) de los ligandos de Wnt y los componentes intracelulares en una variedad de cánceres (8).
Señalización de Wnt dependiente de beta-catenina
Aunque los factores de crecimiento similares a la insulina (IGF) son estructuralmente similares a la insulina, tienden a ser más importantes para mediar actividades a largo plazo como el destino celular, mientras que la insulina es más importante para la actividad metabólica (9). A diferencia de la insulina, que solo es secretada por las células β pancreáticas, el IGF se produce en una variedad de tejidos y no se ha identificado el tipo de célula específico que lo secreta. La producción de IGF aumenta con la edad hasta la edad adulta y disminuye después de los 30 años.
Los factores de crecimiento del endotelio vascular (VEGF) juegan un papel importante en la formación, el mantenimiento y la remodelación de los vasos sanguíneos. Los subtipos AF de VEGF son ligandos de alta afinidad por los receptores de tirosina quinasas, receptores de VEGF (VEGFR) 1, 2 y 3. Los VEGF también se unen a los co-receptores, neuropilina-1 y neuropilina-2 (NRP1, NRP2) y heparán. proteoglicanos de sulfato (HSPG) (10). La señalización de VEGF está regulada por múltiples variables que incluyen la expresión del receptor, la afinidad del ligando, la expresión del correceptor, las proteínas auxiliares de unión que no son del VEGF y las tirosina fosfatasas (10).
Vías de señalización VEGF-VEGFR2
CSF ( GM-CSF , M-CSF , G-CSF )
Hay cuatro factores estimulantes de colonias (CSF) conocidos que también se conocen como factores de crecimiento hematopoyético. Estos incluyen LCR de granulocitos y macrófagos (GM-CSF), LCR de formación de colonias de macrófagos (M-CSF), LCR de granulocitos (G-CSF) y LCR múltiple, también conocido como interleucina-3 (IL-3). Los LCR son glicoproteínas que tienen varias funciones, entre ellas estimular la proliferación, suprimir la apoptosis, inducir la maduración y promover la diferenciación (11).
Las angiopoyetinas (Ang-1, Ang-2, Ang-3 y Ang-4) son una familia de factores de crecimiento específicos de células endoteliales que se unen al receptor de tirosina cinasa, Tie-2, y participan en la regulación de la angiogénesis. La vía del receptor del factor de crecimiento Tie-2 se ha convertido en un objetivo complementario para las terapias contra el cáncer antiangiogénico basadas en el factor de crecimiento endotelial vascular (VEGF) (12). Aunque Tie-1 se considera actualmente un receptor huérfano, se activa a través de la interacción con Tie-2. El aumento de la expresión de Ang-2 se ha correlacionado con una variedad de cánceres humanos, incluidos el melanoma, el carcinoma de células renales, el glioblastoma, el cáncer de mama y el cáncer colorrectal (12). Ang-2 también se ha implicado en otras dolencias como enfermedad renal, diabetes, cirrosis hepática, asma y enfermedades del corazón. La expresión Ang-1 también se ha invocado en algunas de estas dolencias, 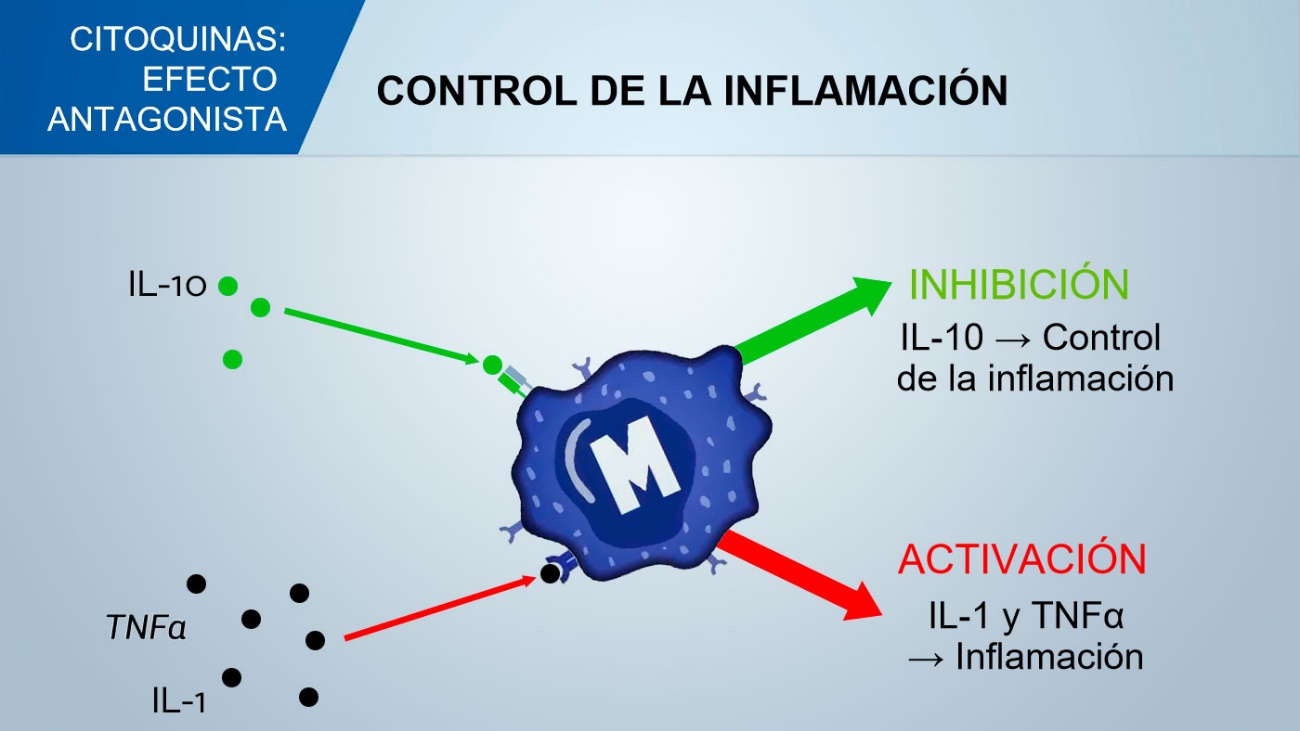
Se ha demostrado que el factor de crecimiento derivado de plaquetas (PDGF) promueve la proliferación, supervivencia y migración de células de origen mesenquimatoso (13). Varias isoformas de PDGF juegan un papel en la tumorigénesis y enfermedades neurológicas. Como diana terapéutica, se han utilizado varios enfoques para inhibir la señalización de PDGF. Estos incluyen el uso de anticuerpos o aptámeros para bloquear la unión del ligando/receptor y la activación del receptor de PDGF, así como el uso de moléculas pequeñas para bloquear la señalización de la quinasa.
Aunque el factor de necrosis tumoral (TNF) se describió inicialmente como un factor sérico para inducir la necrosis tumoral, actualmente es un objetivo terapéutico en una variedad de condiciones inmunitarias e inflamatorias (14). Además de tener funciones patogénicas en la inflamación, la autoinmunidad, la degeneración tisular y la tumorigénesis, el TNF también tiene funciones homeostáticas como la regeneración, la remielinización y la remodelación.
Interacciones del receptor del ligando de la superfamilia de TNF
Los miembros de la familia del factor de crecimiento de la espondina específica de la placa del techo (R-Spondin) se identificaron inicialmente en el cerebro humano fetal y en la placa del techo del tubo neural del ratón (15). Se sabe que las proteínas R-Spondin regulan positivamente la señalización canónica y no canónica del sitio de integración relacionado con Wingless (Wnt), que es importante para el desarrollo del organismo, el comportamiento celular y el cáncer (16). Las proteínas R-Spondin secretadas (RSPO1-4) también funcionan como factores de crecimiento de células madre adultas y R-Spondin 1 y R-Spondin 3 ahora se usan ampliamente como factores de crecimiento para el cultivo de organoides.
El término interferón (IFN) se acuñó en 1957 para describir una “partícula macromolecular no hemaglutinante” que se demostró que era responsable de la interferencia viral (17). Actualmente, los 22 IFN conocidos se dividen en 3 clases, IFN tipo I, II y III. Además de los efectos antivirales compartidos por todas las clases de IFN, la clase II, que consta únicamente de IFN-gamma, también es un objetivo terapéutico contra el cáncer (18).
Vías de señalización de IFN tipo I
Vías de señalización de IFN tipo II
Vías de señalización de IFN tipo III
El factor neurotrófico derivado del cerebro (BDNF) es un miembro de la familia de factores de crecimiento de las neurotrofinas que también incluye el factor de crecimiento nervioso, la neurotrofina-3 y la neurotrofina-4/5. Existen varias isoformas de BDNF, que incluyen pre-pro-BDNF, pro-BDNF y BDNF maduro (19). La secuencia señal de pre-pro-BDNF se escinde en el aparato de Golgi, produciendo pro-BDNF. Las respuestas de señalización a pro-BDNF se han correlacionado con el destino, el desarrollo y la diferenciación neuronal. Las respuestas de señalización aguas abajo del BDNF maduro se han asociado con la plasticidad, el crecimiento neuronal y la ramificación dendrítica.
El factor de células madre (SCF) o ligando c-kit (KL) es un factor de crecimiento ampliamente expresado que se une al receptor de tirosina quinasa tipo III, c-kit o Kit para estimular varias vías de señalización, incluidas MAPK y PI3K/AKT (20 ). El SCF existe tanto en forma soluble como transmembrana, cuya regulación se determina a nivel de mRNA y proteína. Similar al ligando Flt-3, SCF estimula la proliferación de células madre o progenitoras. La sobreactivación de c-Kit se ha asociado con la leucemia y el desarrollo de tumores del estroma gastrointestinal (GIST) que producen SCF soluble (21)
El ligando de tirosina quinasa 3 diana similar a Fms (o FLT3L) es una citoquina hematopoyética que funciona como un factor de crecimiento de células dendríticas y, a menudo, está mutado o sobreexpresado en la leucemia (22). Es estructuralmente similar a SCF y CSF-1 y emite señales a través de la tirosina quinasa 3 diana similar a Fms (Flt3), que es un receptor de tirosina quinasa de clase 3. Los factores de señalización aguas abajo incluyen SHC, Grb2, Gab2, SHIP y las vías Ras/MAPK, PI3K y STAT.
El factor inducible de leucemia (LIF) es una citocina de la familia IL-6 que se clonó a fines de la década de 1980 (23). La proteína LIF recombinante se utiliza con frecuencia como factor de crecimiento en medios de cultivo de células madre para mantener la pluripotencialidad de las células madre embrionarias. También se ha demostrado que LIF induce la diferenciación de macrófagos en células de leucemia mieloide M1 de ratón sin estimular la proliferación de células progenitoras. Como tal, hubo un gran interés en LIF como un objetivo terapéutico potencial para la leucemia. Desafortunadamente, estudios posteriores demostraron que LIF es en realidad bastante pleiotrópico (24).
Aunque el relato es tediosos, es real . No obstante creo que necesitamos una escala , mas fácil de entender y retener.
Los ciertos que estas moléculas son vitales, para la salud y la enfermedad y lo malo que pueden estar en ambos lugares o en cada uno de ellos.
Referencias
Dinarello, CA (2007) Eur. J. Immunol. 37: S34
Brocker, C. et al . (2010) Genómica Humana. 5: 30
Akdis, M. et al . (2016) J Allergy Clin Immunol. 138: 984
Weiss, A. y L. Attisano (2013) WIREs Dev Biol. 2: 47
Hughes, CE y RJBNibs (2018) The FEBS Journal. 285: 2944
Yun, Y.-R. et al . (2010) Revista de Ingeniería de Tejidos. 1:
Wee, P. y Z. Wang. (2017) Cánceres. 9: 52
Wiese, KE et al . (2018) Desarrollo. 145
Hakuno, F. y S. Takahashi (2018) Revista de Endocrinología Molecular. 61: T69
Simons, M. et al. (2016) Biología Celular Molecular 17: 611
Metcalf, D. (2010) Nature Reviews Cancer. 10: 425
Saharinen, P. et al . (2017) Nature Reviews Drug Discovery 16: 635
Papadopoulos, N. y J Lennartsson. (2018) Aspectos moleculares de la medicina 62: 75
Kalliolias, GD y LB Ivashkiv (2016) Nat. Rev. Reumatol. 12:49 _
Jin, YR y JKYoon. (2012) Int. J. Bioquímica. Célula. 44: 2278
Nusse, R. y H. Varmus. (2012) La revista EMBO 31: 1
Isaacs, A. y J Lindenmann (1957) Actas de la Royal Society B 147: 258
Castro, F. et al. (2018) Fronteras en Inmunología 9: 1
Kowianski, P. et al. (2018) Célula. mol. Neurobiol. 38: 579
Ho, CC et al. (2017) Célula. 168: 1041
Lennartsson, J y L. Ronnstrand (2011) Physiol. Ap. 92: 1619
Tsapogas, P. et al . (2017) Revista Internacional de Ciencias Moleculares. 18: 1115
Engranaje, DP et al. (1987) La revista EMBO. 6: 3995
Mathieu, M-.E. et al . (2012) Revisiones de células madre. 8: 1
