EPIGENÉTICA
Cancer y gen metilado
La epigenética es un campo de la ciencia, todavía incipiente, que tendrá implicaciones muy importantes sobre cómo abordamos nuestra salud y la de las generaciones futuras.
La palabra epigenética significa literalmente «por encima de los genes», y eso resume perfectamente el epigenoma.
Todos tenemos nuestro ADN único, siempre y cuando no se tenga un gemelo idéntico. Y casi todas las células de nuestro cuerpo contienen todo nuestro ADN y todos los genes que nos hacen ser quienes somos. Esto se conoce como el genoma. Pero, no todas las células son iguales, por ejemplo, nuestras células cerebrales hacen cosas diferentes a las del corazón, que a su vez se comportan de manera diferente a las células de la piel.
Nuestras células tienen todas la misma información, en forma de ADN, ¿pero hacen cosas diferentes?
Aquí es donde entra en juego la epigenética. Básicamente es una capa de instrucción por encima del ADN al que le dice qué activar, cómo actuar, etc.
Esto es similar a una orquesta en la que nuestro ADN serían los músicos y el epigenoma sería el director, que les dice a las células qué deben hacer y cuándo hacerlo. La orquesta de cada persona es diferente. Por eso, aunque el epigenoma no cambia nuestro ADN, si que es el responsable de decidir qué genes se expresarán y cuales no. 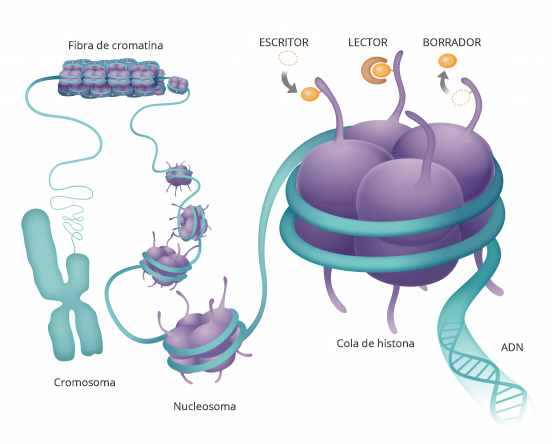
Resumiendo, cada célula con todo su ADN espera instrucciones externas, las cuales vienen en forma de un grupo METILO, un compuesto hecho de carbono e hidrógeno. Estos grupos metilo se unen a los genes, haciéndoles saber cuándo expresarse y cuándo permanecer inactivos, y se unen de manera diferente dependiendo de en qué parte del cuerpo se encuentra el ADN. Además hay otras moléculas que son las HISTONAS que también juegan un papel muy importante en cómo se expresan los genes, pues las histonas son las proteínas alrededor de las cuales se enrolla el ADN. La forma en que este el ADN empaquetado alrededor de la histona juega un papel importante en la fuerza con que se expresa un gen. 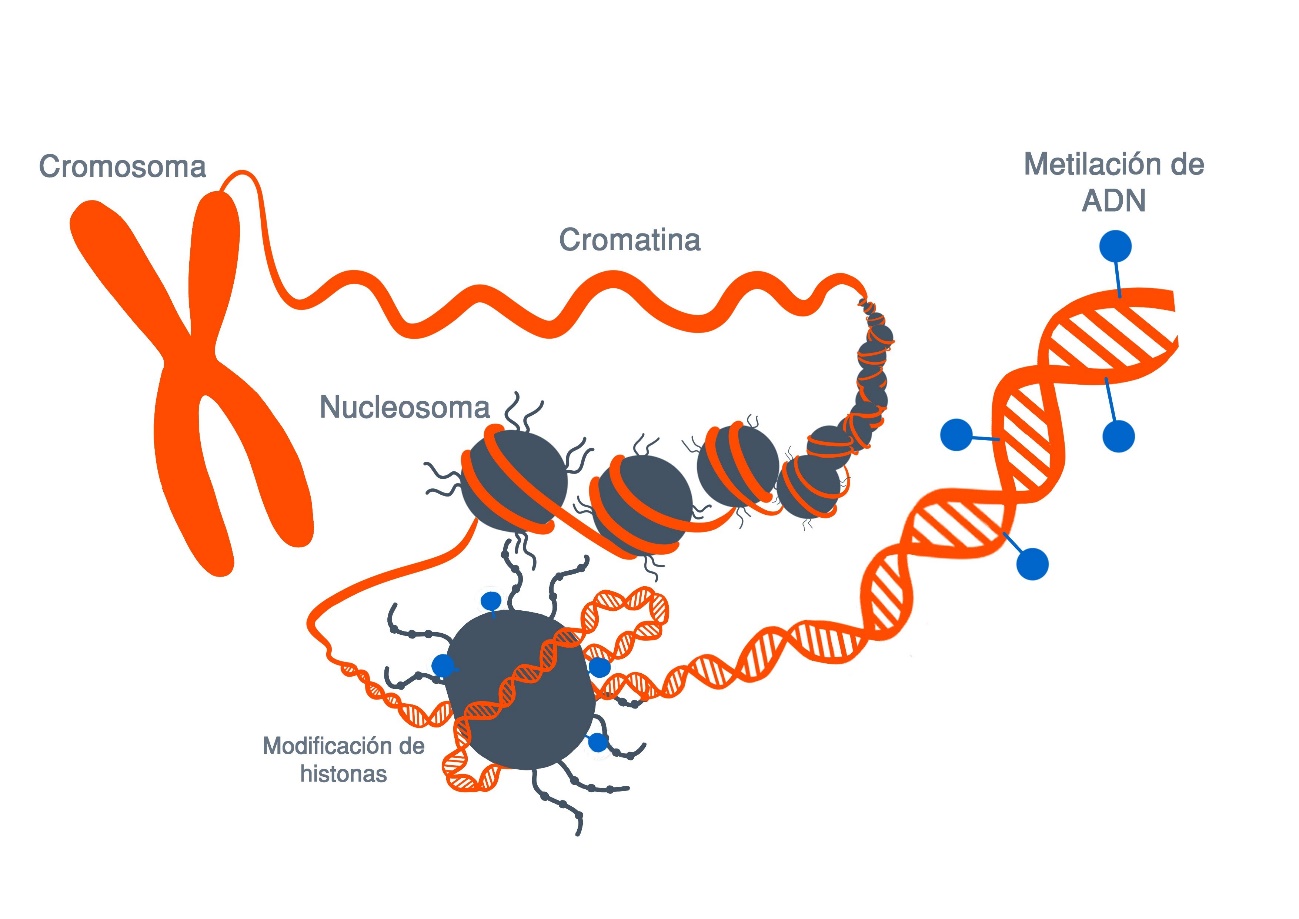
En resumen, los grupos metilo le dicen a la célula qué es, por ejemplo «eres una célula de la piel, y esto es loque tienes que hacer», y las histonas deciden como va a comportarse esa célula de la piel . Cada célula tiene esta combinación de metil e histona, que le indica qué hacer y en que medida.
Sin el epigenoma dando instruccionesal genoma de las células, nuestro cuerpo no sabría qué hacer.
Nuestro genoma es el mismo desde que nacemos hasta que morimos, nuestro epigenoma va cambiando a lo largo de nuestra vida, decidiendo qué genes se activan o desactivan.
En ocasiones, estos cambios suceden cuando se producen cambios físicos importantes en nuestro cuerpo, como puede ser la pubertad o durante el embarazo. Pero, como la ciencia está comenzando a descubrir, existen otros factores externos que también pueden provocar cambios epigenéticos. Cosas como cuánta actividad física realizamos, qué y cuánto comemos, nuestro nivel de estrés, fumar o beber mucho entre otras cosas, pueden provocar cambios en nuestro epigenoma y afectar la forma en que los grupos metilo se unen a las células.
Estos cambios pueden causar errores, y conducen a enfermedades y otros trastornos.
Debido a que el epigenoma cambia constantemente, sería lógico pensar, que cuando nacemos cada uno de nosotros comenzaríamos con una digamos una pizarra limpia, en blanco, es decir, que nuestros padres no nos pasarían sus epigenomas. Y si bien eso es lo que debería suceder, a veces estos cambios epigenéticos se atascan en los genes y se transmiten a los hijos.
Un ejemplo de esto es el Síndrome de Invierno del Hambre Holandés. Los bebés expuestos a la hambruna prenatal durante la Segunda Guerra Mundial en los Países Bajos tenían un mayor riesgo de enfermedad metabólica más adelante en la vida y tenían diferente metilación del ADN de un gen en particular en comparación con sus hermanos del mismo sexo que no estaban expuestos a la hambruna.
“Estos cambios persistieron seis décadas después.“  Metilacion en el dolor
Metilacion en el dolor
”Otro estudio encontró que, si bien los gemelos idénticos son en gran medida indiferenciables entre sí cuando nacen, a medida que envejecen, existen grandes diferencias en sus grupos metilo e histonas, lo que afecta la forma en que sus genes se expresan y explican las diferencias en su salud. El ADN dañado o debilitado que se replica puede inevitablemente crear estados de expresión epigenética alternativos que pueden afectar a varias generaciones. Además, la alteración de la replicación del ADN durante el desarrollo embrionario o prenatal tiene consecuencias epigenéticas para un gen, o el conjunto completo de ADN del organismo.
Si bien la epigenética está todavía en pañales, hay muchas cosas que hacen que parezcan apasionantes.
En primer lugar podría cambiar la forma en que tratamos las enfermedades pues si el epigenoma controla cómo se comportan los genes, un epigenoma erróneo puede comportarse como una mutación genética. Esto nos podría conducir a tener un mayor riesgo de enfermedades autoinmunes o el cáncer, incluso aunque los genes sean perfectamente normales. A medida que se sepan más cosas sobre las causas de los errores epigenéticos, sería posible desarrollar medicamentos que modifiquen los grupos metilo o las histonas que estén causando esos errores, pudiendo desarrollarse una cura para esas enfermedades causadas por epigenética.
En segundo lugar podría cambiar la forma en que tratamos las adicciones. Pues como es bien sabido algunas personas son más vulnerables a las adicciones que otras. Pero no hay un gen de la adicción, pues es una combinación de factores heredados y ambientales lo que conducen a una adicción.
Los mecanismos epigenéticos juegan un papel muy importante en lo que se refiere a las adicciones, pues influyen en cómo se expresan los genes para desarrollar una adicción y también cómo esa predisposición a la adicción se transmite a la descendencia. Una mejor comprensión de cómo el epigenoma afecta la adicción podría significar cambiar la forma en que se trata para evitar que la descendencia tenga un mayor riesgo de padecerla.
En tercer lugar podría cambiar la forma en que abordamos los traumas.
Una de las teorías sobre la epigenética trata de explicar cómo un evento traumático, como podría ser sobrevivir al Holocausto, podrían cambiar el epigenoma de una persona y el de su descendencia.
Un pequeño estudio sugiere que los hijos de los supervivientes del Holocausto heredaron una respuesta específica al estrés.
Otro estudio mostró que los hijos de mujeres embarazadas durante los ataques de septiembre en las torres de New York tenían niveles más bajos de cortisol, lo que podría hacerlos más vulnerables al trastorno de estrés postraumático. Estos estudios al ser muy pequeños tienen sus detractores, pero si bien pueden no ser concluyentes, no es difícil pensar que eventos traumáticos mayores podrían encontrar una manera de alterar el epigenoma de alguien lo suficiente como para transmitirlo a su descendencia.
La epigenética es por ahora un campo de investigación muy joven y muchos de los estudios sobre el tema son muy muy pequeños, por lo que es difícil afirmar que sean concluyentes. Además nadie está seguro en que medida influye lo que hacemos en el epigenoma. Si bien tener unos buenos hábitos, como llevar una dieta saludable, hacer ejercicio regularmente no consumir alcohol se sabe que influye positivamente en tu salud, ¿Pueden estos buenos hábitos revertir cualquier daño anterior que ya hayamos causado al epigenoma?
Pues esto no está claro en humanos. La mayor parte de los trabajos llevados a cabo en epigenética hasta ahora han sido hechos en animales, y aún queda por ver cómo se comporta en humanos. Múltiples cosas influyen en la epigenética como son, el entorno, los medicamentos, la dieta, la edad, a medida que se envejece se producen mas daño en el ADN, pero hay que tener en cuenta que todos los factores epigenéticos funciona de manera conjunta y también que no hay nada que podamos hacer por el momento para evitar morir cuando toque. Lo que si es cierto es que las decisiones que tomemos en cuanto a alimentación o entorno pueden ayudar a retrasar o acelerar el envejecimiento. Un alto nivel de emociones afecta a cómo se expresan los genes.
De igual forme la mala nutrición también modifica la forma en que los genes van a expresarse.
La remisión espontánea de ciertas enfermedades , donde alguien que tiene una enfermedad, de repente sana posiblemente la epigenetica tiene aquí también una acción apasionante.
Este sorprendente y grandioso descubrimiento, le queda mucho por ver.
Pero si esta clara que las lesiones del genoma pueden ser evitables y reparables.
Queda un capitulo por entender, el de las enfermedades psiquiátricas, que posiblemente son producidas por daños genómicos en cadena.
Pero seguro que también los encontraremos.
Referencias
Iridoy Zulet, Marina; Pulido Fontes, Laura; Ayuso Blanco, Teresa; Lacruz Bescos, F.; Mendioroz Iriarte, Maite (septiembre de 2017). «Modificaciones epigenéticas en neurología: alteraciones en la metilación del ADN en la esclerosis múltiple». Neurología (en inglés) (Elsevier España, S.L.U.) 32 (7): 463-468. doi:10.1016/j.nrl.2015.03.011. Consultado el 10 de octubre de 2018.
Berger SL, Kouzarides T, Shiekhattar R, Shilatifard A. An operational definition of epigenetics. ‘Genes Dev 2009;23:781-783.
Waddington CH. Preliminary notes on the development of the wings in normal and mutant strains of drosophila. Proc Natl Acad Sci USA 1939;25:299-307.
Berger SL, Kouzarides T, Shiekhattar R, Shilatifard A. An operational definition of epigenetics. ‘Genes Dev 2009;23:781-783.
Michael Mosley (16 de septiembre de 2015). «El extraordinario impacto para tu salud de lo que comía tu madre en el embarazo». BBC News, Mundo. Consultado el 20 de mayo de 2022.
Epigenética, mucho más que genes, ADC Murcia, 30 de enero de 2014.
José Luis García-Giménez (2012). Epigenética. La gramática del código genético: Journal of Feelsynapsis, ISSN 2254-3651. 4:34-38.
García Azkonobieta, T.(2005). Evolución, desarrollo y (auto)organización. Un estudio sobre los principios filosóficos de la evo-devo Archivado el 12 de abril de 2012 en Wayback Machine.: tesis doctoral dirigida por Miren Arantzazu Etxeberria Agiriano. Universidad del País Vasco, Donostia-San Sebastián.
«Epigenética». www.revistaeidon.es. Archivado desde el original el 21 de septiembre de 2016. Consultado el 10 de septiembre de 2016.
Gilbert, S. F., & Epel, D. (2009). Ecological Developmental Biology. Sunderlad: Sinauer Associates Inc.
Watt, W. B. (1969). Adaptive significance of pigment polymorphisms in Colias butterflies, II. Thermoregulation and photoperiodically controlled melanin variation in Colias eurytheme. PNAS, 63 (3), 767-774.
Nijhout, H. F. (1999). Control mechanisms of polymorphic development in insects. BioScience, 42, 181-192.
Nijhout, H. F. (2003). Development and evolution of adaptive polyphenisms. Evolution and Development, 5, 9-18.
Woodward, D. E., & Murray, J. D. (1993). On the effects of temperature-dependent sex determination on sex ratio and survivorship in crocodilians. Proceedings of the Royal Society of London, 252, 149-155.
Kroon, F. J., Munday, P. L., Westcott, D. A., Hobbs, J. P., & Liley, N. R. (2005). Aromatase pathway mediates sex change in each direction. Proceedings. Biological Sciences, 272, 1399-1405.
Plowright, R. C., & Pendrel, B. A. (1977). Larval growth in bumble bees. The Canadian Entomologist, 109, 967-973.
Kucharski, R., Maleszka, J., Foret, S., & Maleszka, R. (2008). Nutritional Control of Reproductive Status in Honeybees via DNA Methylation. Science, 319, 1827-1830.
Emlen, D. J. (1997). Alternative reproductive tactics and male dimorphism in the horned beetle Ontophagus acuminatus (Coleoptera:Scarabaeidae). Behavioral ecology and sociobiology, 141, 335-341.
Emlen, D. J., & Nijhout, H. F. (1999). Hormonal control of male horn length dimorphism on the horned beetle Ontophagus taurus. Journal of Insect Physiology, 45, 45-53.
Emlen, D. J. (2000). Integrating development with evolution: a case study with beetle horns. BioScience, 50, 403-418.
↑ Mardones L.; Villagrán M.; Lanuza F.; Leiva A.M.; Troncoso C.; Martínez-Sanguinetti M.A.; Peterman-Rocha F.; Celis-Morales C. (2019). «La trascendencia de la alimentación prenatal: Desde la hambruna holandesa hasta la realidad chilena». Rev. chil. pediatr. (Santiago) 90 (4).
Black, M. P., Moore, T. B., Canario, A. V., Ford, D., Reavis, R. H., & Grober, M. S. (2005). Reproduction in context:Field-testing a lab model of socially controlled sex change in Lythrypnus dalli. Journal of Experimental Marine Biology and Ecology, 318, 127-143
Mark A. Dawson, Tony Kouzarides, and Brian J.P. Huntly. Targeting epigenetic readers in cancer. N Engl J Med, 2012; 367:647-657, August 16, 2012.
Geutjes E, Bajpe P, Bernards R. Targeting the epigenome for treatment of cancer. ‘Oncogene 2012; 31(34): 3827-3844, Agust 23, 2012.
Paoloni-Giacobino, Ariane (2014).