SÍNDROME DE RETT
El síndrome de Rett es una enfermedad congénita con compromiso neurológico que afecta la gran mayoría de las veces al sexo femenino. 
La enfermedad no es evidente en el momento del nacimiento, sino que se manifiesta generalmente durante el segundo año de vida, y en todos los casos antes de los 4 años. Afecta aproximadamente a 1 niño de cada 10 000. Puede observarse una adquisición del lenguaje y de la coordinación motriz gravemente tardía, así como una discapacidad intelectual grave. La pérdida de las capacidades es por lo general persistente y progresiva.
Este articulo presta interés a las manifestaciones de desórdenes motores y ansiedad que presentan estos pacientes
El síndrome de Rett provoca grave discapacidad en todos los niveles, haciendo al enfermo dependiente de los demás para el resto de la vida. Toma su nombre del médico austríaco Andreas Rett, que fue el primero en describir la enfermedad en 1966.1
Se estima que el síndrome de Rett afecta a una de cada 10 000 niñas.2 Ocurre en todos los grupos raciales y étnicos a nivel mundial. Afecta principalmente a mujeres. Existen exámenes prenatales disponibles para las familias que tengan una hija en la que se haya identificado una mutación de tipo MECP2.
Debido a que el trastorno ocurre espontáneamente en la mayoría de los casos, el riesgo de que una familia tenga una segunda niña con el trastorno es de menos del 1 por ciento. 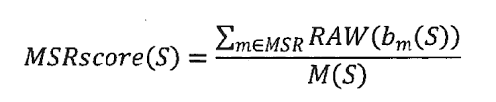
Parece deberse a una anomalía del cromosoma X dominante sobre su brazo largo (Xq28), en la posición MECP2, encargada de la producción de la proteína homónima. También se han observado casos en que, incluso estando presente esta anomalía, los sujetos no satisficieron los criterios que definen el síndrome de Rett. 
En 1999 los científicos identificaron el gen que se cree controla las funciones de otros genes. Cuando funciona normalmente, el gen MECP2 contiene instrucciones para la síntesis de una proteína llamada proteína metilo citosina de enlace 2 (MeCP2), que actúa como uno de los muchos interruptores bioquímicos que indican a otros genes cuándo dejar de funcionar y parar de producir sus propias proteínas. Debido a que el gen MECP2 no funciona correctamente en las personas que padecen del síndrome de Rett, se forman cantidades escasas de dicha proteína. La ausencia de la proteína hace que otros genes se activen y se mantengan activos en las etapas inadecuadas, generando cantidades excesivas de proteína. A largo plazo, esto puede causar los problemas de desarrollo neurológico que son característicos en este trastorno.
En los últimos años ha habido avances esperanzadores para los afectados y sus familias. Adrian Bird y su equipo, de la universidad de Edimburgo, han experimentado con ratones y demostrado que los síntomas de la enfermedad no son irreversibles, aunque el camino por recorrer es largo, este descubrimiento constituye una gran esperanza para el futuro de las afectadas por el síndrome de Rett.
Entre el setenta y el ochenta por ciento de las niñas diagnosticadas con el síndrome de Rett tienen la mutación genética de tipo MECP2. Los científicos creen que 20 a 30 por ciento de los casos restantes pueden deberse a mutaciones en otras partes del gen o a genes que todavía no han sido identificados, por lo que continúan investigando otras mutaciones.
La mayoría de los casos son esporádicos, lo que significa que la mutación ocurre al azar y no se hereda.
Tras una fase inicial de desarrollo normal, se asiste a una detención del desarrollo y luego a un retroceso o pérdida de las capacidades adquiridas. Se observa una disminución de la velocidad de crecimiento del cráneo (de tamaño normal al nacimiento) con respecto al resto del cuerpo entre los primeros 5 y 48 meses de vida.
Se ha observado un desarrollo psicomotor normal dentro de los primeros 5 meses de vida. Posteriormente se deterioran las capacidades manuales anteriormente desarrolladas y aparecen movimientos estereotipados de las manos (agitarlas, morderlas, retorcerlas). Se observa también una progresiva pérdida de interés por el entorno social, que en algunos casos reaparece con la adolescencia.
Otro síntoma, la apraxia —la incapacidad de realizar funciones motoras— es quizás la característica más debilitante del síndrome de Rett. La apraxia interfiere con todos los movimientos del cuerpo, incluyendo la fijación de la mirada y el habla.
Algunos autores destacan de esta apraxia la inquietud y agitación constantes
Los individuos que padecen del síndrome de Rett a menudo presentan comportamientos autistas en las primeras etapas. Otros síntomas pueden incluir caminar con la punta de los pies, problemas del sueño; marcha con amplia base de sustentación (es decir, con las piernas muy separadas); rechinar o crujir los dientes y dificultad para masticar; crecimiento retardado; incapacidades cognoscitivas (del aprendizaje e intelecto) y dificultades en la respiración al estar despierto que se manifiestan por hiperventilación, apnea y aspiración de aire.
También pueden estar presentes anomalías del electrocardiograma, epilepsia (más del 50% de las personas enfermas ha tenido al menos una crisis epiléptica), rigidez muscular que puede provocar deformidad y atrofias musculares, deambulación (en cerca del 50% de los sujetos), escoliosis y retraso del crecimiento.
Desarrollo prenatal y perinatal aparentemente normal.y el desarrollo psicomotor aparentemente es normal en los primeros 5 meses después del nacimiento.
Circunferencia del cráneo normal al momento del nacimiento.
Después del período de desarrollo normal disminuyee la velocidad del crecimiento del cráneo entre los 5 y los 48 meses.
Pérdida de capacidades manuales finas adquiridas anteriormente entre los 5 y los 30 meses y desarrollo de movimientos estereotipados de las manos.
Pérdida precoz del interés social (aunque la interacción social a menudo suele desarrollarse posteriormente).
Marcha y movimientos del tronco poco coordinados.
Deterioro severo en el desarrollo del lenguaje expresivo y receptivo, acompañado de un retraso psicomotor importante.
No existe una terapia resolutiva para el síndrome de Rett. Sin embargo, gran parte de los autores creen que el curso de la enfermedad puede ser modificado por una variedad de terapias dirigidas a retardar la progresión de las discapacidades motrices y a mejorar las capacidades de comunicación. Por ello, el suministro de fármacos se dirige principalmente a contrarrestar el trastorno motor. Se han empleado L .Dopa y agonistas de la dopamina. Entre éstos, la Bromocriptina y la Lisurida han dado algunos resultados positivos.
Se han detectado mejorías en los síntomas respiratorios y conductuales y en las crisis epilépticas con el suministro de Naltresona, que detiene la producción de beta-endorfinas inhibiendo los receptores opiáceos. Para contrarrestar las crisis epilépticas también se emplean con éxito los antiepilépticos como la Carbamazepina el ácido Valproico, y más recientes lamotrigina y Gabapentina.
Los fármacos se complementan con terapias dirigidas a conseguir mejorías tanto en el plano educativo y cognitivo como en el conductual, y en una mejor gestión de las emociones. También son beneficiosas las sesiones de fisioterapia que mejoran y mantienen el desarrollo motor adecuado del niño, así como el mantenimiento funcional y psicomotriz de los movimientos y posturas, las sesiones de terapia ocupacional se emplean para disminuir el retraso cognitivo.
A pesar de las dificultades que acarrean los síntomas, la mayoría de los individuos que padecen el síndrome de Rett continúan viviendo hasta la edad adulta. Debido a que el trastorno es poco común, se sabe muy poco sobre la esperanza de vida y la prognosis a largo plazo. A pesar de que se estima que hay muchas mujeres de edad mediana (entre 40 y 50 años) que padecen este trastorno, no se han estudiado suficientes casos para llevar a cabo cálculos exactos sobre la esperanza de vida más allá de la edad de 40 años.
La evolución y la gravedad del síndrome de Rett es muy variable. Algunas niñas presentan un trastorno congénito (antes o durante el nacimiento), mientras que otras pueden presentar una regresión tardía o síntomas más leves.
Debido a que las niñas poseen dos copias del cromosoma X y necesitan solamente una copia en funcionamiento para generar la información genética, desactivan el cromosoma X adicional en un proceso llamado desactivación del cromosoma X. Este proceso ocurre al azar para que cada célula posea un cromosoma X activo. La gravedad del síndrome de Rett en las niñas depende del porcentaje de las células que poseen una copia normal del gen MECP2 después de que ocurre la desactivación del cromosoma X: si la desactivación del cromosoma X inhibe al cromosoma X que porta el gen defectuoso en una gran cantidad de células, los síntomas tienden a ser más leves, pero si un porcentaje más grande de células posee el cromosoma X sano desactivado, el inicio del trastorno puede ocurrir antes y los síntomas pueden ser más graves.
Un estudio patrocinado por el NINDS está investigando mutaciones en el gen MECP2 en individuos que padecen del síndrome de Rett para descubrir cómo funciona la proteína MeCP2. La información proveniente de este estudio incrementará la comprensión de dicho trastorno y hará factible nuevas terapias.
Los científicos saben que la carencia de una proteína MeCP2 que funcione correctamente causa problemas en el patrón de desarrollo, pero se desconocen los mecanismos exactos por los que esto ocurre. Los investigadores también están intentando encontrar otras mutaciones genéticas que puedan causar el síndrome de Rett y otros interruptores genéticos que funcionan de manera similar a la proteína MeCP2. Una vez que descubran cómo funciona la proteína y logren conseguir interruptores similares, podrán buscar las terapias que puedan reemplazar al interruptor que funciona incorrectamente. Otro resultado pudiera involucrar la manipulación de otras rutas bioquímicas para sustituir el gen MECP2 que funciona incorrectamente, previniendo así la progresión del trastorno.
La vía CRH, punto de entrada potencial para el tratamiento de la ansiedad en el síndrome de Rett y trastornos relacionados
Es la primera investigación que aborda las consecuencias de manipulaciones tempranas estresantes en el modelo de Rett.

Un estudio multicéntrico europeo con modelos animales, en el cual participan María Abellán-Álvaro y Carmen Agustín-Pavón, de la Unidad Mixta de Investigación en Neuroanatomía Funcional de la Universitat de València (UV), ha añadido evidencias sobre la vía CRH (hormona liberadora de corticotropina, que controla la liberación de hormonas del estrés) como un punto de entrada potencial para el tratamiento de la ansiedad en el síndrome de Rett -una enfermedad rara que afecta al desarrollo neurológico, principalmente en niñas, y que provoca discapacidad motora e intelectual, pérdida del habla y epilepsia, entre otros síntomas- y trastornos relacionados.
El estudio, liderado por Mónica Santos, del Centro de Neurociencia y Biología Celular de la Universidad de Coímbra (Portugal) y con la colaboración de Oliver Stork, de la Universidad Otto von Guericke de Magdeburgo (Alemania), se ha publicado en la revista Journal of Neurodevelopmental Disorders y ha contado con la financiación de las Ayudas FinRett 2019 para la Investigación del Síndrome de Rett, la Foundación Jérôme Lejeune, y el Ministerio de Ciencia e Innovación de España.
El proyecto, la primera investigación que aborda las consecuencias de manipulaciones tempranas estresantes en el modelo de Rett, pretendía profundizar en los factores que contribuyen a las alteraciones en la ansiedad que padecen las niñas y mujeres este síndrome, con el objetivo de encontrar nuevas dianas terapéuticas para la mejora de los síntomas. Para ello, se ha analizado en ratones la interacción del estrés durante la primera infancia con la deficiencia del gen MECP2 -las mutaciones en el mismos son la principal causa del síndrome de Rett-, y así conocer las consecuencias de ambos factores sobre la expresión de la ansiedad durante la adolescencia.
El estudio, realizado en hembras jóvenes de ratón deficientes para el gen MECP2, ha confirmado que estos animales muestran alteraciones muy significativas en la expresión del comportamiento ansioso, al compararlas con hembras sanas, pese a ser consideradas todavía presintomáticas. Estas alteraciones en el comportamiento ansioso fueron similares a las mostradas por ratones sanos a los que se sometió a un estrés temprano moderado, separándolas durante tres horas al día de sus madres mientras fueron lactantes.
De esta manera, se confirma el papel clave del gen MECP2 durante el desarrollo postnatal en alteraciones posteriores en el comportamiento de ansiedad. “Tanto los animales MECP2-deficientes como sus controles sanos a los que se sometió a separación materna durante la primera infancia mostraron, durante la realización de una prueba que induce ansiedad en una edad comparable a la adolescencia humana, un menor comportamiento ansioso y una menor activación de las neuronas que segregan hormona liberadora de corticotropina (CRH, que controla la liberación de hormonas del estrés)”, apunta Agustín-Pavón, doctora en Neurociencias por la UV y profesora del Departamento de Biología Celular, Biología Funcional y Antropología Física, que también incide en que “estos resultados muestran que el sistema neuroendocrino de control del estrés se ve alterado tanto por la deficiencia en MECP2 como por las condiciones adversas durante el desarrollo temprano”.
Implicaciones
Los datos han confirmado la vía CRH como un punto de entrada potencial para el tratamiento de la ansiedad en el síndrome de Rett y trastornos relacionados. Es importante resaltar que el estudio se ha realizado en hembras, un modelo más cercano a la enfermedad humana, que afecta muy mayoritariamente a niñas y mujeres. “Muchos de los estudios que se realizan en el modelo en ratón utilizan exclusivamente machos”, añade Agustín-Pavón.
A partir de estos resultados, se vislumbran nuevas investigaciones. “En nuestro caso, tenemos un proyecto financiado por el Ministerio de Ciencia, del cual soy investigadora principal, que investigará el efecto del estrés temprano en la maduración neural postnatal, que recientemente mostramos que se encuentra alterada en este modelo (ref Martínez-Rodríguez E, Martín-Sánchez A, Coviello S, Foiani C, Kul E, Stork O, Martínez-García F, Nacher J, Lanuza E, Santos M, Agustín-Pavón C. Lack of MeCP2 leads to region-specific increase of doublecortin in the olfactory system. Brain Struct Funct. 2019 May;224(4):1647-1658. doi: 10.1007/s00429-019-01860-6.)”, comenta Agustín-Pavón. Una vez establecidas nuevas dianas terapéuticas, “el objetivo último es revertir los síntomas mediante una aproximación farmacológica o una combinación de manipulación ambiental y farmacológica”.
El síndrome de Rett está catalogado en el DSM-IV («Diagnostic and Statistical Manual of Mental Disorders-Fourth Edition», manual diagnóstico de los trastornos psiquiátricos de la American Psychiatric Association) dentro de una categoría más general, los Trastornos Generalizados del Desarrollo (o Trastornos Penetrantes del Desarrollo) y se diagnostica basándose en la presencia de un cierto número de indicadores conductuales. Los criterios diagnósticos se organizan en el siguiente esquema.
Referencias
Síndrome de Rett – Criterios diagnósticos. Archivado el 1 de abril de 2013 en Wayback Machine. Consultado el 10 de febrero de 2012
«Artículo sobre el síndrome de Rett del Instituto Nacional de Salud Infantil y Desarrollo Humano». Archivado desde el original el 16 de mayo de 2011.
NINDS 2008 «El Síndrome de Rett»; National Institute of Neurological Disorders and Stroke:Office of Communications and Public Liaison; Revisado el 6 de junio de 2008; Publicación de NIH 04-4863S; Bethesda, MD 20892; URL: http://espanol.ninds.nih.gov/trastornos/el_sindrome_de_rett.htm
1 Rett A. «On an unusual brain atropic syndrome with hyperammonemia in childhood». Wien Med Wochenschr 1966; 116:723-726.
2 Hagberg B, Aicardi J, Dias K, Ramos O. «A progressive syndrome of autism dementia, ataxia, and loss of purposeful hand use in girls: Rett’s syndrome: report of 35 cases». Ann Neurol 1983; 14:471-479.
María Abellán Álvaro y Carmen Agustín Pavon, autoras del estudio.
Enrique Mezquita. Valencia Mar, 22/03/2022 – 13:49