|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ¿Qué es el eje intestino-cerebro?
El eje intestino-cerebro se refiere a la comunicación bidireccional entre el sistema nervioso del tracto gastrointestinal (GI), denominado sistema nervioso entérico (ENS), y el sistema nervioso central (SNC). El intestino humano adulto contiene más de 1 kg de bacterias, que no solo son responsables de la salud intestinal, sino que también influyen en el funcionamiento de otros órganos, incluido el cerebro. La microbiota intestinal es capaz de comunicarse con el cerebro a través de una variedad de rutas, incluso a través de vías directas de la médula espinal y el nervio vago o a través de metabolitos circulantes y células inmunes. El microbioma intestinal juega un papel crítico en muchos procesos neurogenerativos, como la formación de la barrera hematoencefálica, la mielinización, la maduración de la microglía, la respuesta inmune a la infección y la neurogénesis. La microbiota intestinal alterada o desregulada, especialmente en la primera infancia o durante el envejecimiento, puede tener un efecto grave en la función cerebral, lo que lleva a afecciones neuropsiquiátricas y trastornos neurodegenerativos.
Solicitar o descargar póster del eje intestino-cerebro
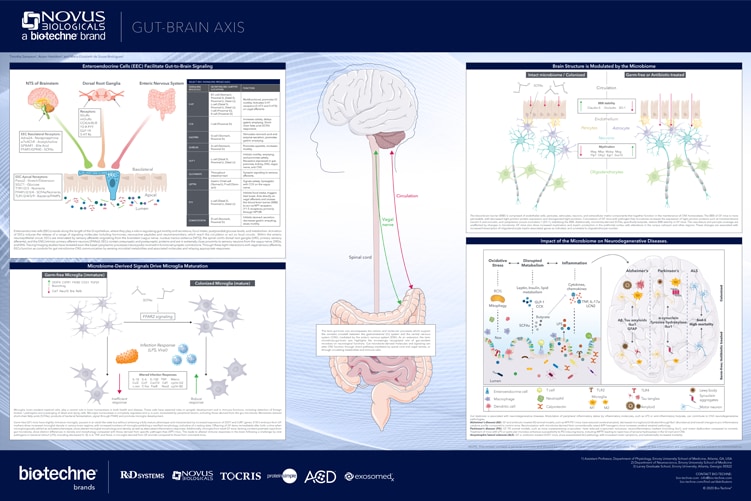
Sistema nervioso entérico El sistema nervioso entérico (ENS) es parte del sistema nervioso autónomo que puede funcionar de forma independiente, pero también tiene múltiples conexiones con el SNC, conocido como el eje intestino-cerebro. El sistema nervioso entérico, como se muestra a continuación, es una serie compleja de neuronas sensoriales, interneuronas y neuronas motoras que forman circuitos locales dentro de la pared entérica, con entradas tanto del entorno local como del SNC. Actores clave e interacciones neuronales del sistema nervioso entérico
Gráfico creado en colaboración con el Dr. Timothy Sampson, Ph.D. del Departamento de Fisiología de la Escuela de Medicina de la Universidad de Emory La motilidad GI está regulada por las interacciones entre las neuronas entéricas, los músculos y las células epiteliales intestinales. Entre estas, las neuronas sensoriales Las neuronas aferentes primarias intrínsecas (IPAN) desempeñan un papel central en la mecanodetección y responden a los estímulos químicos para regular la motilidad. Por ejemplo, las moléculas derivadas de microbios y producidas por el huésped, incluidos los lipopolisacáridos (LPS) y los ácidos biliares, se secretan en la circulación, son detectadas por las neuronas sensoriales y procesadas por el cerebro. El nervio vago y la médula espinal también expresan proteínas y enzimas importantes, incluida la colina acetiltransferasa (ChAT), que regula la biosíntesis del neurotransmisor acetilcolina, y la tubulina Beta III (TUBB3), que desempeña un papel en el desarrollo neuronal. El nervio vago contiene fibras aferentes (sensoriales) y eferentes (motoras) y, por lo tanto, es responsable de llevar señales motoras al intestino y transmitir señales sensoriales al SNC. Otro jugador clave del sistema nervioso entérico son los EPC, a menudo conocidos como las células gustativas del intestino, que son células epiteliales intestinales especializadas capaces de detectar y responder a las señales ambientales. Las EPC desempeñan un papel en la comunicación intestino-cerebro a través de conexiones neuronales directas e indirectas, sirviendo como un componente vital del sistema nervioso entérico. Los cultivos celulares tridimensionales (3D), también llamados organoides, se están convirtiendo en la tecnología preferida para estudiar la naturaleza compleja y dinámica del sistema nervioso entérico en comparación con los modelos tradicionales que involucran modelos animales, análisis de tejidos post mortem y estudios genéticos humanos. Los sistemas de modelos de cultivo celular 3D recapitulan con mayor precisión las interacciones célula-célula en comparación con los modelos de cultivo celular 2D, al tiempo que proporcionan acceso a tejidos previamente inaccesibles. Los organoides entéricos consisten en organoides intestinales humanos con la adición de entradas de neuronas entéricas y sensoriales.
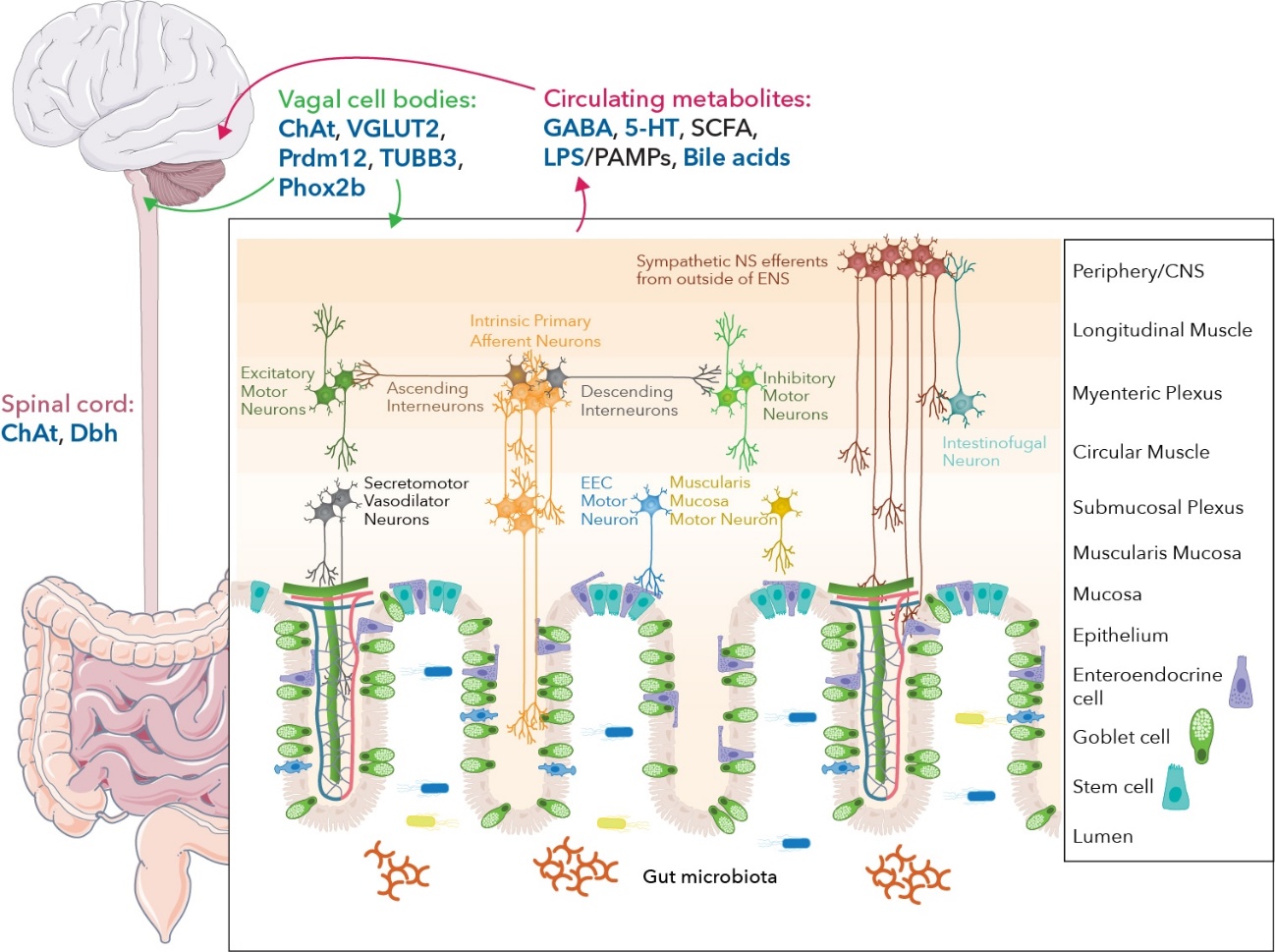
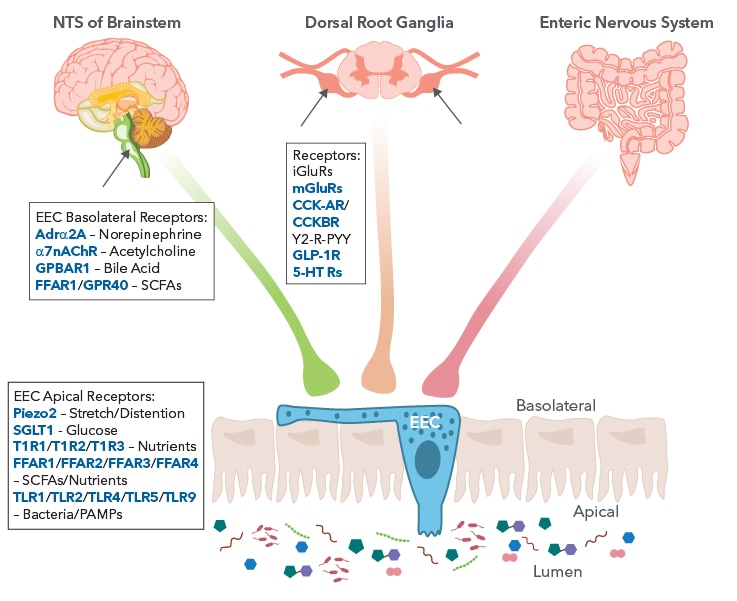
Señalización de células enteroendocrinas (CEE) Los EPC desempeñan un papel en la regulación de la secreción y la motilidad intestinal, la ingesta de alimentos, los niveles de glucosa después de las comidas y el metabolismo. Los EPC pueden detectar el contenido luminal y, a su vez, producir y secretar moléculas de señalización como hormonas, péptidos y neurotransmisores que pueden actuar en los circuitos locales y unirse a receptores específicos. Las EPC pueden transmitir señales localmente a otras células intestinales cercanas a través de la señalización paracrina, a través de hormonas circulantes en el torrente sanguíneo a través de la señalización endocrina y a través de vías neuronales. El circuito neuroepitelial entérico está formado por procesos similares a axones que hacen conexiones directas desde las EPC al cerebro y al intestino. Las EPC están inervadas por aferentes sensoriales de varios lugares, formando la comunicación bidireccional cerebro-intestino. Específicamente, hay procesos neuronales del tronco encefálico (nervio vago, núcleo tractus solitarius (NTS)), los ganglios de la raíz dorsal (DRG) de la médula espinal y el sistema nervioso entérico (ENS). Las EPC facilitan la señalización de intestino a cerebro Gráfico creado en colaboración con el Dr. Timothy Sampson, Ph.D. del Departamento de Fisiología de la Escuela de Medicina de la Universidad de Emory
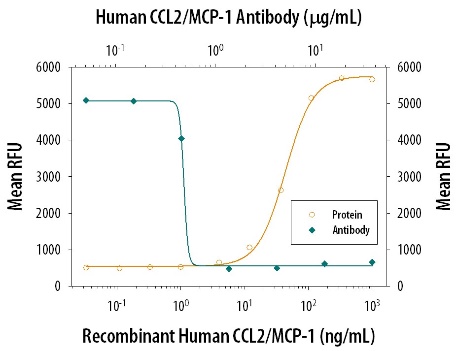
Los diversos receptores ubicados en los propios EPC y dentro de los NTS y DRG son esenciales para la comunicación intestino-SNC y son responsables de detectar los metabolitos y moléculas secretadas y transmitir las respuestas apropiadas. Los EPC poseen procesos citoplasmáticos basales que contienen hormonas llamados neurópodos que pueden extenderse a células distantes y conectarse directamente a los nervios. Estos neurópodos ayudan a formar conexiones sinápticas entre las proteínas presinápticas y postsinápticas de las EPC y las neuronas sensoriales. Milo de ProteinSimple se ha utilizado para confirmar neuropods de EPC que contienen moléculas de señalización, midiendo específicamente la expresión de la proteína presináptica sinapsina-I. Obtenga más información sobre los marcadores de neurópodos detectados por Milo. Existen distintas subpoblaciones de EPC que liberan moléculas de señalización y hormonas específicas en respuesta a diversos estímulos. Los estudios con ratones transgénicos han revelado que las EPC son capaces de secretar más de una molécula de señalización y tienen perfiles de coexpresión complejos. Las moléculas de señalización producidas por las EPC también están influenciadas por la región del tracto gastrointestinal. Por ejemplo, las células A, un subtipo de EPC ubicado principalmente en el estómago, liberan la molécula de señalización grelina, mientras que las células L ubicadas en gran parte en el intestino delgado distal (SI) y el colon producen 5-HT, GLP-1 y péptido YY (PYY). Estas moléculas de señalización tienen diversas funciones que van desde la motilidad gastrointestinal hasta la saciedad de señalización. La identificación de las moléculas de señalización específicas expresadas por cada subtipo celular dará como resultado una mejor caracterización de las EPC y proporcionará una comprensión más profunda de las interacciones célula-molécula-receptor.
Moléculas de señalización EEC, subtipo celular, especificidad y ubicación del receptor, y función
*Nota: Esta no es una tabla inclusiva, sino que destaca algunas de las principales moléculas de señalización. *Abreviaturas: LI, Intestino Grueso; SI, intestino delgado
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Señalización del microbioma
La estructura del cerebro y el microbioma La microbiota intestinal es crítica para la formación y funcionalidad de la barrera hematoencefálica (BBB). El BBB sirve como una barrera semipermeable selectiva entre los solutos en la sangre circulante y el cerebro. El BBB está compuesto por células endoteliales, pericitos, astrocitos, neuronas, oligodendrocitos y componentes de la matriz extracelular que en conjunto funcionan en el mantenimiento de la homeostasis del SNC. Los estudios de ratones libres de gérmenes (GF) revelan una función BBB deteriorada y una mayor permeabilidad a las macromoléculas en comparación con los ratones colonizados normales. Por lo general, los microbios intestinales producen ácidos grasos de cadena corta (SCFA) que señalan a las células epiteliales para formar el BBB, aumentan la expresión de proteínas de unión estrecha, incluidas la claudina-5, la ocludina y la ocludensa de la zónula citoplasmática-1 (zo-1) / proteína de unión apretada 1, y disminuyen la expresión de genes que codifican para proteínas relacionadas con la mielinización. BBB y expresión de proteína de mielinización en ratones GF en comparación con ratones colonizados
Ver más recursos sobre la barrera hematoencefálica
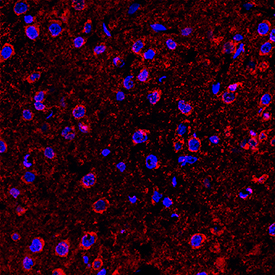
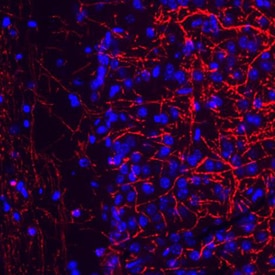
Microglia y respuesta a la infección La microglía son las células inmunes residentes del cerebro. Se ha demostrado que los SCFA producidos por el microbioma intestinal promueven la maduración de la microglía. Los ratones GF tienden a tener microglía más inmadura que aparecen en un estado pausado o de topografía. La densidad microglial aumenta en ratones GF y tienen morfología ramificada, clasificada por cuerpos celulares más pequeños y numerosos procesos largos. Curiosamente, la microglía de ratones libres de patógenos específicos (SPF) se encuentra en un estado activo y tiene grandes cuerpos de células ameboides y procesos retraídos y más rechonchos, característicos de la madurez. Además de las diferencias morfológicas, la microglía inmadura y madura tiene una expresión génica variable. Específicamente, la microglía inmadura ha aumentado la expresión génica del adn Damage Inducible Transcript 4 (DDIT4) y Colony stimulating factor receptor 1 (CsfR1), los cuales tienen un papel en la regulación del crecimiento, la maduración, la proliferación y la supervivencia de las células de microglia. Por el contrario, la microglía inmadura ha disminuido Cst7, un gen asociado con el envejecimiento y la desmielinización, y la expresión de Neurl3 en comparación con la microglía madura y colonizada. Además de la morfología microglial alterada y la expresión génica, los ratones GF y colonizados tienen diferentes respuestas a la infección. El lipopolisacárido (LPS) es un patrón molecular asociado a patógenos (PAMP) que impulsa tanto la inflamación gastrointestinal como la neuroinflamación. El desafío bacteriano (como el LPS) o la infección viral hace que la microglía en el cerebro pase de un estado de encuesta a un estado activo y libere citoquinas proinflamatorias.
La microglía inmadura (GF) muestra una respuesta de infección ineficiente en comparación con la microglía madura (colonizada) con disminución de la producción de IL-1β, IL-6, TNF y Nox2. Zheng et al examinaron los efectos de un fármaco con efectos neuroprotectores conocidos en muchas enfermedades neurodegenerativas y neuroinflamatorias sobre el dolor neuropático espinal. Los investigadores encontraron que la neuroinflamación espinal podría reducirse suprimiendo la producción de citoquinas IL-1β (NB600-633), detectada en Western Blot, lo que indica que la reducción del dolor inducida por fármacos fue causada por la inhibición de la vía microglial il-1β. En general, el estudio destaca que la microglía es uno de los actores clave que subyacen al dolor neuropático y, por lo tanto, puede ser un objetivo para el tratamiento del dolor relacionado con el SNC.
Microglia en neuroinflamación Visión general
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
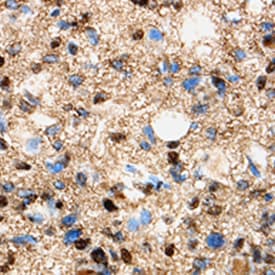
Enfermedades neurodegenerativas Las enfermedades y trastornos neurológicos no se originan únicamente en el cerebro, sino que están influenciados por una variedad de afecciones y factores periféricos. La neuroinflamación, el metabolismo alterado y el estrés oxidativo son características comunes de la neurodegeneración y el avance de la enfermedad. La microglía responde a los PAMPS y a los patrones moleculares asociados al daño (DAMP) asociados con la infección o los estados de enfermedad mediante la producción de especies reactivas de oxígeno (ROS), que contribuyen aún más a patologías neurodegenerativas como la enfermedad de Alzheimer (EA), la enfermedad de Parkinson (EP) y la esclerosis lateral amiotrófica (ELA). En un estudio realizado por Lee et al, las células sanguíneas y el plasma del cordón umbilical humano se probaron como tratamiento para la EP. Los investigadores mostraron una reducción tanto en el marcador de activación de células inmunes MHC Clase II RT1B Anticuerpo (NB100-65541) como en la producción de citoquinas proinflamatorias junto con una disminución de la microbiota inflamatoria en el intestino, destacando el papel de la disbiosis intestinal en la neurodegeneración. Novus Biologicals ofrece una variedad de diapositivas prefijadas y listas para usar de tejido cerebral normal y enfermo, incluyendo EA, EP, Esclerosis Múltiple, Depresión, Demencia y Parálisis Supranuclear Progresiva.
Obtenga más información sobre neurodegeneración y objetivos de proteínas clave |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Recursos y soporte del eje intestino-cerebro
Recursos organoides: Manual de cultivo de organoides Protocolos de cultivo de organoides Recursos y recetas para cultivos de células organoides y 3D Seleccionar referencias Abdel-Haq, R., Schlachetzki, J., Glass, C. K. y Mazmanian, S. K. (2019). Conexiones microbioma-microglía a través del eje intestino-cerebro. Revista de medicina experimental. https://doi.org/10.1084/jem.20180794 Bisht, K., Sharma, K., & Tremblay, M. È. (2018). El estrés crónico como factor de riesgo para la enfermedad de Alzheimer: Roles de la remodelación sináptica mediada por microglia, la inflamación y el estrés oxidativo. Neurobiología del estrés. https://doi.org/10.1016/j.ynstr.2018.05.003 Buford T. W. (2017). (Des)Confíe en su intestino: el microbioma intestinal en la inflamación, la salud y la enfermedad relacionadas con la edad. Microbioma. https://doi.org/10.1186/s40168-017-0296-0 Chukwurah, E., Osmundsen, A., Davis, S. W., & Lizarraga, S. B. (2019). All Together Now: Modelando la interacción de sistemas neuronales con sistemas no neuronales utilizando modelos organoides. Fronteras en neurociencia. https://doi.org/10.3389/fnins.2019.00582 Cryan, J. F., O’Riordan, K. J., Cowan, C., Sandhu, K. V., Bastiaanssen, T., Boehme, M., Codagnone, M. G., Cussotto, S., Fulling, C., Golubeva, A. V., Guzzetta, K. E., Jaggar, M., Long-Smith, C. M., Lyte, J. M., Martin, J. A., Molinero-Perez, A., Moloney, G., The Microbiota-Gut-Brain Axis. Revisiones fisiológicas. https://doi.org/10.1152/physrev.00018.2018 Morelli, E., Morillas, E., O’Connor, R., … Dinan, T. G. (2019). El eje microbiota-intestino-cerebro. Revisiones fisiológicas. https://doi.org/10.1152/physrev.00018.2018 Dinan, T. G., & Cryan, J. F. (2017). El eje microbioma-intestino-cerebro en la salud y la enfermedad. Clínicas de gastroenterología de América del Norte. https://doi.org/10.1016/j.gtc.2016.09.007 Fukui, H., Xu, X., & Miwa, H. (2018). Papel del eje microbiota intestinal-hormona intestinal en la fisiopatología de los trastornos gastrointestinales funcionales. Revista de neurogastroenterología y motilidad. https://doi.org/10.5056/jnm18071 Kadry, H., Noorani, B., & Cucullo, L. (2020). Una visión general de la barrera hematoencefálica sobre la estructura, la función, el deterioro y los biomarcadores de integridad. Fluidos y barreras del SNC. https://doi.org/10.1186/s12987-020-00230-3 Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P. y Bohórquez, D. V. (2020). Células de neurópodos: La biología emergente de la transducción sensorial intestino-cerebro. Revisión anual de la neurociencia. https://doi.org/10.1146/annurev-neuro-091619-022657 Kaelberer, M. M., Buchanan, K. L., Klein, M. E., Barth, B. B., Montoya, M. M., Shen, X., & Bohórquez, D. V. (2018). Un circuito neuronal intestino-cerebro para la transducción sensorial de nutrientes. Ciencia. https://doi.org/10.1126/science.aat5236 Latorre, R., Sternini, C., De Giorgio, R., & Greenwood-Van Meerveld, B. (2016). Células enteroendocrinas: una revisión de su papel en la comunicación cerebro-intestino. Neurogastroenterología y motilidad : revista oficial de la Sociedad Europea de Motilidad Gastrointestinal. https://doi.org/10.1111/nmo.12754 Lee, D. H., & Linker, R. A. (2012). El papel de la glicoproteína oligodendrocitos de mielina en la desmielinización autoinmune: ¿un objetivo para la terapia de la esclerosis múltiple? . Opinión de expertos sobre dianas terapéuticas. https://doi.org/10.1517/14728222.2012.677438 Lee, J. Y., Tuazon, J. P., Corey, S., Bonsack, B., Acosta, S., Ehrhart, J., Sanberg, P. R., & Borlongan, C. V. (2019). A Gutsy Move for Cell-Based Regenerative Medicine in Parkinson’s Disease: Targeting the Gut Microbiome to Sequester Inflammation and Neurotoxicity. Revisiones e informes sobre células madre. https://doi.org/10.1007/s12015-019-09906-2 Liddle R. A. (2019). Neurópodos. Gastroenterología celular y molecular y hepatología. https://doi.org/10.1016/j.jcmgh.2019.01.006 Mosher, K. I., & Wyss-Coray, T. (2015). Vaya con su intestino: la microbiota se encuentra con la microglía. Neurociencia de la naturaleza. https://doi.org/10.1038/nn.4051 Rao, M., & Gershon, M. D. (2016). El intestino y más allá: el sistema nervioso entérico en los trastornos neurológicos. Reseñas de naturaleza. Gastroenterología y hepatología. https://doi.org/10.1038/nrgastro.2016.107 Sampson, T. R., & Mazmanian, S. K. (2015). Control del desarrollo, la función y el comportamiento del cerebro por el microbioma. Huésped celular y microbio. https://doi.org/10.1016/j.chom.2015.04.011 Sharon, G., Sampson, T. R., Geschwind, D. H. y Mazmanian, S. K. (2016). El sistema nervioso central y el microbioma intestinal. Celda. https://doi.org/10.1016/j.cell.2016.10.027 Simpson, D., & Oliver, P. L. (2020). Generación de ROS en microglía: comprensión del estrés oxidativo y la inflamación en enfermedades neurodegenerativas. Antioxidantes (Basilea, Suiza).. https://doi.org/10.3390/antiox9080743 Stadelmann, C., Timmler, S., Barrantes-Freer, A., & Simons, M. (2019). Mielina en el sistema nervioso central: estructura, función y patología. Revisiones fisiológicas. https://doi.org/10.1152/physrev.00031.2018 Veremeyko, T., Yung, A., Dukhinova, M., Strekalova, T., & Ponomarev, E. D. (2019). El papel de los factores neuronales en la reprogramación epigenética de la microglía en el sistema nervioso central normal y enfermo. Fronteras en neurociencia celular. https://doi.org/10.3389/fncel.2019.00453 Xu, L., He, D., & Bai, Y. (2016). Inflamación mediada por microglía y enfermedad neurodegenerativa. Neurobiología molecular. https://doi.org/10.1007/s12035-015-9593-4 Zheng, S. H., Yan, C. Y., Duan, N., Wang, W., & Mei, X. P. (2019). El clorhidrato de penehyclidina suprimió el dolor neuropático inducido por la lesión del nervio periférico al inhibir la activación de la vía microglial MAPK / p-p38 / IL-1β. Dolor molecular, 15, 1744806919858260. https://doi.org/10.1177/1744806919858260 |