LAS VACUNAS DE ARN
UN GRAN AVANCE EN INMUNOLOGIA
Vacunas de ARN mensajero, son aquellas que en las que se emplea ácido ribonucleico para lograr el desarrollo de una respuesta inmune. Se diferencian de las vacunas tradicionales en que no se administran agentes vivos atenuados ni fragmentos del mismo, por lo que no existe el peligro de provocar la enfermedad que se pretende prevenir. Para fabricarlas es preciso encontrar las secuencias de ADN que codifican antígenos esenciales del agente infeccioso y después transcribirlo para obtener el ARN correspondiente, el cual se usará como vacuna. Aunque existen diferentes tipos de ARN, en las vacunas se utiliza ARN mensajero. Una vez administrada, parte del ARN puede degradarse por acción de las ARNasas, pero la porción que entra en las células genera péptidos similares a los del agente patógeno, lo que provoca una respuesta inmune que protege de la infección. 1 2 3 4 5
Este proceder es revolucionario y puede ser aplicado y varias enfermedades autoinmunes.
Posiblemente no fue puesto en marcha, hasta que se conoció mejor, la producción desde el ARN, de anticuerpos específicos, sin peligrosidad de enfermedad, ni perdida de inmunidad
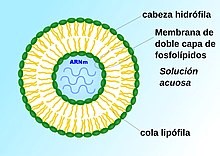
Liposoma cargado de ARN mensajero.
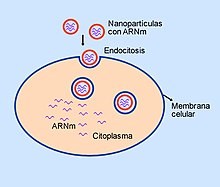
Microesferas de lípidos (liposomas) cargadas de ARNm penetran en la célula por un proceso de endocitosis.
Esquema general del proceso de traducción genética mediante el cual se sintetiza una proteína a partir del ARN mensajero (mRNA).
Las vacunas tradicionales contienen el agente infeccioso inactivado o fragmentos del mismo que al introducirse en el cuerpo provocan una respuesta inmune por parte del organismo, el cual de esta forma responde con gran rapidez y eficacia cuando sufre una infección verdadera por el microorganismo específico para el que está diseñada la vacuna. Sin embargo las vacunas de ARN consisten en una secuencia de ácido nucleico que introduce en la célula el código para que la maquinaria celular fabrique la proteína extraña del agente infeccioso, la cual posteriormente es presentada en la membrana celular y reconocida por el sistema inmune, que genera inmunidad contra el mismo; por lo tanto puede decirse que no introduce el antígeno, sino las instrucciones para fabricarlo. 6
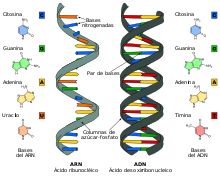
El ARN mensajero o ARNm es el ácido ribonucleico que transfiere el código genético desde el ADN a los ribosomas en el citoplasma de una célula. Actúa por tanto como plantilla o patrón para la síntesis de una proteína. Se trata de un ácido nucleico de cadena única (monocatenario), a diferencia del ADN, que tiene dos cadenas enlazadas (bicatenario). Las vacunas de ARN mensajero están formadas por cadenas de esta molécula que codifican un antígeno específico de un patógeno. Cuando el ARNm entra en la célula, el ribosoma sintetiza la proteína codificada que corresponde a un antígeno del patógeno, el cual posteriormente se presenta en la superficie de la célula, donde es reconocido por las células del sistema inmune, generando inmunidad.
Para evitar la rápida degradación de la molécula antes de entrar a la célula, se utilizan varias estrategias, una de ellas emplea microesferas de lípidos (liposomas) en cuyo interior se encuentra el ARN, que de esta forma entra en la célula con facilidad por un proceso de endocitosis. La idea de encapsular ARNm en nanopartículas lipídicas ha resultado atractiva por varias razones. El recubrimiento de lípidos proporciona una capa de protección que evita la rápida degradación, lo que hace posible un proceso de traducción genética para formación de proteínas más eficiente. Además, la capa externa de lípidos puede modificarse, lo que permite que se una a las células deseadas a través de interacciones de ligandos. Las nanopartículas pueden administrarse al organismo a través de diferentes rutas, por ejemplo por vía intravenosa o por inyección intramuscular.
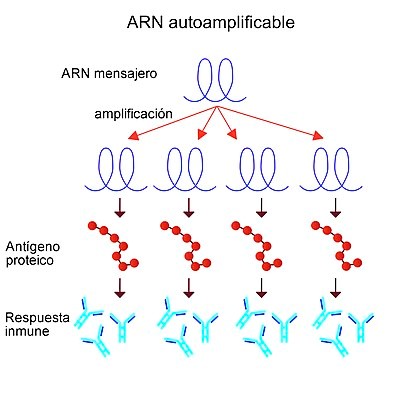
Determinadas vacunas utilizan ARN autoampliflicable (replicón)Nota 1, es decir, el ARN introducido se multiplica por sí mismo en el interior de la célula, lo que hace que se genere una cantidad muy superior del antígeno contra el que se pretende crear inmunidad. Esta técnica no pueden producir agentes infecciosos activos porque se ha eliminado el gen de la proteína estructural del virus y este no puede formarse completo ni propagarse a las células adyacentes.789
Una de las particularidades de las vacunas de ARN es que desencadenan la respuesta inmune mediante varios mecanismos. Estimulan la formación de anticuerpos y reclutan linfocitos T citotóxicos mediante la unión de la proteína virica producida en los ribosomas al complejo mayor de histocompatibilidad tipo I (MHC). Este doble mecanismo no tiene lugar con otros tipos de vacunas.
Mecanismo de acción de las vacunas de ARN e interacción con el complejo mayor de histocompatibilidad (MHC)
Las vacunas de ARN son menos estables que otros tipos de vacunas y pueden ser degradadas fácilmente por el calor. Por ello deben conservarse congeladas o a temperaturas muy bajas, lo que representa un inconveniente para el proceso de distribución. 2
Las ventajes potenciales de las vacunas de ARN son:
- Seguridad. No se inoculan microorganismos vivos ni atenuados, por lo que no existe la posibilidad de provocar una infección.3
- El ARN no se integra en el genoma del hospedador, que está formado por ADN, por lo que no existe la posibilidad de alterar el genoma. 3
- El ARN se degrada con relativa rapidez, lo que podría evitar la aparición de efectos secundarios a largo plazo. 3
- El proceso de producción puede ser rápido y más estandarizado que en las vacunas tradicionales, lo que facilitaría una rápida respuesta ante la aparición de nuevos agentes infecciosos.3
Se han realizado ensayos clínicos con vacunas ARN desarrolladas para evitar la aparición de diferentes enfermedades infecciosas causadas por virus, entre otras las provocadas por el virus de la gripe, virus de la rabia, citomegalovirus, VIH, virus Zika y SARS-CoV-2.10
Virus de la gripe 22
Virus de la rabia] .23
Citomegalovirus.24
Cáncer Las vacunas de ARN contra el cáncer no son preventivas, están diseñadas para el tratamiento de personas que ya están diagnósticadas de esta enfermedad e intentan potenciar el sistema inmunológico para que destruya las células malignas del tumor. 25 26
Los primeros estudios sobre la eficacia de vacunas de ARNm fueron realizados por Woff en 1990. Posteriormente se desarrollaron dos formas: vacunas de ARNm convencional y vacunas de ARNm autorreplicativo. Los trabajos iniciales no alcanzaron resultados prácticos por la fragilidad de la molécula de ARN y su inactivación por endonucleasas, sin embargo con el tiempo se han desarrollado métodos que aumentan la estabilidad del ARNm y permiten su producción sintética en el laboratorio a partir de plásmidos de ADN, mediante una transcripción enzimática y ARN polimerasa, sin que sean precisos cultivos celulares.27
- .
Referencias]
- ↑ Vacunas de ARN: la más prometedora generación de vacunas. Autor: María Coronada García Hidalgo. MoleQla, revista de Ciencias de la Universidad Pablo de Olavide. Número 26, 2017. Consultado el 20 de noviembre de 2020.
- ↑ Saltar a:a b Vacunas de ADN o ARN contra el nuevo coronavirus. Schmidt C. Investigación y Ciencia, junio 2020. Consultado el 20 de noviembre de 2020.
- ↑ Saltar a:a b c d e f RNA vaccines: an introduction, phg foundation, 2018. Autor: Laura Blackburn. Consultado el 20 de noviembre de 2020.
- ↑ Verbeke, Rein; Lentacker, Ine; De Smedt, Stefaan C.; Dewitte, Heleen (octubre de 2019). «Three decades of messenger RNA vaccine development». Nano Today 28: 100766. doi:10.1016/j.nantod.2019.100766.
- ↑ Saltar a:a b mRNA vaccines — a new era in vaccinology. Autores: Pardi, N., Hogan, M., Porter, F. et al. Nat Rev Drug Discov 17, 261–279 (2018).
- ↑ Advances in mRNA Vaccines for Infectious Diseases. Front. Immunol., publicado el 27 de marzo de 2019.
- ↑ Luis Enjuanes: «Nuestra vacuna será más potente«. Libertad Digital, publicado el 21 de noviembre de 2020
- ↑ Amplifying RNA Vaccine Development. N Engl J Med 2020; 382:2469-2471
- ↑ Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses. Molecular Therapy. Volumen 26, ISSUE 2, P446-455, 7 de febrero de 2018.
- ↑ Development of a potent Zika virus vaccine using self-amplifying messenger RNA. Science Advances 07 agosto 2020: Vol. 6, no. 32. Consultado el 20 de noviembre de 2020.
- ↑ Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. Lancet, 2017 Sep 23; 390(10101): 1511-1520.
- ↑ An RNA nanoparticle vaccine against Zika virus elicits antibody and CD8+ T cell responses in a mouse model. Sci Rep. 2017 Mar 21;7(1):252. VV.AA. Consultado el 22 de noviembre de 2020.
- ↑ «Safety, Tolerability, and Immunogenicity of mRNA-1325 in Healthy Adult Subjects – Full Text View – ClinicalTrials.gov» (en inglés).
- ↑ Saltar a:a b Fernandez, E; Diamond, MS (19 April 2017). «Vaccination strategies against Zika virus». Current Opinion in Virology 23: 59-67. PMC 5576498. PMID 28432975. doi:10.1016/j.coviro.2017.03.006.
- ↑ Pfizer and BioNTech Achieve First Authorization in the World for a Vaccine to Combat COVID-19. Drugs.com, consultado el 3 de diciembre de 2020
- ↑ Canadá aprueba la vacuna de Pfizer contra la Covid-19. Diario de Mallorca, publicado el 9 de diciembre de 2020.
- ↑ La EMA autoriza la vacuna de Pfizer. La Vanguardia, publicado el 21 de diciembre de 2020.
- ↑ «FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine». U.S. Food and Drug Administration (FDA). Consultado el 18 December 2020.
- ↑ Agencia SINC (7 de enero de 2021). «La Comisión Europea autoriza el uso de la vacuna de Moderna». Agencia SINC. Consultado el 7 de enero de 2021.
- ↑ «Vaccine Development, Testing, and Regulation — History of Vaccines». www.historyofvaccines.org. Consultado el 28 de enero de 2016.
- ↑ «Zika virus: US scientists say vaccine ’10 years away’ – BBC News». BBC News (en inglés británico). Consultado el 28 de enero de 201628 de enero de 2016.
- ↑ Una vacuna contra la gripe elaborada a partir del ARN. CORDIS. Resultados de investigación en la UE. Consultado el 9 de diciembre de 2020
- ↑ Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies. Autores: Nicole Armbruster, Edith Jasny, Benjamin Petsch. Vaccines (Basel). Diciembre 2019 ; 7(4): 132. Publicado el 27 de septiembre de 2019. PMID: 31569785
- ↑ Laboratorio Moderna. Consultado el 13 de diciembre de 2020.
- ↑ Cancer Treatment Vaccines. National Cancer Institute, consultado el 5 de diciembre de 2020.
- ↑ Vaccine Strategy in Melanoma. Surg Oncol Clin N Am. Julio 2019; 28(3): 337–351.
- ↑ Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, et al. Direct gene transfer into mouse muscle in vivo. Science. (1990) 247:1465–8.
- ↑ Replicones: moléculas de ARN con capacidad para replicarse pero no para propagarse de una célula a otra.