SISTEMA GLINFÁTICO
El sistema glinfático (o vía de limpieza glinfática) es una vía de limpieza de desechos del sistema nervioso central (SNC) de los organismos mamíferos. Aunque el sistema linfático es responsable de eliminar proteínas extracelulares, exceso de fluido y productos de desecho del metabolismo del tejido periférico, curiosamente, el cerebro y la médula espinal carecen de vasculatura linfática. El sistema glinfático es la razón por la que el tejido nervioso del SNC funciona en ausencia de la circulación linfática convencional. Esta vía consiste en una ruta periarterial de entrada para el líquido cefalorraquídeo a la parénquima cerebral, acoplada a un mecanismo de limpieza para la eliminación del líquido intersticial y solutos extracelulares de los compartimentos intersticiales del cerebro y la médula espinal. El intercambio de solutos entre el líquido cefalorraquídeo y el líquido intersticial es impulsado por el pulso arterial y regulado durante el sueño por la expansión y contracción del espacio extracelular del cerebro. La limpieza de proteínas solubles, productos de desecho, y el exceso de fluido extracelular se logra a través flujo convectivo del líquido intersticial, facilitado por los canales de agua de la acuaporina 4 (AQP4) astrocítica.
El término de sistema glinfático fue acuñado por la neurocientífica danesa Maiken Nedergaard dada la dependencia del sistema en las células gliales y por su papel en funciones linfáticas en el SNC.1
Descripción sobre el fluido cefalorraquídeo
Aunque las primeras observaciones sobre el líquido cefalorraquídeo se remontan a Hipócrates (460 – 375 a. C.) y más tarde a Galeno (130 – 200), su descubrimiento se le atribuye a Emanuel Swedenborg (1688 – 1772), que, siendo un religioso devoto, descubrió el líquido cefalorraquídeo mientras buscaba la «silla del alma».2 Los 16 siglos de anatomistas que sucedió a Hipócrates y Galeno pudo haber pasado por alto el líquido cefalorraquídeo dado a las técnicas prevalente en la autopsia de su tiempo. Estas incluían la amputación de la cabeza y el drenado de la sangre antes de la disección del cerebro.2 Aunque el trabajo de Swedenborg, traducido, no fue publicado sino hasta 1887 dada su falta de reconocimiento como médico, pudo haber hecho también la primera relación entre el líquido cefalorraquídeo y el sistema linfático. Su descripción del líquido cefalorraquídeo fue «la línfa espiritual».2
Ausencia de conductos linfáticos en el sistema nervioso central
En los órganos periféricos, el sistema linfático desempeña una papel importante en las funciones del sistema inmune y se encuentra y funciona en paralelo con el sistema circulatorio para proporcionar una segunda vía de circulación que transporta el exceso de líquido intersticial, proteínas y desechos del metabolismo del tejido sistémico de regreso a la sangre. La eliminación eficiente de proteínas solubles del líquido intersticial es crítica para la regulación tanto de la presión osmótica coloidal como de la regulación homeostática del volumen de fluido en el cuerpo. La importancia del flujo linfático es especialmente evidente cuando el sistema linfático se obstruye. En enfermedades asociadas con el sistema linfático, tal como la elefantiasis, donde los parásitos que ocupan los conductos linfáticos impiden el flujo de la línfa, el impacto de dicha obstrucción es dramático. El edema crónico resultante se debe a la suspensión de la limpieza linfática y la acumulación de solutos intersticiales. Paradójicamente, el sistema linfático no se extiende al cerebro y la médula espinal a pesar de la gran actividad metabólica del tejido nervioso y su gran sensibilidad a los cambios en el entorno extracelular, incluyendo la acumulación de productos de desecho del metabolismo. Esta ausencia de conductos linfático ha llevado a los científicos a creer que existe un proceso alternativo, el cual se encarga de esta función linfática crítica.
Hipótesis de la difusión
Por más de un siglo la hipótesis más aceptada era que el flujo de líquido cefalorraquídeo, el cual rodea pero no se encuentra en contacto directamente con la parénquima del sistema nervioso central, podía realizar las funciones que el sistema linfático realizaba en la periferia y desempeñar un papel importante en la limpieza de solutos extracelulares. La mayor parte del líquido cefalorraquídeo se genera en los plexos coroideos y fluye a través de una ruta diferente: moviéndose a través del sistema ventricular cerebral, hacia el espacio subaracnoideo que rodea al cerebro, para después drenarse hacia la circulación sanguínea sistémica por medio de la granulación aracnoidea de los senos venosos durales o hacia los conductos periféricos linfáticos a lo largo de las vainas de los nervios craneales.34 Muchos investigadores han sugerido que el compartimento del líquido cefalorraquídeo constituye una especie de drenaje para el soluto intersticial y la limpieza de fluido de la parénquima cerebral. Sin embargo, las distancias entre el líquido intersticial y el líquido cefalorraquídeo en los ventrículos y el espacio subaracnoideo son demasiado grandes para la eliminación eficiente de macromoléculas intersticiales y desechos por difusión simple únicamente. Helene Cserr en la Universidad de Brown calculó que el promedio de los tiempos de difusión para moléculas grandes tal como la albumina excedería las 100 horas para atravesar 1cm de tejido nervioso,5 una velocidad que no es compatible con la intensa demanda metabólica del tejido cerebral. Un sistema de limpieza basado en difusión sencilla, además, tendría falta de sensibilidad para responder rápidamente a cambios en las condiciones homeostáticas.
Determinantes clave de la difusión a través de los espacios intersticiales cerebrales son las dimensiones y composición del compartimento extracelular. En una serie de experimentos elegantemente diseñados en los años 1980 – 1990, C. Nicholson y sus colegas en la Universidad de Nueva York exploraron el microentorno del espacio extracelular usando micropipetas selectivas de iones y fuentes de puntos iontoforéticos (iontophoretic point sources en inglés). Usando estas técnicas, Nicholson demostró que el movimiento de los solutos y el agua a través de la parénquima cerebral disminuye su velocidad a medida que la fracción de volumen extracelular disminuye y se vuelve más tortuoso.6
Como una explicación alternativa a la difusión, Cserr y sus colegas propusieron que el flujo convectivo de material del líquido intersticial de la parénquima cerebral al líquido cefalorraquídeo era responsable por la limpieza eficiente de desechos.5
Progreso en el campo de la dinámica de fluido cefalorraquídeo
Experimentos realizados en la Universidad de Maryland en los años de 1980 por Patricia Grady y sus colegas postularon la existencia del intercambio de solutos entre el líquido intersticial de la parénquima cerebral y el líquido cefalorraquídeo por medio de espacios paravasculares. En 1985, Grady y sus colegas sugirieron que el líquido cefalorraquídeo y el líquido intersticial intercambiaban por medio de vías anatómicas específicas dentro del cerebro, con el líquido cefalorraquídeo moviéndose a través del cerebro junto con los vasos sanguíneos exteriores. El grupo de Grady sugirió que estos «canales paravasculares» eran funcionalmente análogos a los conductos linfáticos periféricos, facilitando la limpieza de desechos intersticiales del cerebro.78 Sin embargo, otros laboratorios no observaron un intercambio paravascular tan vasto entre el líquido cefalorraquídeo y el líquido intersticial.591011
La conexión entre el líquido intersticial del cerebro y el líquido cefalorraquídeo fue confirmada por H Cserr y sus colegas de la Universidad de Brown y el King’s College de Londres.11 El mismo grupo postuló que los solutos intersticiales en la parénquima cerebral se intercambiaban con el líquido cefalorraquídeo por medio de un mecanismo de flujo a granel, en vez de por medio de difusión. Sin embargo, otro trabajo de este mismo laboratorio demostró que el intercambio entre el líquido cefalorraquídeo y el líquido intersticial era inconsistente y mínimo, contradiciendo los hallazgos de Grady y sus colegas.910
Modelo actual de limpieza de todos los órganos
Aspectos clave
En un estudio publicado en 2012,12 un grupo de investigadores de la Universidad de Rochester encabezados por M. Nedergaard, usó in vivo la técnica de imagen de excitación de dos fotones de marcadores fluorescentes pequeños para monitorear el flujo de líquido cefalorraquídeo aracnoideo dentro y a través de la parénquima cerebral. La microscopía de excitación de dos fotones permitió al grupo de Rochester visualizar el flujo de líquido cefalorraquídeo en tiempo real de ratones vivos sin necesidad de perforar el compartimento del líquido cefalorraquídeo (la técnica fue realizada a través de una ventana craneal pequeña). De acuerdo a los hallazgos del estudio, el líquido cefalorraquídeo subaracnoideo entra rápidamente al cerebro, a lo largo de los espacios paravasculares rodeando así las arterias penetrantes. Después intercambia con el entorno del líquido intersticial.12 De manera semejante, el fluido intersticial es removido de la parénquima cerebral por medio de los espacios paravasculares que rodean las grandes venas de drenaje.
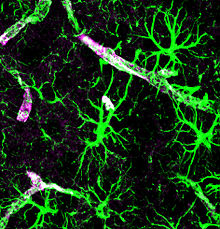
Astrocytes stained for GFAP (green) and aquaporin-4 (purple)
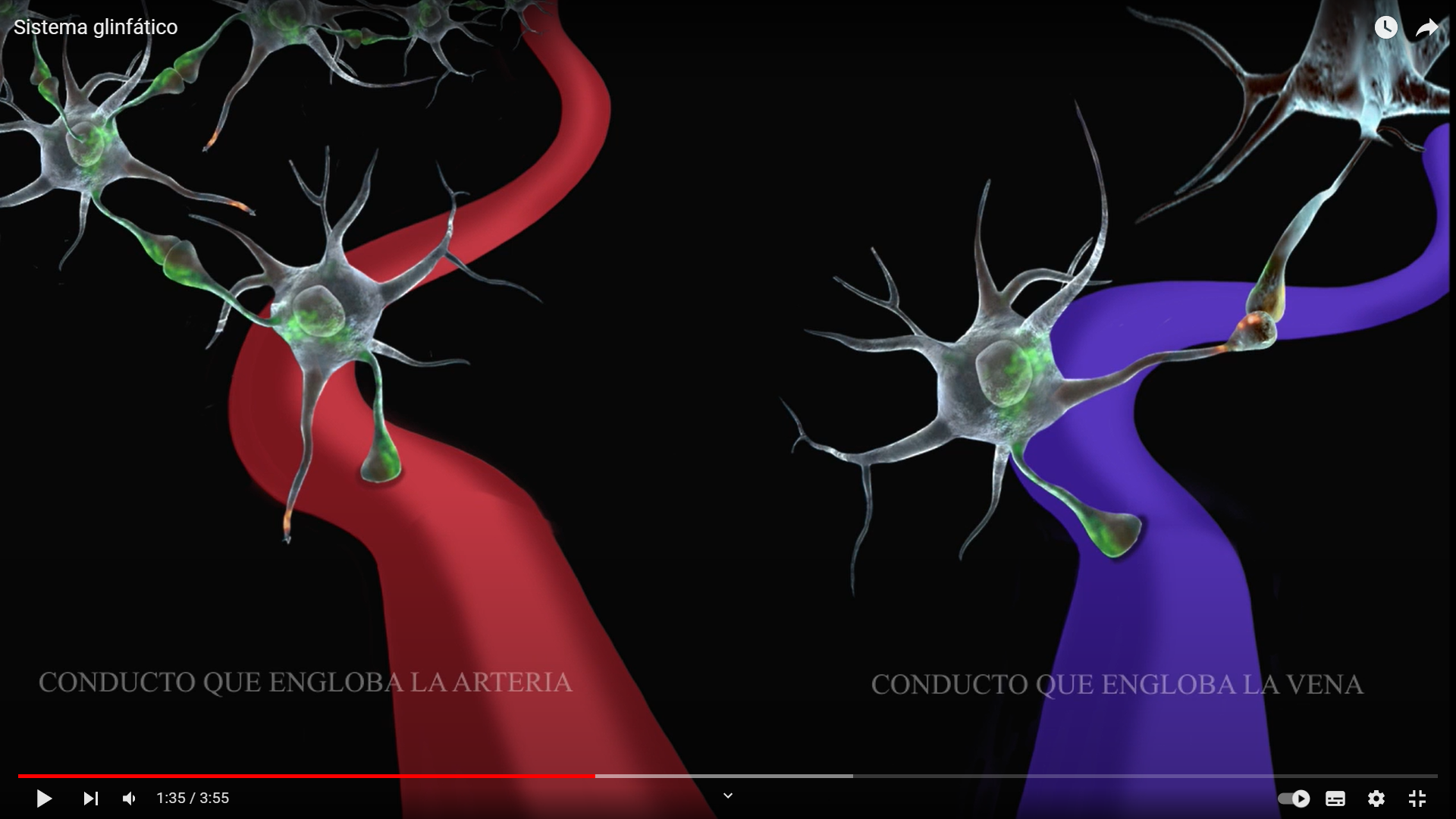
Los espacios paravasculares son canales repletos con líquido cefalorraquídeo formados entre los vasos sanguíneos y las vainas leptomeníngeas que rodean los vasos de la superficie cerebral y los vasos penetrantes vecinos. Alrededor de estos vasos penetrantes, los espacios paravasculares toman la forma de espacios de Virchow-Robin. Donde terminan los espacios de Virchow-Robin, dentro de la parénquima cerebral, el líquido cefalorraquídeo paravascular puede continuar viajando a lo largo de las membranas basales que rodean músculo liso arterial vascular para alcanzar la lámina basal que rodean los capilares del cerebro. El movimiento del líquido cefalorraquídeo a lo largo de estas vías paravasculares es rápido y se ha sospechado que el pulso arterial es una fuerza importante para el movimiento del fluido paravascular.7 En un estudio publicado en 2013, J. Iliff y sus colegas demostraron esto directamente. Usando microscopía de excitación de dos fotones in vivo, los autores reportaron que cuando el pulso arterial cerebral disminuía o se incrementaba, la velocidad de flujo de líquido cefalorraquídeo paravascular incrementaba o diminuía respectivamente.
Los astrocitos generan una interfaz en la sinapsis neuronal, así como proyecciones conocidas como «end-feet» que recubren completamente la vasculatura del cerebro. Aunque el mecanismo completo no ha sido comprendido en su totalidad, los astrocitos son conocidos por facilitar los cambios en el flujo sanguíneo1314 y se cree que desempeñan un papel en la eliminación de desechos en el cerebro.15
Los investigadores saben desde hace tiempo que los astrocitos expresan canales de agua llamados acuaporinas.16 Sin embargo, hasta hace poco no se había identificado una función fisiológica que explicara el porqué de su presencia en astrocitos del SNC de mamíferos. Las acuaporinas son proteínas de membrana que desempeñan un papel crítico en la regulación del flujo de agua hacia fuera y dentro de la célula. Relativo a la difusión simple, la presencia de acuaporinas en las membranas de células incrementaba de 3 a 10 veces la permeabilidad para la entrada y salida de agua.17
Dos tipos de acuaporinas son expresadas en el SNC: acuaporina-1, la cual la expresan células epiteliales especializadas de los plexos coroideos, y la acuaporina-4, la cual es expresada en astrocitos.1819
La expresión de acuaporina-4 en astrocitos está reservada a las prolongaciones pediculares o ‘end-feet’ (también conocidos como procesos pediculares) recubriendo las vasculatura cerebral. Hasta 50% de la superficie pedicular que se encuentra frente a la vasculatura está ocupada por arreglos ortogonales de acuaporina-4.1618
En 2012, se desmotró que la acuaporina-4 es esencial para el intercambio paravascular entre el líquido cefalorraquídeo y el líquido intersticial. Análisis de ratones modificados genéticamente que carecían del gen de la acuaporina-4 revelaron que la limpieza de solutos intersticials dependiente de flujo a granel disminuyó un 70% en la ausencia de acuaporina-4. Basados en este papel del transporte de agua dependiente de acuaporina-4 en el proceso de limpieza paravascular de solutos intersticiales, Iliff y Nedergaard le dieron nombre a esta vía gliovascular de todo el cerebro como «sistema glinfático».
Funciones fisiológicas[editar]
Aumento de la eliminación de desechos durante el sueño[editar]
Una publicación por L. Xie y sus colegas en 2013 exploró la eficiencia del sistema glinfático durante la fase de sueño lento y proporcionaron la primera evidencia directa de la limpieza intersticial de productos de desecho durante el periodo de descanso. Usando una combinación de la técnica de difusión iontforética de Nicholson y sus colegas, imagen de excitación de dos fotones in vivo, y electroencefalografía para confirmar los estados de alerta y sueño, Xia y Nedergaard demostraron que los cambios en la eficiencia del intercambio entre el líquido cefalorraquídeo y el líquido intersticial entre el cerebro alerta y dormido eran causados por la expansión y contracción del espacio extracelular, el cual aumentaba un 60% en el cerebro dormido para promover la limpieza de desechos intersticiales tales como los beta amiloides.20 Sobre la base de estos hallazgos, formularon la hipótesis de las propiedades restauradoras del sueño pueden estar ligadas al incremento de limpieza glinfática de los desechos del metabolismo producidos por la actividad neuronal del cerebro en estado de alerta.
Transporte de lípidos[editar]
Otra función clave del sistema glinfático fue documentada por Thrane et al., quien, en 2013, demostró que el sistema de vías paravasculares del cerebro juegan un papel importante en el transporte de moléculas lipofílicas pequeñas.21 Dirigidos por M. Nedergaard, Thane y sus colegas también demostraron que el transporte paravascular de lípidos a través de la vía glinfática activaba la señalización de calcio en células gliales y que la despresurización de la cavidad craneal, y por lo tanto la deficiencia de la circulación glinfática, llevaba a difusión no selectiva de lípidos, acumulación intracelular de lípidos y señalización patológica entre astrocitos. Aunque se requieren experimentos adicionales para analizar la importancia fisiológica de la conexión entre la circulación glinfática, la señalización de calcio y el transporte paravascular de lípidos en el cerebro, los hallazgos llevan a creer que existe una función similar, en el SNC, a la capacidad de los conductos linfáticos de llevar lípidos al hígado.
Implicaciones en enfermedades neurodegenerativas[editar]
Patológicamente, las enfermedades neurodegenerativas tales como la esclerosis lateral amiotrófica, enfermedad de Alzheimer, enfermedad de Parkinson y la enfermedad de Huntington son caracterizadas por la pérdida progresiva de neuronas, deterioro cognitivo, discapacidad motriz y pérdida de los sentidos.2223 Colectivamente, estas enfermedades caen en la extensa categoría conocida como proteopatías, debido al ensamblaje de proteínas con un mal plegamiento o de agregados intracelulares o proteínas extracelulares. De acuerdo con la hipótesis prevalente de los amiloides para la enfermedad de Alzheimer, la acumulación de beta amiloides (un péptido normalmente producido en el cerebro y eliminado en cerebros saludables) en placas extracelulares lleva a pérdida de neuronas y atrófia cerebral, los cuales son sellos de la enfermedad de Alzheimer. Aunque no se conoce hasta qué punto está involucrado el sistema glinfático en la enfermedad de Alzheimer y otras enfermedades neurodegenerativas, los investigadores han demostrado a través de experimentos con ratones genéticamente modificados que el correcto funcionamiento del sistema de limpieza glinfático es necesario para la eliminación de beta amiloides solubles del cerebro.12 En ratones la falta del gen de acuaporina-4, reduce la eliminación de beta amiloides en un 55%.
El sistema glinfático también puede resultar dañado después de lesiones cerebrales como accidentes cerebrovasculares, hemorragia intracraneal o hemorragia subaracnoidea. En 2014, un grupo de investigadores del Instituto Francés de Investigación Médica y de Salud (INSERM) demostró por medio de imagen por resonancia magnética que el sistema glinfático fue dañado después de una hemorragia subaracnoidea, debido a la presencia de sangre coagulada in los espacios paravasculares.24 Interesantemente, la inyección de activador tisular del plasminógeno (un medicamento fibrolítico) en el líquido cefalorraquídeo mejoró el funcionamiento del sistema glinfático. En un estudio paralelo, también descubrieron que el sistema glinfático fue dañado después de un accidente cerebrovascular isquémico en el hemisferio isquémico. Aunque los fundamentos patofisiológicos de este fenómeno siguen sin ser claros.
Referencias
↑ Konnikova, Maria (11 de enero de 2014). «Goodnight. Sleep Clean.». The New York Times. Consultado el 18 de febrero de 2014. «She called it the glymphatic system, a nod to its dependence on glial cells ».
↑ Saltar a:a b c Hajdu, Steven (2003). «A Note from History: Discovery of the Cerebrospinal Fluid». Annals of Clinical and Laboratory Science 33 (3).
↑ Abbott NJ (2004). «Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology». Neurochem Int. 45 (4): 545-52. PMID 15186921. doi:10.1016/j.neuint.2003.11.006.
↑ Bradbury MW, Cserr HF, Westrop RJ (1981). «Drainage of cerebral interstitial fluid into deep cervical lymph of the rabbit». Am J Physiol. 240 (4): F329-36. PMID 7223890.
↑ Saltar a:a b c Cserr HF (1971). «Physiology of the choroid plexus». Physiol Rev. 51 (2): 273-311. PMID 4930496.
↑ C. Nicholson, J. M. Phillips (1981). «Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum». The Journal of Physiology 321 (1): 225-257. PMID 7338810. Consultado el 9 de diciembre de 2013.
↑ Saltar a:a b Rennels ML, Gregory TF, Blaumanis OR, Fujimoto K, Grady PA (1985). «Evidence for a ‘paravascular’ fluid circulation in the mammalian central nervous system, provided by the rapid distribution of tracer protein throughout the brain from the subarachnoid space». Brain Res. 326 (1): 47-63. PMID 3971148. doi:10.1016/0006-8993(85)91383-6.
↑ Rennels ML, Blaumanis OR, Grady PA (1990). «Rapid solute transport throughout the brain via paravascular fluid pathways». Adv Neurol. 52: 431-9. PMID 2396537.
↑ Saltar a:a b Pullen RG, DePasquale M, Cserr HF (1987). «Bulk flow of cerebrospinal fluid into brain in response to acute hyperosmolality». Am J Physiol. 253 (3 Pt 2): F538-45. PMID 3115117.
↑ Saltar a:a b Ichimura T, Fraser PA, Cserr HF (1991). «Distribution of extracellular tracers in perivascular spaces of the rat brain». Brain Res. 545 (1–2): 103-13. PMID 1713524. doi:10.1016/0006-8993(91)91275-6.
↑ Saltar a:a b Cserr HF, Cooper DN, Suri PK, Patlak CS (1981). «Efflux of radiolabeled polyethylene glycols and albumin from rat brain». Am J Physiol. 240 (4): F319-28. PMID 7223889.
↑ Saltar a:a b c Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, Benveniste H, Vates GE, Deane R, Goldman SA, Nagelhus EA, Nedergaard M (2012). «A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid β». Sci Trans Med 4 (147): 147ra111. PMC 3551275. PMID 22896675. doi:10.1126/scitranslmed.3003748.
↑ Takano T, Tian GF, Peng W, Lou N, Libionka W, Han X, Nedergaard M (2006). «Astrocyte-mediated control of cerebral blood flow». Nat Neurosci 9 (2): 260-7. PMID 16388306. doi:10.1038/nn1623.
↑ Schummers J, Yu H, Sur M (2008). «Tuned Responses of Astrocytes and Their Influence on Hemodynamic Signals in the Visual Cortex». Science 320 (5883): 1638-43. PMID 18566287. doi:10.1126/science.1156120.
↑ Yuhas, Daisy. «How the brain cleans itself». Scientific American.
↑ Saltar a:a b Amiry-Moghaddam M, Ottersen OP (2003). «The molecular basis of water transport in the brain». Nature Reviews Neuroscience 4 (12): 991-1001. PMID 14682361. doi:10.1038/nrn1252.
↑ Verkman AS, Mitra AK (2000). «Structure and function of aquaporin water channels». Am J Physiol Renal Physiol. 278 (1): F13-28. PMID 10644652.
↑ Saltar a:a b Verkman AS, Binder DK, Bloch O, Auguste K, Papadopoulos MC (2006). «Three distinct roles of aquaporin-4 in brain function revealed by knockout mice». Biochim Biophys Acta. 1758 (8): 1085-93. PMID 16564496. doi:10.1016/j.bbamem.2006.02.018.
↑ Yool AJ (2007). «Aquaporins: multiple roles in the central nervous system». Neuroscientist 13 (5): 470-85. PMID 17901256. doi:10.1177/1073858407303081.
↑ Lulu Xie, Hongyi Kang1, Qiwu Xu, Michael J. Chen, Yonghong Liao, Meenakshisundaram Thiyagarajan, John O’Donne, Daniel J. Christensen, Charles Nicholson, Jeffrey J. Iliff, Takahiro Takano, Rashid Deane, Maiken Nedergaard (2013). «Sleep Drives Metabolite Clearance from the Adult Brain». Science 342 (6156): 373-377. PMID 24136970. doi:10.1126/science.1241224. Consultado el 18 de octubre de 2013.
↑ Vinita Rangroo Thrane, Alexander S. Thrane, Benjamin A. Plog, Meenakshisundaram Thiyagarajan, Jeffrey J. Iliff, Rashid Deane, Erlend A. Nagelhus, Maiken Nedergaard (2013). «Paravascular microcirculation facilitates rapid lipid transport and astrocyte signaling in the brain». Scientific Reports 3 (2582). doi:10.1038/srep02582. Consultado el 9 de diciembre de 2013.
↑ Mehler MF, Gokhan S (2000). «Mechanisms underlying neural cell death in neurodegenerative diseases: alterations of a developmentally-mediated cellular rheostat». Trends Neurosci. 23 (12): 599-605. PMID 11137149. doi:10.1016/s0166-2236(00)01705-7.
↑ Narasimhan, Kalyani. «Quantifying motor neuron loss in ALS». Nature Neuroscience. Archivado desde el original el 20 de mayo de 2006.
↑ Gauberti, Gaberel. «Impaired Glymphatic Perfusion After Strokes Revealed by Contrast-Enhanced MRI: A New Target for Fibrinolysis?». Stroke.
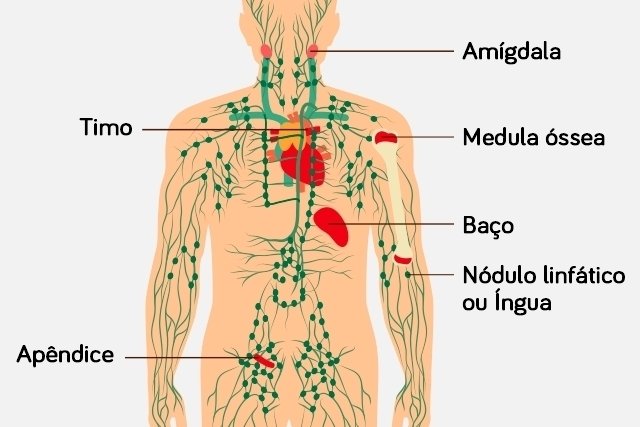 El sistema linfático es uno de los sistemas más importantes implicados en la eliminación de los desechos metabólicos producidos en el cuerpo no obstante los vasos de este sistema no llegan al cerebro por ello antes se pensaba que el cerebro no tenía la capacidad de eliminar sus propios desechos, pero para sorpresa de todos se ha descubierto que esto no es así
El sistema linfático es uno de los sistemas más importantes implicados en la eliminación de los desechos metabólicos producidos en el cuerpo no obstante los vasos de este sistema no llegan al cerebro por ello antes se pensaba que el cerebro no tenía la capacidad de eliminar sus propios desechos, pero para sorpresa de todos se ha descubierto que esto no es así







 Conocer la estructura de la proteína espiga del Sars-COV-2 fue fundamental para el desarrollo de la vacuna contra la COVID-19. Crédito: Andriy Onufriyenko
Conocer la estructura de la proteína espiga del Sars-COV-2 fue fundamental para el desarrollo de la vacuna contra la COVID-19. Crédito: Andriy Onufriyenko


 Michael Eisenstein
Michael Eisenstein
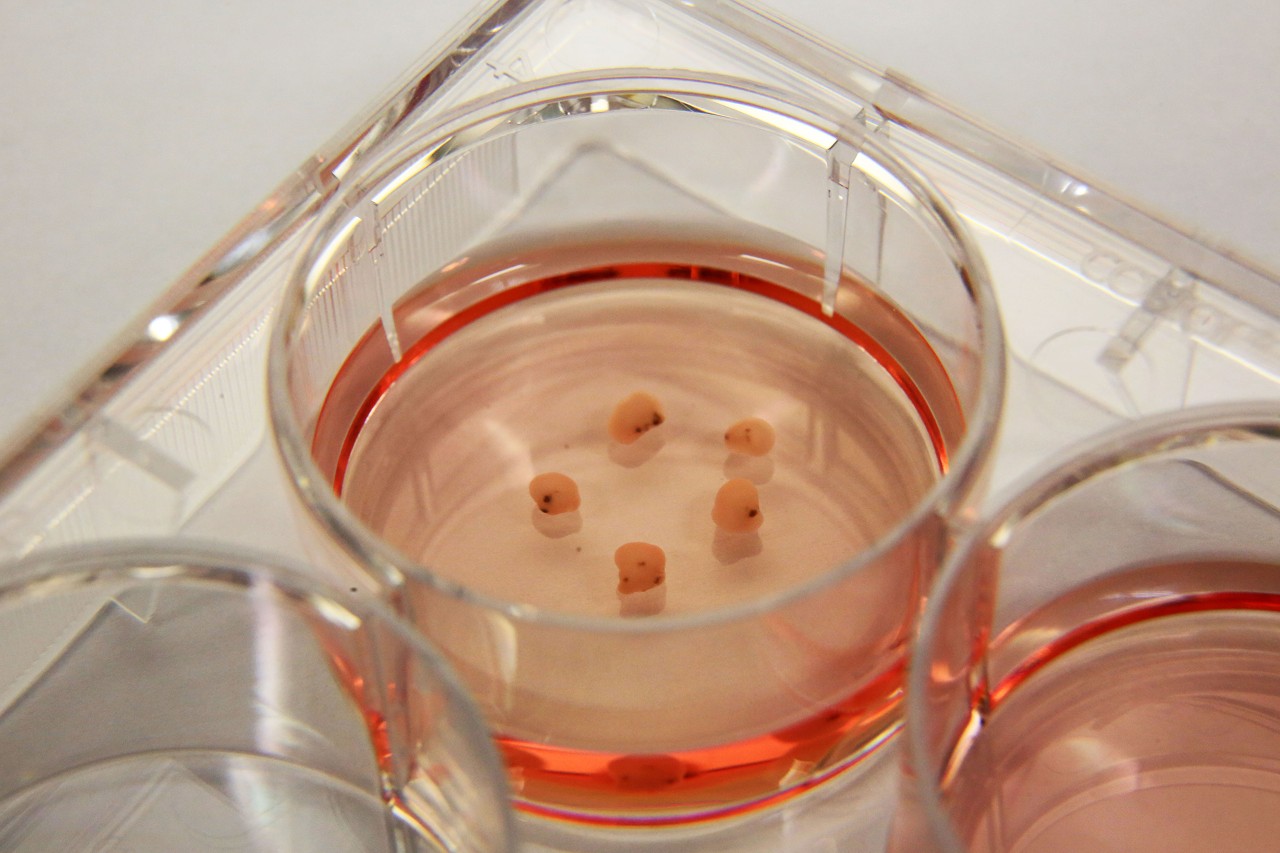
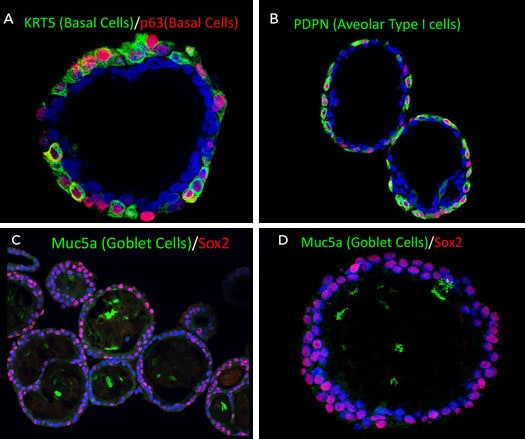
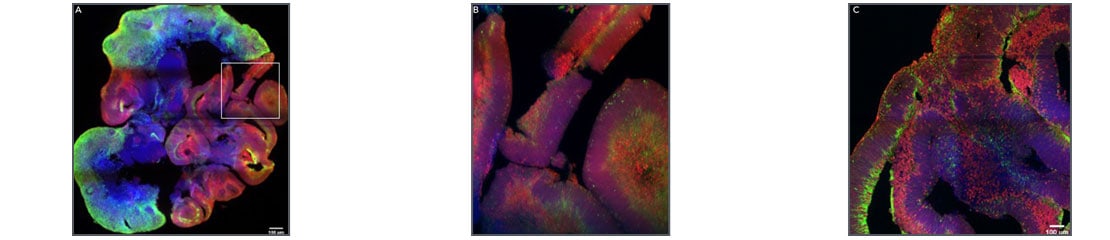 Cerebral Organoids Grown in Cultrex UltiMatrix RGF Basement Membrane Extracto de membrana de sótano Cultrex™ UltiMatrix RGF
Cerebral Organoids Grown in Cultrex UltiMatrix RGF Basement Membrane Extracto de membrana de sótano Cultrex™ UltiMatrix RGF