ALFA-SINUCLEÍNA Y CUERPOS DE LEWY
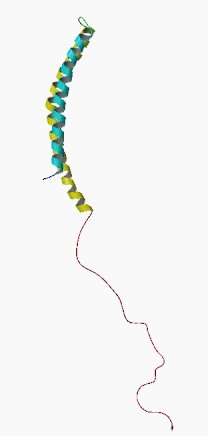
La α-sinucleína (alfa-sinucleína) es una proteína neuronal expresada con abundancia en el cerebro y, más concretamente, predomina en las terminaciones nerviosas presinápticas de este, constituyendo más del 1% del total de proteína del citosol de las células cerebrales.[1] Además, es el principal componente de los cuerpos de Lewy tanto en las formas esporádica como hereditaria de enfermedad de Parkinson y asimismo en la demencia de cuerpos de Lewy.
Cada vez mas se la considera artifice de enfermedades neurodegenerativas.
Se conoce como enfermedad neurodegenerativa a un grupo de enfermedades que agrupa a un género de desórdenes cognitivos, tales como, enfermedad de Alzheimer, de Parkinson, de Creutzfeldt-Jakob y esclerosis múltiple.[1]
Estos trastornos cognitivos se deben a un aumento en los procesos de muerte celular, reduciendo el número de neuronas y generando cambios en la conducta.[2][3]
La principal etiopatología es la neurodegeneración y se destacan las enfermedades asociadas al mal plegamiento proteico «missfolding diseases» que originaría la muerte neuronal exacerbada por alteraciones de proteínas claves en la función y arquitectura. estas enfermedades se asoan a causas tales como el alcoholismo, un tumor o un ataque cerebrovascular. También, pueden darse por toxinas, químicos y virus.
. 
Cuerpos de Lewy
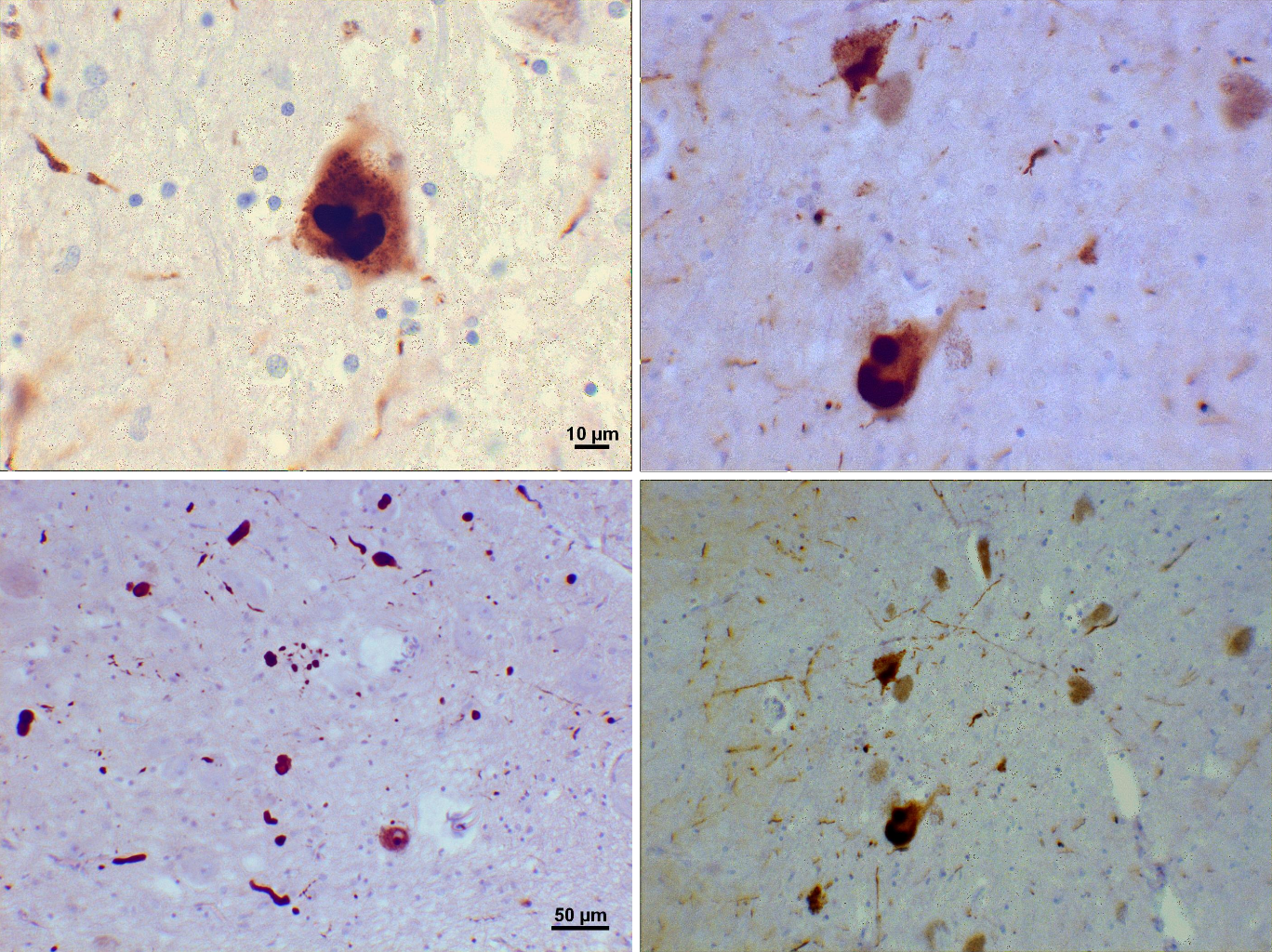
Las fotomicrografías de regiones de la sustancia negra de un paciente con Parkinson muestran cuerpos de Lewy y neuritas de Lewy en varios aumentos. Tinciones utilizadas: anticuerpo monoclonal de ratón anti-alfa-sinucleína; contratinción de hematoxilina de Mayer.
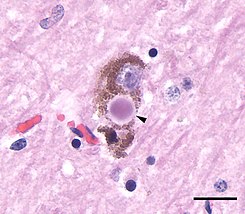
Los cuerpos de Lewy son agregados proteicos anormales que se desarrollan dentro de las células nerviosas y que contribuyen a la demencia asociada a la enfermedad de Parkinson, a la demencia con cuerpos de Lewy y a otros trastornos neurodegenerativos. También se observan en la atrofia multisistémica, especialmente en la de tipo parkinsoniano.[1]
Las fotomicrografías de regiones de la sustancia negra de este paciente con Parkinson muestran cuerpos de Lewy y neuritas de Lewy en varios aumentos. Los paneles superiores muestran imágenes a 60x de las inclusiones intraneuronales de alfa-sinucleína agregadas para formar cuerpos de Lewy. Los paneles inferiores son imágenes a 20x que muestran neuritas de Lewy en forma de filamentos y cuerpos de Lewy redondeados de varios tamaños. En el fondo se aprecian células de la sustancia negra cargadas de neuromelanina.
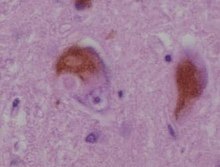
Cuerpos de Lewy. Tinciones utilizadas: anticuerpo monoclonal de ratón anti-alfa-sinucleína; contratinción de hematoxilina de Mayer.
Se identifican mediante el examen microscópico inmunohistoquímico del tejido nervioso afectado. Los cuerpos de Lewy se presentan como masas esféricas en el citoplasma que desplazan a otros componentes celulares. Por ejemplo, algunos cuerpos de Lewy tienden a desplazar el núcleo hacia un lado de la célula. Pueden encontrarse en el mesencéfalo (dentro de la sustancia negra) y también en la corteza cerebral. Por ello, existen dos variantes morfológicas: los cuerpos de Lewy clásicos y los corticales. Un cuerpo de Lewy clásico es una inclusión citoplasmática eosinofílica formada por un núcleo denso rodeado por un halo fibrilar radial de 10 nm, cuyo principal componente estructural es la alfa-sinucleína. Un cuerpo de Lewy cortical, en cambio, está menos definido y carece de halo, pero también está compuesto por fibrillas de alfa-sinucleína. Esta variante de cuerpo de Lewy es una de las ya citadas que desplaza con frecuencia al núcleo.
En el campo de la histopatología, los cuerpos de Lewy corticales son un rasgo distintivo de la demencia con cuerpos de Lewy (DCL), pero en ocasiones se pueden ver en las neuronas abombadas características de la enfermedad de Pick y la degeneración corticobasal,[2] así como en pacientes con otras tauopatías.[3]
La α-sinucleína se identificó por primera vez en el órgano eléctrico del pez Torpedo Californica usando anticuerpos en vesículas colinérgicas purificadas y, concretamente, en las membranas nucleares (Maroteaux et al. 1988). Así, la denominaron proteína Sinucleína por su presencia en las vesículas sinápticas («sin») y en la membrana nuclear («nucleína»). En estudios posteriores se confirmó la presencia de la α-sinucleína en los núcleos (Gonçalves and Outeiro, 2013, McLean et al., 2000) More et al., 2002).[2] Esta forma parte de la familia de las sinucleínas; está formada por la α-sinucleína, la β-sinucleína (identificada en las terminaciones presinápticas nerviosas del cerebro de vaca y de rata)(Nakajo et al. 1990; Tobe et al. 1992) y la γ-sinucleína, identificada primeramente como BCSGC1 en cáncer metastásico de mama (Ji et al. 1997).[3]
La alfa-sinucleína (a-syn) es una pequeña proteína intracelular que en los seres humanos es codificada por el gen SNCA, gen situado en la posición 21 del brazo largo del cromosoma 4. Esta proteína tiene un peso molecular de 14.460 Da, es soluble y tiene un punto isoeléctrico teórico de 4,67.[4]
La alfa-sinucleína presenta 4 isoformas compuestas por 98, 112, 126 y 140 aminoácidos, siendo esta última la más abundante en humanos.[5] En la isoforma formada por 140 aminoácidos podemos distinguir tres regiones distintas: primero, encontramos una región cargada positivamente y anfipática llamada dominio N-terminal o también conocida como extremo amino terminal, en la que están comprendidos los aminoácidos del 1 al 60. Este primer dominio contiene una secuencia conformada por 7 repeticiones imperfectas, cada una de una longitud de 11 aminoácidos, que presentan la secuencia consenso KTKEGV y es propenso a formar estructuras de hélice alfa. Esta primera región de la alfa-sinucleína, el extremo N-terminal, es la responsable de la capacidad que tiene esta proteína de unirse a las membranas. Seguidamente, se dispone el segmento central de la proteína que es exclusivo de la alfa-sinucleína y se conoce como componente no-amiloideo (NAC). Este es muy hidrofóbico y fue encontrado por primera vez en pacientes que sufrían espondilitis anquilosante o anquilopoyética (EA) y Demencia con Cuerpos de Lewy (DCL). Este dominio central ha sido denominado como el precursor del componente noamiloidogénico de las placas seniles y comprende los aminoácidos del número 61 al 95 de la alfa-sinucleína. Finalmente, encontramos el extremo carboxilo terminal o también conocido como dominio C-terminal, el cual comprende los aminoácidos del 96 al 140, entre los cuales encontramos residuos de prolina. Esta región situada en el final de la cadena de aminoácidos de esta proteína presenta un carácter ácido y posee propiedades amiloidogénicas, así como es una región no estructurada móvil.[4][6]
La alfa-sinucleína ha sido tradicionalmente catalogada como una proteína intrínsecamente desestructurada y, por lo tanto, careciente de una conformación tridimensional única, estable y definida, hecho que le permite cambiar de conformación dependiendo de las condiciones del medio. Pero, aunque pertenece a este grupo de proteínas intrínsecamente no estructuradas (IUP), se sabe que, contiene algunas estructuras alfa-helicoidales en su región N-terminal. Así pues, en su forma nativa está desplegada y existe en diversas conformaciones en un equilibrio dinámico.[5] Además, diferentes estudios muestran que esta proteína es sujeto de múltiples modificaciones postraduccionales, la mayoría de las cuales están relacionadas con su extremo C-terminal. Dentro de estas modificaciones postraduccionales encontramos la fosforilación, la oxidación, la acetilación, la ubiquitinación, la glicación, la glicosilación, la nitración y la proteólisis. Estas modificaciones provocan ciertos cambios en la proteína, los cuales pueden estar relacionados con su carga, hidrofobicidad y estructura, así como también pueden provocan alteraciones relativas a la afinidad y enlaces establecidos con otras proteínas y lípidos, hechos que determinan también algunas de las características de las diversas conformaciones que puede adoptar la alfa-sinucleína.[7]
La proteína α-sinucleína se encuentra principalmente en el tejido nervioso, aunque está presente en menores cantidades en el corazón, músculos, ovarios, endometrio, placenta, riñón, hígado, pulmones, testículos, próstata y otros tejidos.[3] En el interior de la célula, además de encontrarse en el citosol, donde interactúan con lípidos de membrana, también se localiza en las mitocondrias,[8] y concretamente en las mitocondria asociadas a la membrana del retículo endoplasmático.[9]
Dentro del tejido nervioso se identifica en el neocórtex, el hipocampo, la sustancia negra, el tálamo y el cerebelo. Sin embargo, aunque no se conoce cuales son exactamente sus funciones, se ha podido relacionar la α-sinucleína de forma coherente y firme con las funciones pre-sinápticas y el transporte intracelular de vesículas.[10] Así, diferentes estudios sugieren que podría estar implicada en los siguientes procesos:
Interacción con fosfolípidos y otras proteínas dentro de los terminales presinápticos de las neuronas, como el transportador de dopamina, fosfolipasa D1, SNCAIP, proteína tau o la β-amiloide.[11]
Reciclaje de vesículas y regulación de la movilidad de las vesículas sinápticas, atenuando y restringiendo así la liberación de neurotransmisores, para controlar la transmisión de señales en las zonas pre-sinápticas y la cantidad de vesículas que intervienen en cada transmisión.[2]
Intervención en la apoptosis neuronal, o muerte celular programada, en este caso de algunas de las células del tejido nervioso a través de señales celulares controladas.[7] 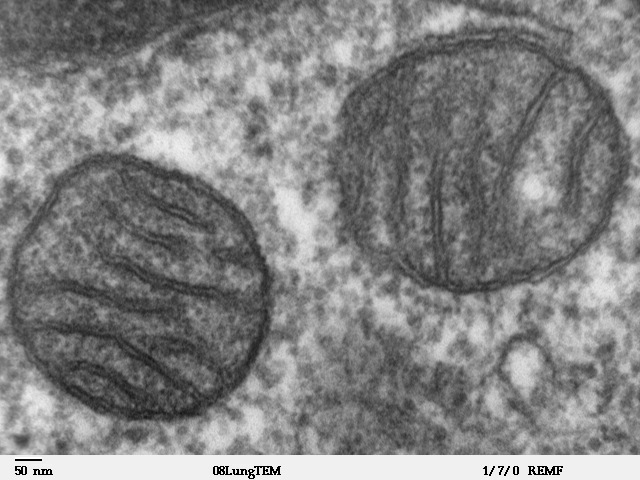
Mitocondrias
En la regulación de la reparación de las roturas de doble cadena del ADN, donde los biomarcadores que señalan daños en el ADN localizan conjuntamente con la α-sinucleína las roturas de la cadena. También interviene en la modulación del estado de modificación de la histona y en la regulación del normal funcionamiento de la célula mediante influencias en la transcripción[12]
Interviene en la activación de células de la microglía así como en la biosíntesis, metabolización y secreción de algunas proteínas como la dopamina.[11]
α-sinucleína y enfermedad de Parkinson
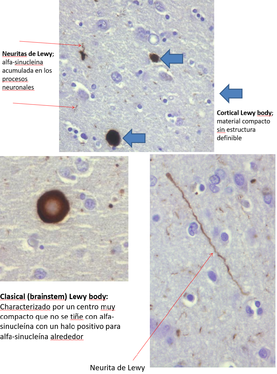
Cuerpos de Lewy y Neuritas de Lewy con acumulación de alfa-sinucleína.[13]
Hace unos 20 años, los científicos creían que no había ninguna relación directa entre la enfermedad de Parkinson y la genética. Sin embargo, hoy en día se tienen evidencias de que al menos un 10% de los pacientes de la enfermedad de Parkinson sufren esta enfermedad por causas genéticas conocidas, aunque se estima que un 30% del riesgo vinculado a esta enfermedad podría ser explicado también a través de la genética. Por lo tanto, se cree que existe una participación importante del rasgo hereditario en los casos esporádicos de la enfermedad. Por esta razón, se está investigando esta enfermedad desde esta nueva perspectiva genética para poder así acercarnos, poco a poco, al descubrimiento de un posible tratamiento. Los científicos han descubierto cambios que afectan a unas 80 localizaciones de genes distintas que podrían influir en el desarrollo de esta enfermedad neurodegenerativa.[14] Por ejemplo, se llegó a informar de un aumento de 13 veces en la susceptibilidad a la enfermedad en pacientes que presentan la combinación de genotipos α-sinucleína y apolipoproteína E, pero esto aún debe confirmarse.[15]
La primera conexión genética establecida con la enfermedad de Parkinson fue la que relaciona esta con el gen SNCA, el cual sintetiza la proteína α-sinucleína. Por lo tanto, la α-sinucleína ha sido vinculada con la enfermedad de Parkinson a raíz de dos hallazgos distintos.
El descubrimiento anteriormente mencionado, es decir, el hallazgo de que las mutaciones puntuales en el gen SNCA son patógenas para las formas famililares de esta enfermedad neurodegenerativa. Esto fue descubierto en 1997 por investigadores del National Institute of Health situado en Estados Unidos.[14] Además, en otro estudio hecho en cuatro familias sin relación con la rara variedad autosómica dominante de la enfermedad de Parkinson se identificó una mutación en el cromosoma 4 que codifica para una variedad aberrante de la sinucleína (Polymeropoulos et al). Se describió asimismo una familia en que la causa genética primaria es una copia extra no mutante del gen de α-sinucleína.[16] En segundo lugar, se demostró, además, que el componente principal de los Cuerpos de Lewy y las Neuritas de Lewy en la enfermedad de Parkinson idiopática o esporádica es la proteína sobre la que se centra este artículo, es decir, la α-sinucleína. A raíz de todas estas investigaciones, se ha visto que hay una mayor expresión de esta proteína, así como formas patológicamente alteradas de la α-sinucleína, en la patogénesis de la enfermedad de Parkinson, tanto en la esporádica como en la familiar. Por lo tanto, se ha podido establecer una correlación entre esta enfermedad y esta proteína.[4]
Hay evidencias de que la α-sinucleína, que en su correcta conformación es soluble, se pliega de manera errónea y pasa a formar oligómeros patológicos y agregados insolubles que se fibrilizan y, a continuación, se depositan en los Cuerpos de Lewy y las Neuritas de Lewy. Estas estructuras se encuentran en las neuronas afectadas por la enfermedad de Parkinson.[4]
Esto ha permitido situar esta proteína dentro de estas estructuras gracias a las técnicas de inmunotinción, que permiten identificar la α-sinucleína y algunas otras proteínas menos específicas, como ubicuitina y tau, dentro de los cuerpos de Lewy.
De este hecho se deduce que la formación de estos agregados incapacita a la α-sinucleína para realizar las funciones normales que se le atribuyen.
Hay distintas consecuencias que podría provocar este plegamiento erróneo de la α-sinucleína, el cual es el detonante de la acumulación patológica de estas proteínas en el cerebro que puede traducirse en una enfermedad neurodegenerativa como la anteriormente mencionada, la enfermedad de Parkinson. Entre estas consecuencias encontramos, por ejemplo, la interrupción del transporte axonal, el aumento del estrés oxidativo, la pérdida de función mitocondrial, el secuestro de otras proteínas, la disfunción sináptica, que afecta negativamente al proceso de comunicación neuronal, y la inhabilitación del sistema ubiquitina-proteasoma (UPS). Se ha visto que todas estas consecuencias pueden ser agravadas si, juntamente con la α-sinucleína, otras proteínas sintéticas que establecen interacciones con esta también son acumuladas en los Cuerpos de Lewy y las Neuritas de Lewy. Además, también ha podido observarse que la propensión al plegamiento erróneo de la α-sinucleína aumenta por los valores altos de esta proteína, así como que este proceso se acelera por defectos en las proteínas de choque por calor que acompañan a la α-sinucleína al interior y exterior de la célula.[4]
En conclusión, el conjunto de estos hallazgos indica que es posible que la inestabilidad y el plegamiento erróneo de la α-sinucleína sean el defecto proteínico primario en estas formas de enfermedad de Parkinson.
Se cree que el causante principal de la neurodegeneració, seria; La α-sinucleína puede plegarse de manera errónea y pasar a formar oligómeros patológicos y agregados insolubles que se acaban depositando en los Cuerpos de Lewy..
Algunos estudios recientes hablan de diversos métodos para reducir la toxicidad provocada por la α-sinucleína. Una opción sería conseguir que la propia neurona realizase la autofagia de esta proteína y de este modo eliminase el exceso de ella. También se propone eliminar el exceso de α-sinucleína en el espacio extracelular mediante la inmunización innata y adaptativa. Además, los anticuerpos dirigidos a la C-terminal de truncamiento, oxidación y nitración podrían reducir la propagación e inhibir la oligomerización de esta.
Se ha visto que el uso de anticuerpos “anti-α-sinucleína” en ratones transgénicos ha disminuido la presencia de esta proteïna en el espacio extracelular, menguando así la transmisión de la proteïna de célula a célula, así como la reducción de la neurodegeneración y las dificultades funcionales. Sin embargo, hay otra manera más rápida de reducirla; en lugar de disminuir la presencia de α-sinucleína en el cerebro, debe reducirse específicamente en el CSF.
Este estudio propone una hipótesis: alterar los niveles de proteínas solubles en el CSF también altera sus niveles en el parénquima cerebral. En la enfermedad de Parkinson, la α-sinucleína se mueve en equilibrio entre el fluido intersticial y el fluido cerebroespinal. Por tanto, podemos llegar a la conclusión que si de alguna forma podemos disminuir la cantidad de α-sinucleína en el fluido cerebroespinal, también se va a reducir en la zona extracelular, evitando así su acumulación y disposición en el cerebro. [17]
Hoy en día existen diferentes propuestas para eliminar péptidos α-sinucleína del sistema nervioso central, basados en acceder al fluido cerebroespinal e ir depurando mediante dispositivos de filtración. La proteína podría ser detectada ya sea por su mida o bien mediante técnicas inmunológicas.
En conclusión, este estudio da luz a la posibilidad que mediante la disminución de los niveles de α-sinucleína en el fluido cerebroespinal gracias a técnicas avanzadas, sería posible reducir la neurodegeneración.
El manitol y la α-sinucleína
El manitol es un edulcorante que se obtiene de las algas y se encuentra en cosas como los chicles sin azúcar. Aun así, lo que realmente nos llama la atención de esta sustancia es que podría ser el siguiente paso en el camino de encontrar un tratamiento contra la enfermedad de Parkinson.
No sería la primera vez que se utiliza como fármaco ya que es utilizado para disminuir la inflamación del cerebro y tratar la insuficiencia renal. En el caso de utilizarlo contra la enfermedad de Parkinson, se haría debido a su capacidad de evitar la acumulación de la α-sinucleína, proteína que juega un papel crítico en el desarrollo y progresión de esta enfermedad.
El problema ocurre cuando esta proteína sufre un defecto y se acumula en una región del cerebro denominada sustancia negra, provocando así la muerte de las neuronas que producen dopamina, un neurotransmisor esencial para llevar a cabo los movimientos, entre otras importantes funciones.
En condiciones normales, existen unas determinadas proteínas, las chaperonas, que se encargan de ayudar a la α-sinucleína a adquirir una forma tridimensional determinada, lo que le permite poder realizar su función (la estructura de las proteínas está directamente ligada a la función que la misma va a realizar). En el caso del Párkinson, las α-sinucleínas se pliegan de una forma inadecuada, lo que hace que se acumulen en la sustancia negra del cerebro, como bien decíamos anteriormente.
Por lo tanto, lo que se trata de conseguir que la α-sinucleína a recobre su forma, y que se acumule en el cerebro.
Los investigadores de la Universidad de Tel Aviv creían que esa sustancia podría ser el manitol, ya que gracias a su capacidad de traspasar la barrera hematoencefálica podría llegar el cerebro y allí actuaría como una chaperona química, ayudando a que la α-sinucleína recobrase su forma.
Esta investigación se desarrolló en 2013 y desde entonces se ha seguido investigando cómo hacer para que el manitol se pueda utilizar, junto con otras moléculas, en la inhibición de la α-sinucleína. Por lo tanto, aunque no se haya conseguido llegar a ninguna idea concisa, sí que se mantiene la hipótesis de que el manitol tiene toxicidad hacia la α-sinucleína y que en un futuro podría utilizarse como tratamiento contra enfermedades como el Párkinson.
¿Como explicar la toxicidad de la α-sinucleína ¿
Existen dos mutaciones principales en el cromosoma 4q: A53T, A30P en las que se promueve la oligomerización de α-sinucleína. Los mecanismos de toxicidad de la α-sinucleína propuestos en la enfermedad de Parkinson según Eriksen, Dawson, Dickson y Petrucelli.
Duplicación de una copia del gen α-sinucleína.
Mutaciones de punto en el gen α-sinucleína que generan acumulaciones excesivas de sinucleína.
Mutaciones en los genes parkin y UCH-L1 que disminuyen la eliminación normal de sinucleína por los proteosomas.
El exceso de sinucleína se polimeriza para formar protofibrillas, un proceso que aumenta por defectos en las proteínas de choque por calor o por acción de la dopamina, que se une a sinucleína. A su vez, ello conduce a la formación de cuerpos de Lewy. Este modelo atribuye la neurotoxicidad a las protofibrillas de los cuerpos de Lewy.[19]
En el 2020 se publicó un artículo en la revista John Wiley & Sons, Inc. investigaron qué relación había entre la concentración de α-sinucleína en el fluido cerebroespinal y el sueño de los adultos de edad avanzada.
Los problemas del sueño como el sueño de movimientos oculares rápidos (MOR o REM, en sus siglas en inglés) y RBD que han sido identificados como síntomas en una gran variedad de enfermedades neurodegenerativas (como la enfermedad de Parkinson, atrofia multisistémica o MSA, demencia, entre otros), tienen más importancia a medida que la persona envejece.
En el estudio se ha observado que horarios irregulares de sueño o dormir de forma excesiva o insuficiente contribuyen a la disminución de niveles de α-sinucleína del fluido cerebroespinal (CSF). Todo esto nos indica que una mala calidad del sueño puede estar asociada con niveles bajos de α-sinucleína en personas de edad avanzada que carecen de trastornos neurológicos. De modo que se le atribuya a esta proteína un papel importante en la mejora del sueño en terapias futuras para trastornos neurodegenerativos. Es más, un análisis demostró que enfermeras que trabajaban durante el turno de noche (y por tanto no tenían un horario regular del sueño) presentaban un riesgo más alto de padecer la enfernedad de Parkinson. [20]
En conclusión, podemos deducir que un horario irregular de sueño baja los niveles de α-sinucleína en el fluido cerebroespinal y esto puede ir ligado al desarrollo de enfermedades neurodegenerativas.
Referencias
Recasens, Ariadna; Ulusoy, Ayse; Kahle, Philipp J.; Di Monte, Donato A.; Dehay, Benjamin (1 de julio de 2018). «In vivo models of alpha-synuclein transmission and propagation». Cell and Tissue Research (en inglés) 373 (1): 183-193. ISSN 1432-0878. doi:10.1007/s00441-017-2730-9. Consultado el 29 de octubre de 2020.
-
- ↑ a b Bendor, Jacob T.; Logan, Todd P.; Edwards, Robert H. (18 de septiembre de 2013). «The Function of α-Synuclein». Neuron (en inglés) 79 (6): 1044-1066. ISSN 0896-6273. PMID 24050397. doi:10.1016/j.neuron.2013.09.004. Consultado el 29 de octubre de 2020.
- ↑ a b Villar‐Piqué, Anna; Fonseca, Tomás Lopes da; Outeiro, Tiago Fleming (2016). «Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies». Journal of Neurochemistry (en inglés) 139 (S1): 240-255. ISSN 1471-4159. doi:10.1111/jnc.13249. Consultado el 29 de octubre de 2020.
- ↑ a b c d e Paloma Álvarez García (Junio 2018). «Trabajo fin de grado: Alfa-sinucleína como diana en el diseño de fármacos». Consultado el 29-10-2020
- ↑ a b Carla Rocío Pacheco Murillo (2013). «Efectos de Alfa-Sinucleína en neuronas del Sistema Nervioso Central». Consultado el 29-10-2020
- ↑ Anna Villar‐Piqué, Tomás Lopes da Fonseca, Tiago Fleming Outeiro (18 de julio de 2015). «Structure, function and toxicity of alpha‐synuclein: the Bermuda triangle in synucleinopathies». Consultado el 29-10-2020
- ↑ a b Jacqueline Burré, Manu Sharma and Thomas C. Südhof (20 de enero de 2017). «Cell Biology and Pathophysiology of α-Synuclein». Consultado el 29-10-2020
- ↑ Chinta, Shankar J.; Mallajosyula, Jyothi K.; Rane, Anand; Andersen, Julie K. (17 de diciembre de 2010). «Mitochondrial alpha-synuclein accumulation impairs complex I function in dopaminergic neurons and results in increased mitophagy in vivo». Neuroscience Letters (en inglés) 486 (3): 235-239. ISSN 0304-3940. PMC 2967673. PMID 20887775. doi:10.1016/j.neulet.2010.09.061. Consultado el 2 de noviembre de 2020.
- ↑ Guardia-Laguarta, Cristina; Area-Gomez, Estela; Rüb, Cornelia; Liu, Yuhui; Magrané, Jordi; Becker, Dorothea; Voos, Wolfgang; Schon, Eric A. et al. (1 de enero de 2014). «α-Synuclein Is Localized to Mitochondria-Associated ER Membranes». Journal of Neuroscience (en inglés) 34 (1): 249-259. ISSN 0270-6474. PMID 24381286. doi:10.1523/JNEUROSCI.2507-13.2014. Consultado el 2 de noviembre de 2020.
- ↑ Ottolini, Denis; Calí, Tito; Szabò, Ildikò; Brini, Marisa (1 de enero de 2017). «Alpha-synuclein at the intracellular and the extracellular side: functional and dysfunctional implications». Biological Chemistry (en inglés) 398 (1): 77-100. ISSN 1437-4315. doi:10.1515/hsz-2016-0201. Consultado el 2 de octubre de 2020.
- ↑ a b Middleton, Elizabeth R.; Rhoades, Elizabeth (2010-10). «Effects of Curvature and Composition on α-Synuclein Binding to Lipid Vesicles». Biophysical Journal 99 (7): 2279-2288. ISSN 0006-3495. doi:10.1016/j.bpj.2010.07.056. Consultado el 5 de noviembre de 2020.
- ↑ Schaser, Allison J.; Osterberg, Valerie R.; Dent, Sydney E.; Stackhouse, Teresa L.; Wakeham, Colin M.; Boutros, Sydney W.; Weston, Leah J.; Owen, Nichole et al. (29 de julio de 2019). «Alpha-synuclein is a DNA binding protein that modulates DNA repair with implications for Lewy body disorders». Scientific Reports 9. ISSN 2045-2322. PMC 6662836. PMID 31358782. doi:10.1038/s41598-019-47227-z. Consultado el 5 de noviembre de 2020.
- ↑ IMAGEN PROPIA (alumnos 1r Medicina)
- ↑ a b The Michael J. Fox Foundation. «Parkinson’s Genetics». Consultado el 5-11-2020
- ↑ KRÜGER, R; VIEIRA-SAECKER AM (1999). «Increased susceptibility to sporadic Parkinson’s disease by a certain combined α- synuclein/apolipoprotein E genotype.». Ann Neurol 45 (611): 917.
- ↑ SINGLETON, AB.; FARRAR M, JOHNSON J (2003). «Alpha-Synuclein locus triplication causes Parkinson’s disease». Science (302): 841.
- ↑ Menéndez-González, Manuel; Padilla-Zambrano, Huber S.; Tomás-Zapico, Cristina; García, Benjamin Fernández (2018/4). «Clearing Extracellular Alpha-Synuclein from Cerebrospinal Fluid: A New Therapeutic Strategy in Parkinson’s Disease». Brain Sciences (en inglés) 8 (4): 52. doi:10.3390/brainsci8040052. Consultado el 5 de noviembre de 2020.
- ↑ «Un edulcorante de los chicles sin azúcar, promesa contra el párkinson». abc. 6 de abril de 2013. Consultado el 5 de noviembre de 2020.
- ↑ Eriksen, JL; Dawson TM; Dickson DW; Petrucelli L (2003). «Caught in the act: α-Synuclein is the culprit in Parkinson’s disease.». Neuron 40: 453-456.
- ↑ [Xiao‐Tong Wang, Feng‐Tao Liu, Yan‐Lin Bi, Xue‐Ning Shen, Xu, W., Wang, J., . . . Jin‐Tai Yu. (2020). Associations of sleep characteristics with alpha‐synuclein in cerebrospinal fluid in older adults. Annals of Clinical and Translational Neurology, 7(10), 2026-2034. doi:http://dx.doi.org.sire.ub.edu/10.1002/acn3.51204 «Inici sessió – Identificació UB – Universitat de Barcelona»]. sso.ub.edu. Consultado el 5 de noviembre de 2020.