TRASTORNOS DEL MOVIMIENTO EN COVID-19 EN 2020:
El trabajo aunque publicado en la revista la LANCET, es un popurri, pero se pueden extraer, dos conclusiones, que dramatizan el pronostico de los enfermos infectados.
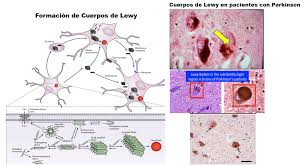
Existe una relación entre el coronavirus y la enfermedad del Parkinson.
Determinados fármacos bloquean la Alfa-sinucleína
La epidemia coronavirus , nos han sorprendido, no solo porque están apareciendo síndromes de Parkinson en pacientes infectados por el virus, sino también, porque a los enfermos con síntomas del virus y Pakinson, los empeora, y el bloqueo determinados fármacos el “Ambroxol”, un agente secretolítico utilizado en el tratamiento de enfermedades respiratorias, aumenta la actividad de la GCasa y, por lo tanto, reduce la α-sinucleína.
El COVID-19 en personas con enfermedad de Parkinson, empeora los síntomas parkinsonianos entre los infectados,
El COVID- 19 parecían tener una mayor tasa de mortalidad en los pacientes con enfermedad de Parkinson que además, mostraban más estrés, síntomas depresivos y ansiedad durante el período de encierro que antes de este período
El ambroxol, un agente secretolítico utilizado en el tratamiento de enfermedades respiratorias, aumenta la actividad de la GCasa y, por lo tanto, reduce la α-sinucleína.
Las concentraciones de algunos marcadores metabólicos y proteínas específicas (como los oligómeros de α-sinucleína y la tau hiperfosforilada) en el LCR se alteraron en los que recibieron nilotinib, lo que aumenta la posibilidad de que se puedan utilizar como posibles biomarcadores de la respuesta al fármaco en futuros ensayos de fase 3
Varios estudios que investigan el efecto de COVID-19 en personas con enfermedad de Parkinson han sugerido que los síntomas parkinsonianos empeoraron entre los infectados, que aquellos con enfermedad de Parkinson más avanzada tenían un mayor riesgo de compromiso pulmonar, que los pacientes hospitalizados con enfermedad de Parkinson y COVID- 19 parecían tener una mayor tasa de mortalidad y que los pacientes con enfermedad de Parkinson mostraban más estrés, síntomas depresivos y ansiedad durante el período de encierro que antes de este período.
Un informe de caso que vincula la infección por coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) con la enfermedad de Parkinson de nueva aparición ha llevado a una mayor conciencia de esta asociación potencial y también de su plausibilidad biológica subyacente.
En medio de la pandemia, varios ensayos clínicos de seguridad y prueba de concepto han dado pequeños pasos hacia la identificación de terapias que modifican la enfermedad. Dirigirse a la α-sinucleína, ya sea a través de inmunizaciones activas o pasivas, ganó considerable atención en los últimos años por su potencial para ralentizar la neurodegeneración, ya que la disfunción de la proteína es un factor importante de la neurodegeneración. En un primer estudio aleatorizado de fase 1 en humanos de inmunizaciones subcutáneas con PD01A (es decir, una inmunoterapia activa que usa un péptido corto dirigido a α-sinucleína oligomérica), 21 de los 24 pacientes originales completaron todas las inmunizaciones iniciales y de refuerzo durante más de 4 años de seguimiento.
La inmunización condujo a un aumento en los títulos de anticuerpos sin evidencia de neuroinflamación por imágenes ni efectos adversos clínicos significativos, lo que impulsó a los investigadores a pasar a la siguiente fase del estudio.
Las mutaciones con pérdida de función en el gen de la glucocerebrosidasa que codifica la β-glucocerebrosidasa (GCasa) lisosomal representan un factor de riesgo importante para la enfermedad de Parkinson y pueden conducir a la acumulación de α-sinucleína. El ambroxol, un agente secretolítico utilizado en el tratamiento de enfermedades respiratorias, aumenta la actividad de la GCasa y, por lo tanto, reduce la α-sinucleína. En un estudio abierto que utilizó una dosis creciente de ambroxol oral, 18 de los 23 pacientes con enfermedad de Parkinson moderadamente grave completaron el estudio.
El ambroxol se toleró bien y se detectó en el LCR, con un aumento de la actividad GCasa del LCR. Aunque se sugirió una mejora en las puntuaciones motoras clínicas con el fármaco, se requerirán ensayos controlados aleatorios futuros para mostrar su efecto sobre la progresión motora.
La inyección subcutánea o la infusión de apomorfina (un agonista de la dopamina no selectivo) a través de minibombas se ha utilizado en pacientes con enfermedad de Parkinson avanzada para aliviar los estados inactivos. Ahora se han investigado vías alternativas de administración de apomorfina. Un estudio multicéntrico, aleatorizado, doble ciego en pacientes con enfermedad de Parkinson y más de 2 horas de descanso por día comparó una dosis eficaz de película sublingual de apomorfina titulada individualmente a 10-35 mg con un placebo (54 frente a 55 pacientes).
Hubo una mejora significativamente mejor en las puntuaciones motoras de la Escala de Calificación de la Enfermedad de Parkinson Unificada de la Sociedad de Trastornos del Movimiento (desde antes de la dosis hasta 30 minutos después de la dosis) en la semana 12 en los participantes que recibieron apomorfina que en los que recibieron placebo. El 31% de los participantes que tomaban el fármaco informaron efectos secundarios orofaríngeos de leves a moderados, y el 17% interrumpió el tratamiento. La seguridad y eficacia a largo plazo de esta formulación de apomorfina como terapia a demanda para episodios inactivos en pacientes con enfermedad de Parkinson aún debe evaluarse más a fondo.
La reutilización de medicamentos continúa atrayendo interés, ya que esta estrategia puede reducir potencialmente el tiempo y el costo y mejorar el apoyo regulatorio para una traducción clínica exitosa. El nilotinib se ha utilizado para tratar la leucemia mieloide crónica. En un ensayo de fase 2 de un solo centro, doble ciego, controlado con placebo, 75 pacientes con enfermedad de Parkinson moderadamente grave fueron aleatorizados en grupos de placebo, nilotinib (150 mg) o nilotinib (300 mg) (administración oral diaria durante un año) .
Aunque hubo más efectos secundarios adversos en los grupos de nilotinib que en el grupo de placebo, el fármaco fue generalmente seguro y detectable en el LCR. Las concentraciones de algunos marcadores metabólicos y proteínas específicas (como los oligómeros de α-sinucleína y la tau hiperfosforilada) en el LCR se alteraron en los que recibieron nilotinib, lo que aumenta la posibilidad de que se puedan utilizar como posibles biomarcadores de la respuesta al fármaco en futuros ensayos de fase 3.
Los enfoques de secuenciación de próxima generación para desentrañar las causas genéticas subyacentes de los trastornos raros del movimiento pueden proporcionar un diagnóstico definitivo y facilitar los estudios fisiopatológicos para identificar nuevos objetivos terapéuticos. Para desentrañar las causas monogénicas de la distonía (una enfermedad clínica y genéticamente heterogénea), se realizó la secuenciación del exoma completo en 764 pacientes con distonía y 346 padres sanos en un estudio colaborativo internacional en el que participaron 33 centros.
Los autores lograron identificar variantes genéticas causales o probables en 135 (19%) de las 728 familias, y variantes diagnósticas en 11 genes que no estaban vinculados previamente a la distonía. La mayoría de las variantes identificadas se encuentran en genes relacionados con trastornos del neurodesarrollo. En esencia, la aplicación de la secuenciación del exoma en un gran número colectivo de pacientes con distonía mejora el diagnóstico, facilita la correlación genotipo-fenotipo, potencialmente guía las pruebas genéticas y mejora el manejo clínico de los pacientes con distonía.
Los trastornos de expansión repetida se han relacionado con un fenotipo clínico amplio. Un estudio examinó a 100 portadores confirmados genéticamente de ataxia cerebelosa con neuropatía y síndrome de arreflexia vestibular, que se debe a expansiones de repetición bialélica en RFC1 (subunidad 1 del complejo del factor de replicación).
Los investigadores encontraron que una tos seca espasmódica se asocia comúnmente con trastornos de expansión repetidos, y que la neuropatía sensorial era la única manifestación en algunos pacientes.
Aunque otros investigadores han informado mutaciones RFC1 en atrofia de múltiples sistemas.
De manera similar, ahora se han informado expansiones repetidas de GGC en NOTCH2NLC , que causa enfermedad de inclusión intranuclear neuronal, en pacientes con enfermedad de Parkinson y temblor esencial que no muestran disfunción cognitiva o evidencia de imagen de enfermedad de inclusión intranuclear.
Se necesita un alto índice de sospecha y conciencia para realizar pruebas genéticas adecuadas en pacientes que presentan trastornos del movimiento.
Como conclusión, existe una relación entre los virus y el empeoramiento y aparición de la enfermedad y síndrome de Parkinson.
Lancet Neurol. 2020; 19 : 908-, P10-12,01 DE ENERO DE 2021