LOS LISOSOMAS COMO TRATAMIENTO EN ENFERMEDAD DE PARKINSON
Un inhibidor de LRRK2 revierte la disfunción lisosomal en enfermedad de Parkinson y abre una nueva puerta al tratamiento las patologías neurodegenerativas.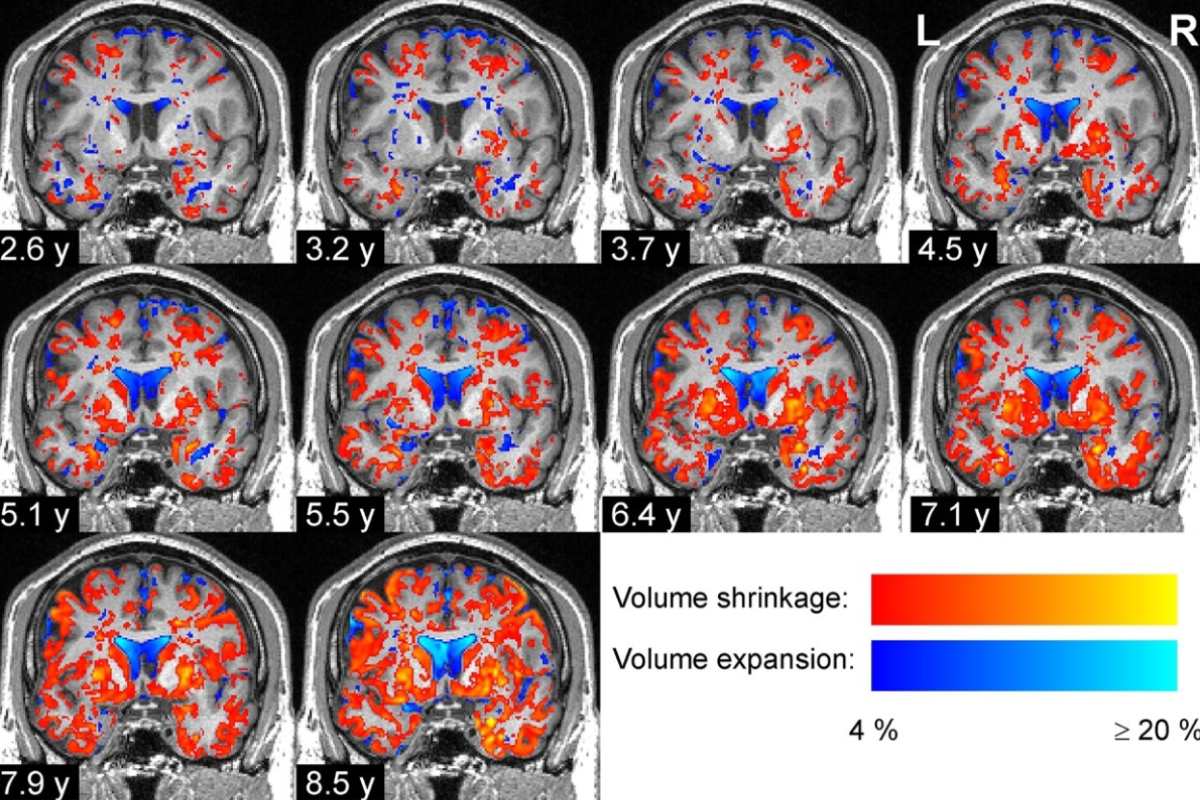
Progresión del cerebro de un paciente con enfermedad de Parkinson. Foto: MIT
Un inhibidor de LRRK2 se ha revelado seguro y bien tolerado, al tiempo que ha sido capaz de penetrar en el sistema nervioso central y ha mostrado eficacia para revertir la disfunción lisosomal en pacientes portadores de la mutación G2019, con lo que puede abrir una nueva vía en el tratamiento de la enfermedad de Parkinson (EP).
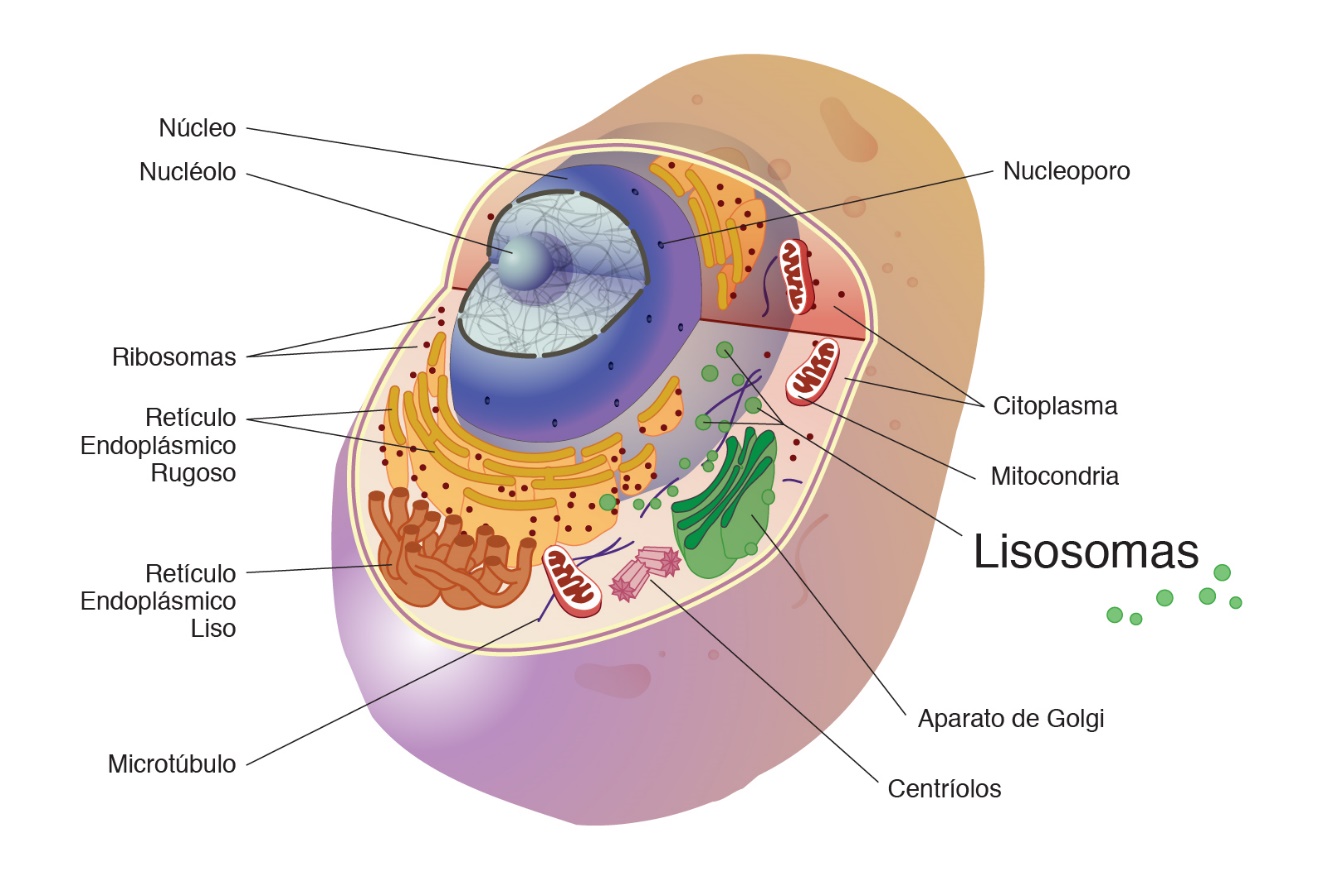
Los lisosomas son orgánulos celulares unidos a la membrana que contienen enzimas digestivas.
Los lisosomas están implicados en varios procesos celulares. Son los encargados de reciclar restos celulares de desecho. Pueden destruir virus y bacterias invasoras. Si la célula es dañada y no puede ser reparada, los lisosomas participan en el proceso de autodestrucción conocido como muerte celular programada o apoptosis.
Es una de las conclusiones de un estudio que acaba de ser publicado en Science Translational Medicine
La enfermedad de Parkinson es una patología que presentan actualmente el 2% de los individuos mayores de 65 años, es decir, que es una entidad con una prevalencia importante y para la que aún no se dispone de una terapia efectiva que consiga curar la enfermedad, explica José Antonio Rodríguez, investigador del Instituto Ramón y Cajal de Investigaciones Sanitarias y responsable del grupo Neurología Experimental.
Los fármacos actualmente disponibles actúan sobre los síntomas, de ahí la necesidad de «desarrollar terapias modificadoras que consigan enlentecer, detener o revertir la progresión de la enfermedad, tanto en Parkinson como en la mayoría de las enfermedades neurodegenerativas», explica Marta Blázquez Estrada, jefa de sección de Enfermedades Neurodegenerativas del Hospital Universitario Central de Asturias (HUCA).
Los lisosomas son orgánulos relativamente grandes, formados a partir del aparato de Golgi, que contienen hidrolasas ácidas (proteasas, nucleasas, glucosidasas, lipasas, etc.) encargadas de degradar el material intracelular de origen externo (como las bacterias o las partículas alimentarias) o interno (como las estructuras celulares dañadas) que llega a ellos.1 Es decir, se encargan de la digestión celular.2 Son estructuras esféricas rodeadas de membrana simple. Son bolsas de enzimas que si se liberasen, destruirían toda la célula. Esto implica que la membrana lisosómica debe estar protegida de estas enzimas. El tamaño de un lisosoma varía entre 0,02~0,5 μm.3 Los lisosomas fueron descubiertos por el bioquímico belga Christian de Duve en 1950 nombrada en 1955 ya como lisosoma.
En un principio se pensó que los lisosomas serían iguales en todas las células, pero se descubrió que tanto sus dimensiones como su contenido son muy variables. Se encuentran en todas las células animales.
El pH en el interior de los lisosomas es de 4,8 (bastante menor que el del citosol, que es neutro) debido a que las enzimas proteolíticas funcionan mejor con un pH ácido. La membrana del lisosoma estabiliza el pH bajo bombeando iones (H+) desde el citosol, asimismo, protege al citosol e igualmente al resto de la célula de las enzimas digestivas que hay en el interior del lisosoma.
Los lisosomas utilizan sus enzimas para reciclar los diferentes orgánulos de la célula, englobándolos, digiriéndolos y liberando sus residuos en el citosol. De esta forma, los orgánulos de la célula se están continuamente reponiendo, a través del proceso de digestión de los orgánulos se llama autofagia. Por ejemplo, las células hepáticas se reconstituyen por completo una vez cada dos semanas.
Enzimas más importantes del lisosoma
Glucosidasas, que digiere carbohidratos.
Proteasas, que digiere proteínas.
Nucleasas, que digiere ácidos nucleicos.
Formación de lisosomas primarios
Los lisosomas primarios son orgánulos derivados del sistema de endomembranas. Cada lisosoma primario es una vesícula que brota del aparato de Golgi, con un contenido de enzimas hidrolíticas (hidrolasas). Las hidrolasas son sintetizadas en el retículo endoplasmático rugoso y viajan hasta el aparato de Golgi por transporte vesicular. Allí sufren una glicosilación terminal (proceso químico en el que se adiciona un carbohidrato a otra molécula) de la cual resultan con cadenas glucídicas ricas en manosa-6-fosfato (manosa-6-P). La manosa-6-P es el marcador molecular, la «estampilla» que dirige a las enzimas hacia la ruta de los lisosomas. Se ha estudiado una enfermedad en la cual las hidrolasas no llevan su marcador; las membranas del aparato de Golgi no las reconocen como tales y las empaquetan en vesículas de secreción para ser exocitadas, de modo que, quienes padecen esta enfermedad, acumulan hidrolasas en el medio extracelular, mientras sus células carecen de ellas.
Lisosomas secundarios y digestión celular
Los lisosomas secundarios contienen una variedad de enzimas hidrolíticas capaces de degradar casi todas las moléculas orgánicas. Estas hidrolasas se ponen en contacto con sus sustratos cuando los lisosomas primarios se fusionan con otras vesículas y el producto de la fusión es un lisosoma secundario. Por lo tanto, la digestión de moléculas orgánicas se lleva a cabo en los lisosomas secundarios, ya que estos contienen a la vez los sustratos y las enzimas capaces de degradarlos.
Existen diversas formas de lisosomas secundarios, según el origen de la vesícula que se fusiona con el lisosoma primario:
Fagolisosomas: se originan de la fusión del lisosoma primario con una vesícula procedente de la fagocitosis, denominada fagosoma. Se encuentran, por ejemplo, en los glóbulos blancos, capaces de fagocitar partículas extrañas que luego son digeridas por estas células.
Autofagolisosomas: que son el producto de la fusión entre un lisosoma primario y una vesícula autofágica o autofagosoma. Algunos orgánulos citoplasmáticos son englobados en vesículas, con membranas que provienen de las cisternas del retículo endoplasmático, para luego ser reciclados cuando estas vesículas autofágicas se unen con los lisosomas primarios.
Lo que queda del lisosoma secundario después de la absorción es un cuerpo residual. Los cuerpos residuales contienen desechos no digeribles que en algunos casos se exocitan y en otros no, acumulándose en el citosol a medida que la célula envejece. Un ejemplo de cuerpos residuales son los gránulos de lipofuscina que se observan en células de larga vida, como las neuronas.
Enfermedades lisosómicas[editar]
Son enfermedades causadas por la disfunción de alguna enzima lisosómica o por la liberación incontrolada de dichas enzimas en el citosol, lo que produce la lisis de la célula.
En algunos casos, la liberación de las enzimas cumple un papel fisiológico, permitiendo la reabsorción de estructuras que ya no son útiles, por ejemplo la cola de los renacuajos durante la metamorfosis.
Enfermedades de almacenamiento lisosómico
En las enfermedades de almacenamiento lisosómico,4 alguna enzima del lisosoma tiene actividad reducida o nula debido a un error genético y el substrato de dicho enzima se acumula y deposita dentro del lisosoma que aumentan de tamaño a causa del material sin digerir, lo cual interfiere con los procesos celulares normales; algunas de estas enfermedades son:
Esfingolipidosis. Son enfermedades causadas por la disfunción de algunas de las enzimas de la ruta de degradación de los esfingolípidos. Dado que los esfingolípidos abundan en el cerebro, varias de estas enfermedades cursan con retraso mental severo y muerte prematura; entre ellas hay que destacar la enfermedad de Tay-Sachs, la enfermedad de Gaucher, la enfermedad de Niemann-Pick, la enfermedad de Krabbe, la fucosidosis, etc.
Carencia de lipasa ácida. La lipasa ácida es una enzima fundamental en el metabolismo de los triglicéridos y del colesterol, que se acumulan en los tejidos. La disfunción de esta enzima provoca dos enfermedades, la enfermedad de almacenamiento de ésteres de colesterol, en que la enzima presenta muy poca actividad, y la enfermedad de Wolman, en que la enzima es totalmente inactiva.
Glucogenosis tipo II o enfermedad de Pompe. Es un defecto de la α(1-4) glucosidasa ácida lisosómica, también denominada maltasa ácida. El glucógeno aparece almacenado en lisosomas. En niños destaca por producir insuficiencia cardíaca al acumularse en el músculo cardíaco causando cardiomegalia, mientras que en adultos el acúmulo es más acusado en músculo esquelético.
Mucopolisacaridosis. Causadas por la ausencia o el mal funcionamiento de las enzimas necesarias para la degradación moléculas llamadas glicosoaminoglicanos o glucosaminglucanos (antes llamadas mucopolisacáridos). Destacan la mucopolisacaridosis tipo I, también conocida como gargolismo o enfermedad de Hurler, en la que existe un defecto de la enzima α-1-iduronidasa, y la mucopolisacaridosis de tipo II o síndrome de Hunter, causada por un error en la enzima iduronato-2-sulfatasa. El —síndrome Sanfilippo—— MPS III, está relacionado con la acumulación de N-heparan Sulfatasa.
Gota
En la gota, el ácido úrico proveniente del catabolismo de las purinas se produce en exceso, lo que provoca la deposición de cristales de urato en las articulaciones. Los cristales son fagocitados por las células y se acumulan en los lisosomas secundarios; estos cristales provocan la ruptura de dichas vacuolas con la consiguiente liberación de enzimas lisosómicos en el citosol que causa la digestión de componentes celulares, la liberación de sustancias de la célula y la autolisis celular.
La membrana de los lisosomas es impermeable a las enzimas y resistente a la acción de estas. Ambos hechos protegen normalmente a la célula de una batería enzimática que podría degradarla. Existen, sin embargo, algunos procesos patológicos, como la artritis reumatoide, que causan la destrucción de las membranas lisosomales, con la consecuente liberación de las enzimas y la lisis celular.
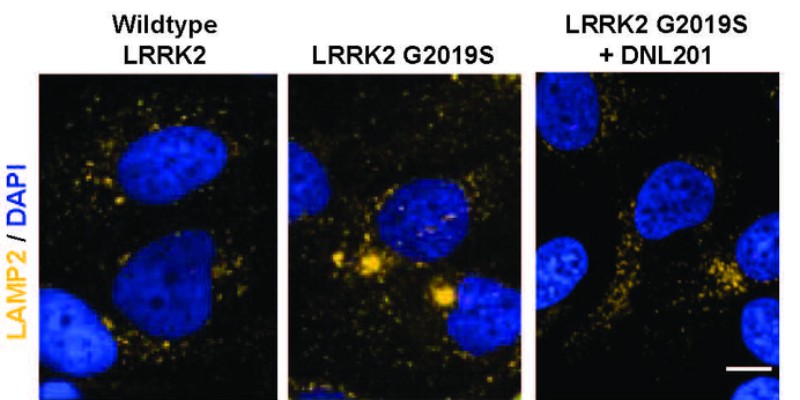 Células humanas que expresan LRRK2, a las 72 horas del tratamiento; la estructura de los lisosomas se marca en amarillo. Foto: STM
Células humanas que expresan LRRK2, a las 72 horas del tratamiento; la estructura de los lisosomas se marca en amarillo. Foto: STM
Uno de los genes mutados en algunos casos de enfermedad de Parkinson familiar es LRRK2, encargado de codificar la cinasa LRRK2, que se considera en la actualidad el factor de riesgo genético más común en la EP, explica Marta Blázquez. Así, se ha comprobado que el aumento de la actividad de esta cinasa LRRK2 altera la función lisosomal y tiene un papel fundamental en la patogénesis de la enfermedad. Por tanto, la inhibición de LRRK2 sería una posible estrategia terapéutica modificadora de la enfermedad de Parkinson.
Los lisosomas son los órganos encargados de degradar las proteínas mal plegadas en las células, es decir, son como órganos de reciclaje. «Y esta actividad de degradación en los pacientes con enfermedad de Parkinson no se desarrolla adecuadamente por esa mutación en una proteína implicada en la regulación de esta actividad»,
El trabajo ahora publicado da cuenta de los resultados de un estudio en fase preclínica y dos ensayos clínicos en fase I y Ib en humanos en los que se incluyeron 122 individuos sanos y 28 pacientes con enfermedad de Parkinson, en los que se ha probado la seguridad y efectividad del inhibidor de la cinasa LRRK2 DNL201.
Y lo que han visto es que el fármaco es seguro y bien tolerado en la muestra de individuos estudiada y que tiene actividad en el sistema nervioso central, resalta José Antonio Rodríguez, además de ser capaz de revertir la disfunción lisosomal en los pacientes portadores de la mutación G2019, que es la más frecuente en LRRK2, indica Marta Blázquez.
También se ha demostrado en estudios in vitro con fibroblastos de pacientes portadores de mutaciones en el gen GBA1, que es un factor de riesgo para enfermedad de Parkinson, además de ser causante de la enfermedad de Gaucher, que DNL201 reduce la fosforilación y mejora la disfunción lisosomal. «Esto significa que tiene efectividad sobre la proteína LRRK2», resalta Marta Blázquez.
Así, esta molécula se perfila como una nueva droga capaz de inhibir LRRK2 y corregir los defectos lisosomales que se producen en la enfermedad de Parkinson y otras enfermedades neurodegenerativas, «favoreciendo esa actividad lisosomal que está alterada», apunta José Antonio Rodríguez.
El estudio apoya la hipótesis con la que se viene trabajando desde hace años de que la inhibición de LRRK2 tiene potencial para corregir la disfunción lisosomal en pacientes con EP, lo que justificaría, según los autores del trabajo, un mayor desarrollo clínico de los inhibidores de LRRK2 como modalidad terapéutica para la enfermedad de Parkinson.
Referencias
Cooper, G. M., Hausman, R. E. La Célula. Madrid: Marban; 2011.
Granillo Velázquez, María del Pilar; Valdivia Urdiales, Blanca Alma; Villarreal Domínguez, María del Socorro (2011). Biología general. Los sistemas vivientes. Ciudad de México: Grupo editorial patria. p. 100. ISBN 978-607-438-248-8.
Kuehnel, W. (2003). Color Atlas of Cytology, Histology, & Microscopic Anatomy (en inglés) (4th edición). Thieme. pp. 34. ISBN 1-58890-175-0.
Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4.
Covadonga Díaz. Oviedo Dom, 12/06/2022 – 16:57