 LAS CITOCINAS
LAS CITOCINAS
Son un grupo de proteínas y glucoproteínas producidas por diversos tipos celulares que actúan
fundamentalmente como reguladores de las respuestas inmunitaria e inflamatoria. Intervienen como factores de crecimiento de distintas células, sobre todo, en las células hematopoyéticas.
Isaac y Lindermann la describieron hace más de 40 años en la actividad del interferón. Posteriormente, en los años sesenta se evidenció la presencia de diferentes actividades biológicas en el sobrenadante de cultivos celulares.
En 1967 Robinson describió los factores estimuladores de colonias (CSF), denominados así por su capacidad de estimular la formación de granulocitos y macrófagos en la médula ósea. Más adelante, en 1969, el grupo de Dumonde designó con el nombre de linfocina una serie de mediadores de la inmunidad celular producidos por los linfocitos. En los años siguientes se caracterizaron diversas linfocinas, así como otros mediadores producidos por los monocitos que fueron denominados monocinas.
En 1974 el grupo de Cohen propuso utilizar el nombre de citocinas para referirse en general a estos mediadores celulares que se originan en diversos tipos celulares.
Dentro del grupo de las citocinas se incluyen las interleucinas:
(IL), los factores de necrosis tumoral (TNF), los interferones (IFN), los CSF y las quimocinas.
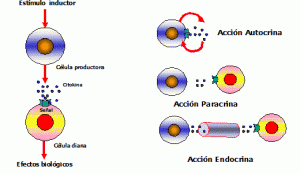
Las citocinas actúan como reguladores sistémicos a concentraciones del orden de nano o picomoles, modulando la actividad de un amplio espectro de tipos celulares que, en general, es bastante superior al de las hormonas. Por otro lado, las citocinas pueden actuar
como factores de crecimiento locales, a través de un mecanismo autocrino (sobre la propia célula), paracrino (sobre una célula vecina), yuxtacrino (implicando interacciones intercelulares) o retrocrino (a través de formas solubles de ciertos receptores de membrana)
En cualquier caso, la actuación biológica de las citocinas se produce a través de su interacción con receptores de membrana específicos que desencadenan una cascada de reacciones bioquímicas en el interior de la célula diana que determina su acción biológica
A partir de la década de los ochenta, una vez conseguida su clonación y con la disposición de anticuerpos monoclonales específicos para cada
citocina, se ha realizado un paso decisivo en su conocimiento. En la
actualidad, la diversidad de métodos disponibles permite un enfoque plural
al estudio de las citocinas y sus receptores. Dichos métodos ofrecen
información tanto sobre la concentración en distintos líquidos biológicos de las citocinas y sus receptores como sobre su expresión en la superficie de un tipo celular concreto.
Las técnicas de biología molecular han permitido conocer los mecanismos genéticos implicados en la regulación de su síntesis y han puesto en evidencia la existencia de polimorfismos genéticos en las regiones reguladoras de diversas citocinas, cuya trascendencia clínica ha
sido puesta de manifiesto a través de diversos estudios.
Cómo funcionan las citosinas
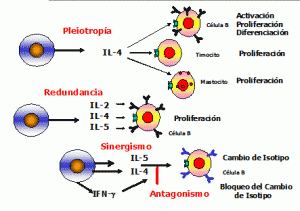
Las citocinas forman una compleja red y hacen que distintos tipos de células se conecten entre sí a través de las citosinas, que inducen o suprimen su propia síntesis o la de otras citocinas o sus receptores.
A la vez, las citocinas favorecen de manera el sinérgica la acción de otras citocinas o bien actúan como verdaderos antagonistas de sus efectos biológicos y se caracterizan por su efecto redundante, hecho que subraya la importancia de su función reguladora.
Las citocinas se caracterizan por su capacidad para actuar pleiotrópicamente sobre diversos
tejidos y producir múltiples efectos biológicos.
Todo ello define una red dotada de gran flexibilidad y para inter relacionarse
Y compensar cuando es necesario la falta de uno de sus componentes.
Por otro lado, debe considerarse que la solubilización de los receptores de las citocinas tras su unión con la correspondiente citocina interviene también en este entramado biológico, y pueden actuar como inhibidores de la correspondiente citocina (como sucede con los receptores solubles de la IL-2 o del TNF, por ejemplo) o como agonistas (como el receptor soluble
de la IL-6).
Métodos de dosificación de las citocinas
Diversos bioensayos basados en el empleo de líneas celulares capaces de responder al efecto de una citosina permiten determinar in vitro la actividad biológica de estas sustancias. Estas técnicas requieren una atenta dedicación y presentan algunos problemas de precisión y
especificidad que puede ser mejorada con el empleo de inhibidores o de anticuerpos bloqueadores de otras citosinas distintas a la dosificada pero que coinciden en tener
con ella una actividad biológica semejante. Entre los efectos biológicos que fundamentan estos bioensayos se encuentran los estudios de la proliferación celular, de la capacidad citotóxica o de la quimiotaxis.
El estudio de las citocinas se ha extendido con la optimización de técnicas de inmunoanálisis que permiten dosificar la concentración de citocinas y sus receptores solubles tanto en suero y plasma como en otros líquidos biológicos y en el sobrenadante de cultivos. Éstas son técnicas basadas en el empleo de anticuerpos monoclonales o policlonales específicos para cada
citocina, que se caracterizan por su elevada precisión, derivada de sus altas sensibilidad y especificidad analíticas. En algunos casos se dispone de técnicas ultrasensibles
que permiten la dosificación de concentraciones muy bajas de algunas citocinas. Sucede, por
ejemplo, con la IL-6 para la cual se han comercializado kits con una sensibilidad mínima de 0,09 pg/ml y una curva estándar con una amplitud de 0,16-10 pg/ml. Esto es especialmente útil en clínica humana, en que puede ser útil detectar con precisión valores ligeramente
elevados de IL-6.
Existen notables diferencias en la estandarización de los diversos ensayos disponibles en el mercado para la dosificación de cada una de las citocinas. Estas diferencias en buena parte son causadas por el empleo de anticuerpos dirigidos frente a epitopos distintos de la citocina
que deseamos dosificar, a diferencias en el efecto matriz o bien a la presencia de sustancias que interfieren en la dosificación de citocinas como son receptores solubles, proteínas de unión y autoanticuerpos. El establecimiento, a instancias de la OMS, de estándares internacionales
para las citocinas por parte del National Institute for Biological Standards and Controls (Standards@ nibsc.ac.uk) debería permitir avanzar en la unificación de unidades y valores entre los distintos kits.
Debe tenerse especial cuidado con el tipo de muestra de sangre que debe utilizarse para dosificar citocinas. Las muestras deben ser procesadas lo más rápidamente posible
para evitar tanto la degradación enzimática de las citocinas como la producción de citocinas intratubo por parte de las células sanguíneas. En general, se admite la posibilidad de trabajar con suero y plasma, siendo el EDTA el anticoagulante más aconsejado; en este caso
debe tenerse en cuenta que algunos anticoagulantes (p.ej., citrato o heparina sódica no suficientemente pura) pueden ser motivo de concentraciones de citocinas falsamente
elevadas. Una vez separadas las muestras deben ser congeladas a –20 °C o a –70 °C si deben ser almacenadas durante un tiempo prolongado, pues se desaconseja someter las muestras a reiterados ciclos de congelación y descongelación. Mediante estas técnicas pueden observarse concentraciones elevadas de diversas citocinas y sus receptores solubles en numerosas enfermedades, como las infecciosas e inflamatorias, las cardiopatías, las neumopatías
o el cáncer. En estos procesos las citocinas tienen valor como marcadores de actividad o pronósticos. Por otro lado, los inmunoanálisis permiten también estudiar la
capacidad de producción de citocinas por parte de sangre total incubada en presencia de diversos activadores policlonales, como lectinas, lipopolisacáridos o fitohemaglutinina.
Tras la realización de un cultivo de sangre total de entre 24-72 h en campana de cultivos y en condiciones estandarizadas puede observarse la capacidad de producción de citocinas por parte de las células sanguíneas. Siguiendo este protocolo, se hallan, una vez dosificada la concentración de citocinas en el sobrenadante del cultivo, diferencias en la producción de citosinas con respecto a la existente en controles sanos.
Así, por ejemplo, los pacientes con cáncer presentan una capacidad disminuida de producción, mientras que está elevada en los pacientes con enfermedades autoinmunes.
Citocinas de tipo Th1 y Th2
La citometría de flujo permite identificar mediante el empleo de marcadores de superficie específicos células individuales en las que podemos examinar la expresión de una o más citocinas. Este método aporta una información complementaria a la obtenida con la
dosificación de su concentración y ofrece datos acerca de los mecanismos implicados en el desarrollo de ciertas enfermedades que cuentan con una alteración en la síntesis de citocinas. La citometría de flujo ha sido particularmente utilizada para diferenciar los linfocitos
T colaboradores en los subtipos Th1 y Th2.
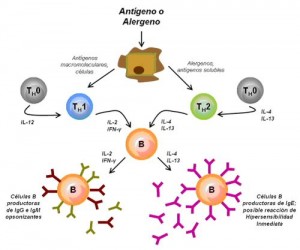
La expresión diferencial de la cadena 2 del receptor de la IL-12 permite caracterizar de forma diferencial las células de tipo Th1 y de tipo Th2. No obstante, el estudio del patrón de expresión de citocinas mediante citometría de flujo es el método usualmente empleado para distinguir entre ambos tipos celulares, existen diversos estudios que acreditan su utilidad en distintas
enfermedades. IFN-, IL-2 y TNF-constituyen el patrón de expresión característico de las células Th1, mientras que las células de tipo Th2 expresan IL-4, 5, 10 y 13. Las células dendríticas (DC) están especializadas en la presentación del antígeno a las
células Th decidiendo si serán activadas las células de tipo Th1 o Th2. Así las células DC1 secretan IL-12, que favorece la diferenciación de las células Th0 en Th1, mientras que las DC2, probablemente a través de la producción de IL-4, facilitan la diferenciación en el sentido Th2. Por otro lado, según indica el denominado paradigma Th1/Th2 (fig. 4) las citocinas, al interactuar entre sí, constituyen un mecanismo de regulación indispensable en el balance entre inmunidad celular y humoral. Así, el IFN-inhibe la proliferación de células Th2 y las IL-4 y 10 inhiben la proliferación de células Th1. La respuesta de tipo Th1 se caracteriza por la activación de las células natural killer (NK) y de los linfocitos T citotóxicos que expresan IFN-y perforina. Las células de tipo Th1 intervienen en la respuesta frente a patógenos intracelulares,
incluyendo bacterias, parásitos y virus, así como frente a tumores, si bien su hiperactivación está implicada en el rechazo de injertos y en diversas enfermedades autoinmunes como la esclerosis múltiple o la diabetes mellitus tipo 1. Por otro lado, la respuesta de tipo Th2 interviene en la erradicación de infecciones por parásitos intracelulares, como los helmintos.
Su activación descontrolada está implicada en la esclerosis sistémica o en la progresión a sida en la infección por VIH.
Citocinas en la inflamación
Las citocinas desempeñan un papel clave en el proceso inflamatorio que es definido por el balance entre citosinas proinflamatorias y antiinflamatorias. Entre las citosinas proinflamatorias destacan las quimocinas, grupo de péptidos de bajo peso molecular entre los que se encuentra
la IL-8, que están implicados en la quimiotaxis y en la activación de los distintos tipos celulares que participan en la inflamación. Por otro lado, la IL-1 y el TNF-tienen un efecto sinérgico sobre la inflamación, que también es promovida por el IFN-a través del aumento del TNF-. Existen numerosas citocinas antiinflamatorias, entre las que destacan la IL-10, el IL-1ra
(receptor del antagonista de la IL-1) y los receptores solubles de la IL-1 (p68) y del TNF (p55 y p75). Por su lado, la IL-6 tiene a la vez propiedades proinflamatorias (es uno de los principales inductores de las proteínas de fase aguda) y antiinflamatorias, y en este sentido es capaz de promover la síntesis de IL-1ra y de los receptores solubles del TNF.
Caracterización de las principales citocinas
Interleucina-1
Es un polipéptido de unos 15-20 kDa del que existen dos formas, denominadas IL-1e IL-1, con una homología de apenas el 26% y que derivan de una proteína precursora (pro-IL-1y pro-IL-1) (fig. 5). Ambas citocinas actúan sobre un mismo receptor, por el que también compite el antagonista del receptor de la IL-1 (IL-1ra), sustancia que impedirá la actuación de la IL-1. La IL-1actúa principalmente intracelularmente y no se encuentra en la circulación general excepto en casos de enfermedad grave. En cambio, la IL-1es la forma predominante en el espacio extracelular. Los macrófagos activados son la principal fuente fisiológica de IL-1, citocina que destaca por su capacidad proinflamatoria.
Interleucina-2
La IL-2 actúa al promover la proliferación de células T. Es producida principalmente por los linfocitos T activados, formando parte de la respuesta de tipo Th1. Efectúa su acción biológica a través de un receptor de membrana constituido por tres subunidades (, y ) (fig. 6). Tras
la activación del linfocito se libera al suero, en forma de receptor soluble, la subunidad o p55 (fig. 7). En el individuo sano existen ciertos niveles del receptor soluble
de la IL-2, mientras que niveles superiores a los normales pueden ser observados en numerosas enfermedades, hecho que refleja una excesiva activación linfocitaria.
Interleucina-3
Es producida fundamentalmente por los linfocitos T einterviene en los estadios iniciales de la hematopoyesis, estimulando el crecimiento y la diferenciación de las células precursoras hematopoyéticas. Se denomina también por este motivo multi-CSF.
Interleucina-4
Tiene su origen en los linfocitos T activados y actúa preferentemente promoviendo la activación, proliferación y diferenciación de los linfocitos B. Interviene de forma decisiva en la inducción de las células Th2 que regulan la inmunidad humoral.
Interleucina-5
Es producida por los linfocitos T activados y actúa como factor estimulador de la activación, crecimiento y diferenciación de los linfocitos B, siendo igualmente el principal factor regulador de la eosinofilia. Puede ser producida por algunos tumores y particularmente por el
cáncer de pulmón.
Interleucina-6
Tiene su origen en diversos tipos celulares, entre los que destacan macrófagos, monocitos, fibroblastos y células endoteliales. Interviene regulando la respuesta inmunológica, en la hematopoyesis y en las reacciones de fase aguda. Tiene, a la vez, efectos proinflamatorios y
antiinflamatorios. Produce sus efectos biológicos a través de un receptor de membrana compuesto por dos subunidades denominadas R-IL-6 y gp 130 (fig. 8), que actúa como señal transductora. Ambos receptores se solubilizan una vez se han unido a la IL-6, pero mientras que el sR-IL-6 actúa como agonista de la IL-6, el gp130 soluble antagoniza la acción de la IL-6.
Interleucina-7
Es una citocina de unos 25 kDa que actúa al estimular el desarrollo de las células precursoras de los linfocitos B y T. Asimismo, tiene actividad antitumoral, al aumentar la producción de linfocitos T citotóxicos y de células NK.
Interleucina-8
Actúa como factor quimiotáctico para los leucocitos, fundamentalmente neutrófilos. Igualmente actúa al favorecer su degranulación y estimular la fagocitosis. Debe ser incluida dentro del grupo de las quimosinas que abarcan diversas sustancias de unos 8-10 kDa y que mantienen entre sí una homología en su secuencia de entre el 20 y el 50%. Las quimocinas intervienen en la inflamación, induciendo la quimiotaxis y la activación celular de numerosas células que intervienen en los procesos
inflamatorios.
Interleucina-9
Es una glucoproteína de entre 32 y 39 kDa, con capacidad mitogénica y capaz de inducir la proliferación de células T. Se ha indicado que podría estar implicada en el desarrollo de tumores de células T.
Interleucina-10
Está producida por los linfocitos T de tipo Th2 y con capacidad de inhibir la síntesis de IFN-y de IL-2 por parte de los linfocitos T. Es la principal citocina antiinflamatoria, actuación que ejerce a través de la inhibición de la síntesis de IL-1, IL-6 y TNF-por parte de los macrófagos.
Interleucina-11
Es una proteína no glucosilada de 23 kDa que es producida por las células del estroma de la médula ósea y por las células mesenquimáticas. Relacionada con otras sustancias del grupo de las citocinas que incluye la IL-6, el factor inhibidor de la leucemia (LIF), la oncostatina-
M (OSM) y el factor neurotrófico ciliar (CNTF) y que se caracterizan por utilizar el transductor gp 130,proteína inicialmente identificada como un componente del receptor de la IL-6. La IL-11 actúa sobre las células hematopoyéticas, células hepáticas –induciendo las proteínas de fase aguda– y células epiteliales intestinales, sobre las que actúa mediando su protección y regeneración. En cambio, a diferencia de la IL-6, tiene escaso
efecto sobre los linfocitos. (Filella X, et al. Estructura y función de las citosinas)
Interleucina-12
Es una glucoproteína de 70 kDa y constituida por dos dominios, denominados p40 y p35, que son necesarios para que tenga actividad biológica. La subunidad p40 tiene cierta homología con el dominio extracelular del receptor de la IL-6, mientras que la subunidad p35 tiene
homología con la IL-6. Es producida por linfocitos B y, en menor cantidad, por linfocitos T. Actuando sobre linfocitos T de tipo Th1 induce la síntesis de IFN-y IL-2, mientras que también es capaz de reducir la producción de IL-4, IL-5 e IL-10 por parte de las células Th2.
Interleucina-13
Es una citocina producida por las células T y que regula la función de monocitos y células B. Disminuye la producción de interleucinas proinflamatorias y de quimocinas,
a la vez que aumenta la producción de IL-1-RA.
Interleucina-14
Designa al factor de crecimiento de las células B de elevado peso molecular (HMW-BCGF), factor que muestra una elevada homología con el factor Bb del sistema complemento.
Interleucina-15
Tiene una actividad biológica en parte semejante a la IL-2, si bien difiere en su control y expresión, así como en las células sobre las que actúa. Ambas citocinas emplean
como unidades de transducción los receptores (p75) y (p64) del sistema receptor de la IL-2. La IL-2 y la IL-15, en cambio, utilizan una cadena distinta.
Interleucina-16
Es una citocina proinflamatoria descrita inicialmente como el Lymphocyte chemoattractant factor (LCF). Es secretada por células CD8 activadas. Promueve la quimiotaxis y la expresión del receptor de IL-2 y de HLA-DR.
Interleucina-17
Es una glucoproteína de 155 aminoácidos producida
por células T CD4+ estimuladas. La IL-17 aumenta la
expresión de ICAM-1 en fibroblastos y es capaz de estimular
la secreción de IL-6, IL-8 y G-CSF por parte de
células epiteliales, células endoteliales y fibroblastos.
Interleucina-18
Citocina que induce la síntesis de IFN-y que anteriormente era conocida como IFN-inducing factor (IGIF). Tiene un efecto sinérgico con la IL-12 respecto a la producción de IFN-por parte de los linfocitos T, probablemente a causa del aumento de expresión de receptores
para la IL-18 producido por la IL-12. Igualmente, la IL-18 aumenta la producción de IL-2 y la expresión de la cadena del receptor de la IL-2. Participa, por tanto, en la regulación de la respuesta de tipo Th1, y puede, asimismo, disminuir la producción de IL-10.
Factores de necrosis tumoral
El TNF-se produce fundamentalmente por monocitos, macrófagos y linfocitos. Ejerce un efecto antitumoral a través de un doble mecanismo que incluye la inhibición de la angiogénesis, que produce la necrosis hemorrágica del tumor, y el aumento de la respuesta inmunitaria
antitumoral, acción en la que actúa sinérgicamente con el IFN-. Por otro lado, el TNF-actúa
como mediador en el desarrollo del shock séptico y en la caquexia, estado catabólico asociado a las enfermedades crónicas y que cursa con perdida de peso, anorexia y anemia. El TNF-ejerce su función a través de dos receptores, de 55 kDa (TNF-R-I) y de 75 kDa (TNF-R-II), que también utiliza el TNF-. Este presenta una homología con respecto al TNF-de alrededor
del 30%. Esta citocina, también llamada linfotoxina, es secretada por los linfocitos T activados, destacando por su actividad citotóxica sobre algunos tipos tumorales, en los que produce una necrosis hemorrágica.
GM-CSF
El GM-CSF es una glucoproteína de entre 18 y 30 kDa producida por linfocitos T, monocitos, células endoteliales y fibroblastos. Estimula de forma preferencial la formación de colonias de granulocitos y macrófagos, y en menor medida la formación de colonias de eosinófilos.
Igualmente, en combinaciónon la eritropoyetina, interviene en el desarrollo de los eritrocitos.
G-CSF
Es una glucoproteína con un peso molecular de entre 18 y 22 kDa, es producido por monocitos, células endoteliales y células epiteliales. Interviene tardíamente en la hematopoyesis induciendo de forma específica la formación de colonias de granulocitos.
M-CSF
El M-CSF es una citocina de entre 70 y 90 kDa de peso molecular que es producida por monocitos, fibroblastos y células endoteliales. Interviene de forma tardía en la hematopoyesis estimulando la formación de colonias de macrófagos. (Filella X, et al. Estructura y función de las citosinas )
Interferón
Los interferones son un amplio grupo de proteínas caracterizadas por tener una potente acción antiviral y antineoplásica, así como por su efecto regulador de las células del sistema inmunitario. Se distinguen tres grupos distintos de interferones. La familia del IFN-está constituida por unas 14 proteínas que mantienen una elevada homología entre sí, siendo producidas por una amplio grupo de células que incluye macrófagos y linfocitos B.
El IFN-mantiene una cierta homología con el grupo anterior (alrededor del 30%) y es producido por fibroblastos y células epiteliales. Los IFN-y actúan sobre un mismo tipo de receptor y son designados como IFN de tipo I. El IFN-únicamente tiene un 10% de homología
con los IFN de tipo I, actuando sobre un receptor distinto. Este interferón, denominado también de tipo II, es producido por los linfocitos T activados y por las células NK. El IFN-inhibe la proliferación de células de tipo Th2, induce la expresión de los antígenos HLA de clase I
y II y aumenta la actividad citolítica de células LAK y células T citotóxicas, incrementando la expresión de la subunidad (p55) del receptor para la IL-2.
Quimocinas
Las quimocinas son un conjunto de proteínas de muy bajo peso molecular (de 8-10 kDa) con una homología de entre el 20 y el 50% en su secuencia de aminoácidos. Su principal función es la quimiotáctica, y son producidas por una amplia variedad de células en respuesta
a estímulos irritantes y a una serie de mediadores como la IL-1, el TNF o el IFN-. Se clasifican en cuatro subfamilias denominadas -quimocinas o CXC (entre las que se incluye la IL-8), -quimocinas o CC, -quimocinas o C y -quimocinas o CX3C.
Bibliografía
Elsässer-Beile U, Von Kleist S. Cytokines as therapeutic and diagnostic
agents. Tumor Biol 1993;14:69-94.
Filella X, Molina R, Ballesta AM. Citocinas: del laboratorio a la clínica.
Vol 1 y 2. Libro de ponencias, 1998 y 2000.
Nicola NA, editor. Guidebook to Cytokines and their receptors. Oxford:
Oxford University Press, 1994.
Rich RR, Fleisher TA, Shearer WT, Kotzin BL, Schroeder HW, editors.
Clinical immunology. Principles and practice. Vol 1 y 2.
London: Mosby, 2001.
Romagnani S. The Th1/Th2 paradigm. Immunol Today 1997;18:263-6.