LA BETA AMILOIDE EN LA ENFERMEDAD DE ALZHEIMER
Se resumen tres artículos que no ayudan a aclarar el problema.
La proteína Beta amiloide no es la mala de la enfermedad, por ahora
Lo posible 
Alois Alzheimer (y Oskar Fischer) 1906 y 1911 empiezan a describir las placas características de los enfermos
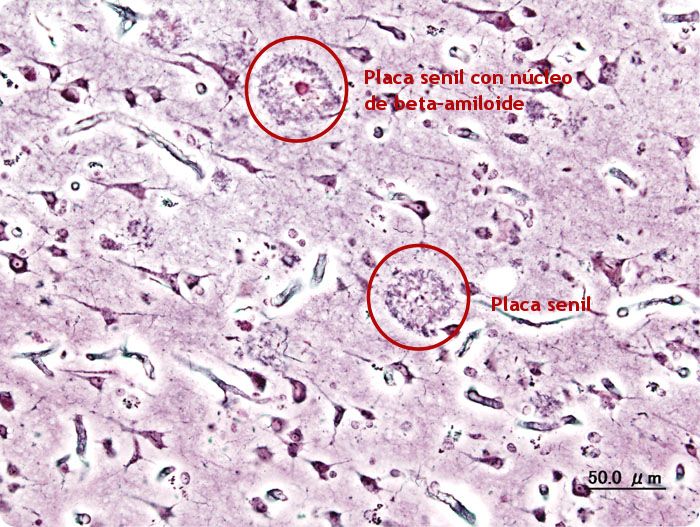
En 1984 se establece que la proteína β-amiloide es el principal componente de las placas.
En 1991 empieza a publicarse que varias mutaciones que aumentan la cantidad de proteína precursora del amiloide provocan indefectiblemente la enfermedad en quienes las portan. Se asume que es la causa del alzhéimer y la teoría se convierte en dominante.
Y lo no posible.
Bastantes personas ancianas presentan placas de amiloide, pero no tienen síntomas, aunque los ensayos clínicos diseñados para reducir las placas han conseguido disminuirlas en varias ocasiones, han fracasado invariablemente a la hora de mejorar los síntomas. Incluso aquellos ensayos realizados de forma precoz y en personas portadoras de mutaciones que les hacen en el futuro desarrollar la enfermedad no han demostrado ninguna mejoría.
Qué es la β- amiloide
Son pequeños fragmentos que proceden de la llamada proteína precursora del amiloide. Existen múltiples formas diferentes que tienden a agregarse y que acaban formando las placas características de la enfermedad de Alzheimer. En el caso del Aβ*56, se trataría de lo que se llama un oligómero soluble, sería una forma presuntamente tóxica pero que no se encuentra formando parte de las placas.
Esta es una cronología simple de algunos hallazgos importantes:
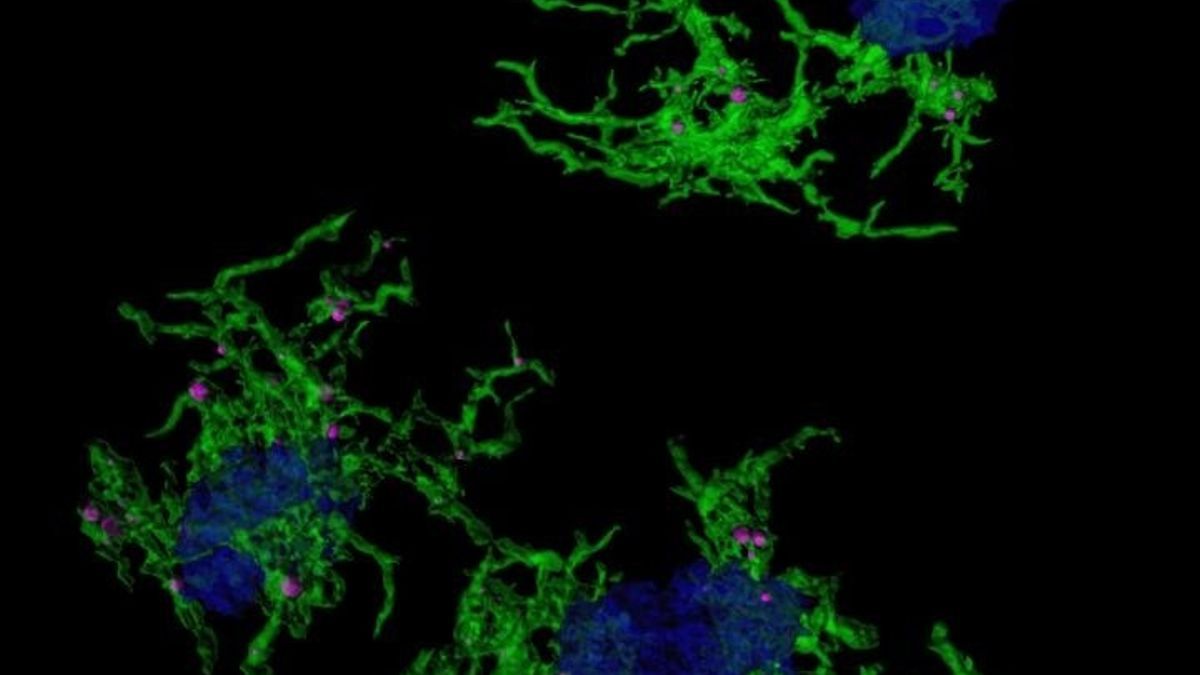 Imagen microscópica confocal microglia verde envuelve placas amiloide azul Europa Press
Imagen microscópica confocal microglia verde envuelve placas amiloide azul Europa Press
Science Media Centre 5 de agosto de 2022 14:38h
El alzhéimer es una de las principales enfermedades neurodegenerativas más estudiadas de las últimas dos décadas. La teoría de su origen y desarrollo ha girado en torno a una proteína llamada beta-amiloide, que se acumula en placas en las neuronas de las personas con alzhéimer. De hecho, se creía que se producía debido a dos fenómenos cerebrales patológicos que ya están perfectamente documentados, la acumulación de péptidos beta-amiloides y la modificación de la proteína Tau, cuyos agregados se encuentran en las neuronas que desestructuran la arquitectura cerebral. Desde entonces, miles de estudios han buscado la forma de encontrar una cura que desactive ambos procesos, aunque ninguno con el éxito suficiente. Y ahora se ha desvelado que la razón podría estar en un fraude científico. Así lo desvela un artículo de la revista Science que asegura que los descubrimientos del padre de esta teoría, Sylvain Lesné, se llevaron a cabo manipulando imágenes.
Este científico obtuvo una gran reputación porque con su trabajo afianzó la tesis dominante en la actualidad sobre la causa del alzhéimer. Presentó unos resultados que parecían demostrar que si se inyectaba un tipo concreto de beta amiloides —la amiloide beta estrella 56— en ratas, estos animales se mostraban incapaces de recordar informaciones muy simples ya aprendidas, como por ejemplo dónde se encontraba una plataforma escondida en un laberinto.
La respuesta se basó en una cascada química creaba estas placas, dañaba el tejido cerebral y convertía este órgano en disfuncional. Desde entonces, tanto la financiación pública como la investigación han apostado por esta idea. En este sentido, la importancia radica en que los experimentos que parecen haber sido trucados sostenían la principal teoría sobre la causa de esta demencia y han servido de guía al desarrollo de muchas terapias en los últimos 16 años.
Según este autor, la acumulación de estas placas son las precursoras de esta enfermedad, aunque ahora se cuestiona si son una causa o una consecuencia de la misma. Quizá esto explicaría por qué hay algunos medicamentos, como el tristemente famoso aducanumab, cuya aprobación en Estados Unidos vino seguida de una fuerte polémica pues, a pesar de destruir eficazmente las placas, no había pruebas de que mejorara la evolución de la enfermedad.
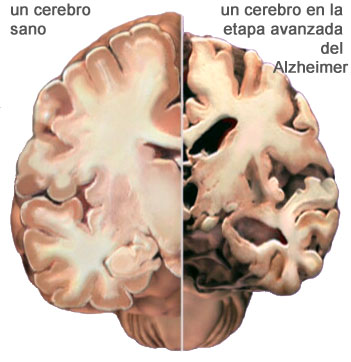
La acumulación de beta amiloide en el cerebro es un conocido precursor de la enfermedad de Alzheimer. Antes de que aparezcan los primeros síntomas, estos depósitos van formando placas entre las neuronas que resultan tóxicas y son responsables del progresivo deterioro cognitivo. Ahora, científicos del Centro Singular de Investigación en Química Biológica y Materiales Moleculares (CiQUS) de la Universidad de Santiago de Compostela (USC) en colaboración con investigadores de la Universidad Católica de Cuyo han diseñado un polímero capaz de reducir los niveles de este péptido sin producir efectos adversos. Estudios preclínicos han demostrado que este tratamiento, administrado en fases tempranas de la patología, contribuye a prevenir la pérdida de memoria.
Para drenar el exceso de beta amiloide en el cerebro, la apolipoproteína E (ApoE) resulta clave. Por otra parte, el DMHCA es una sustancia estructuralmente similar al colesterol capaz de activar los receptores que inducen la expresión de ApoE, sin afectar a los niveles de colesterol y triglicéridos. Pero tiene una limitación: su baja solubilidad le impide atravesar la membrana hematoencefálica que envuelve al tejido cerebral. «Nuestra hipótesis era que la unión controlada de DMHCA a un polímero favorecería la formación de un copolímero anfifílico con gran tendencia a formar micelas, de forma similar a como hace el jabón» explica Eduardo Fernández Megía, investigador principal en el CiQUS y coautor del estudio. Previamente, su grupo había participado con éxito en el desarrollado de nanopartículas capaces de atravesar la barrera hematoencefálica para tratamiento de infarto cerebral. Partiendo de la hipótesis, en esta ocasión la propuesta de los investigadores fue “desarrollar micelas poliméricas a partir de copolímeros dendríticos a los que uniríamos DMHCA de forma covalente, no mediante una simple encapsulación» señala Fernández Megía.
Los estudios llevados a cabo en células con cultivos primarios demostraron que las micelas eran capaces de internalizar neuronas y astrocitos. Posteriormente, los colaboradores argentinos administraron las micelas por vía nasal a ratones transgénicos y confirmaron que la producción ApoE aumentaba al tiempo que disminuía la presencia de beta amiloide, evitando la pérdida de memoria sin afectar a los niveles de colesterol y triglicéridos en sangre. Los autores consideran que los resultados de esta investigación, que acaban de ser publicados en la prestigiosa revista ACS Nano, posibilitarán nuevos desarrollos clínicos en torno a la administración de DMHCA para la prevención del Alzheimer.
Una publicación en la revista Science ha destapado un posible caso de fraude en una importante línea de investigación contra el alzhéimer. La señal de alarma la hizo sonar Matthew Schrag, neurólogo y neurocientífico de la Universidad de Vanderbilt, y la propia revista continuó el análisis. En concreto, identificaron que había todo tipo de manipulaciones de imágenes en al menos diez artículos sobre el llamado péptido Aβ*56. Todos ellos incluían la firma del neurocientífico Sylvain Lesné.
El Aβ*56 es una forma en la que se puede presentar la proteína beta-amiloide, la sustancia que se encuentra formando placas en los cerebros de los enfermos de alzhéimer y que, según la teoría dominante en las últimas décadas, es la responsable de iniciar la enfermedad. La teoría del amiloide ya era controvertida antes de este caso. ¿Por qué?
En los últimos años ha habido un debate intenso sobre la relevancia del amiloide en la enfermedad de Alzheimer. Una razón es que bastantes personas ancianas presentan placas de amiloide, pero no tienen síntomas, por lo que este podría no ser suficiente para desarrollar la enfermedad. Por otro, y esta es la razón principal, aunque los ensayos clínicos diseñados para reducir las placas han conseguido disminuirlas en varias ocasiones, han fracasado invariablemente a la hora de mejorar los síntomas. Incluso aquellos ensayos realizados de forma precoz y en personas portadoras de mutaciones que les hacen en el futuro desarrollar la enfermedad no han demostrado ninguna mejoría.
Actualmente solo hay un fármaco antiamiloideo aprobado para el alzhéimer, el aducanumab. Se le dio luz verde en Estados Unidos en medio de una enorme controversia, tanto por el extraño desarrollo de los ensayos clínicos como por la decisión final. En Europa, la Agencia Europea del Medicamento rechazó aprobarlo, aludiendo a que no había demostrado beneficio clínico y no era suficientemente seguro
Uno de esos diez artículos es uno de los más citados en la historia de la investigación contra el alzhéimer. Publicado en la revista Nature en 2006, aseguraba que al inyectar la forma Aβ*56 en ratas sanas, estas desarrollaban pérdidas de memoria. Era la primera vez que se demostraba que una sustancia, teóricamente presente en los cerebros de personas enfermas de alzhéimer, causaba directamente esos síntomas. Supuso un espaldarazo a la hipótesis del amiloide.
Schrag evita el término “fraude” en sus críticas y describe sus hallazgos como una “señal de alerta”. Otros expertos consultados por la revista Science los califican como “ejemplos sorprendentes de manipulación de imágenes”. También se dice que muchos otros grupos intentaron sin éxito reproducir los resultados, pero muy pocos lo comunicaron. Aunque un resultado irreproducible no implica necesariamente un fraude, en el artículo se reconoce que existe muy poco interés por los resultados negativos y es difícil contradecir a investigadores con autoridad.
A raíz de la publicación, algunos artículos y múltiples comentarios en redes sociales afirmaron que toda la investigación sobre el alzhéimer se basaba en un fraude y que se habían dilapidado cientos de millones de euros y décadas de esfuerzos. Sin embargo, muchos expertos han tratado de desmentir esas conclusiones y de contextualizar sus repercusiones. Todo gira alrededor de la proteína beta-amiloide.
¿Desmonta el posible fraude la teoría del amiloide y el alzhéimer?
No. En palabras en Twitter del investigador en alzhéimer Karl Herrup, “la magnitud del fraude es espeluznante, pero la importancia para el campo del alzhéimer se ha exagerado gravemente”. Según el químico Derek Lowe, exinvestigador del alzhéimer y responsable de un blog en la revista Science, “ciertamente, aumentó el entusiasmo y los niveles de financiación en el área y dio a la gente más razones para creer”. Sin embargo, los trabajos sobre el Aβ*56 ahora en cuestión “no condujeron directamente a ningún ensayo clínico sobre esa forma en concreto”. Seguramente se pusieron demasiados huevos en el mismo cesto amiloideo, pero no fue algo provocado por esos artículos.
Estos trabajos supusieron un espaldarazo, pero son solo una rama en todo el árbol de la teoría. También en Twitter, el investigador Samuel Marsh explicaba que “el trabajo principal en cuestión no estableció el modelo de la placa amiloide. Hablaba de un oligómero específico denominado AB*56. Hay muchos otros artículos en este campo que muestran la importancia y los efectos de los oligómeros y las placas”. Y seguía: “Sinceramente, dudo que la ausencia de este artículo en particular y del AB*56 en los registros científicos históricos hubieran cambiado significativamente los últimos 20 años de desarrollo de fármacos para la enfermedad de Alzheimer. Esto se debe a que existen sólidas pruebas genéticas y de otro tipo sobre el papel del amiloide en la enfermedad”.
Para John Hardy, descubridor de una de las mutaciones que llevan indefectiblemente a la enfermedad, “es una vergüenza que estos trabajos impliquen un engaño, y las revistas e instituciones deben tomar medidas contra el fraude cuando se descubre”. Sin embargo, “nunca he pensado que este artículo fuera importante, y creo que nunca me he referido a él en mi propio trabajo”.
.
Qué podría explicar el fracaso de los ensayos clínicos
Algunas de las explicaciones que se barajan son estas:
Aunque por lógica y por los estudios genéticos sea difícil de aceptar, es posible que el amiloide sea lo que se conoce como un epifenómeno, algo que acompaña a la verdadera causa pero que no actúe como tal.
Podría ser que los tratamientos incluidos en los ensayos no estuvieran llegando a tiempo. El daño producido por el amiloide podría ser muy precoz, y disminuirlo una vez ha desencadenado la agresión quizá no sea suficiente. Aunque algunos ensayos se han hecho en personas todavía sin síntomas, quizá sea aun así demasiado tarde.
Otra opción es que los anticuerpos utilizados para disminuir el amiloide no lo redujeran lo suficiente o que estuvieran actuando contra ciertas formas de este que fueran las realmente tóxicas. En este caso se estaría reduciendo la cantidad total, pero no aquello que está produciendo realmente el daño.
Y cada vez se acepta más que la enfermedad de Alzheimer es un síndrome, más que una enfermedad unívoca.
Referencias.
Alois Alzheimer (y Oskar Fischer) 1906 y 1911 empiezan a describir las placas características de los enfermos.
Science Media Centre 5 de agosto de 2022 14:38h
Sylvain Lesné fraude científico. Science
Eduardo Fernández Megía Centro Singular de Investigación en Química Biológica y Materiales Moleculares (CiQUS) de la Universidad de Santiago de Compostela (USC) en colaboración con investigadores de la Universidad Católica de Cuyo
Matthew Schrag Science fraude en el Alzheimer, neurólogo y neurocientífico de la Universidad de Vanderbilt
Karl Herrup, “la magnitud del fraude es espeluznante, pero la importancia para el campo del alzhéimer se ha exagerado gravemente”.
Samuel Marsh explicaba que “el trabajo principal en cuestión no estableció el modelo de la placa amiloide.