
Elías Metchnikoff
Elías Metchnikoff (16 de mayo de 1845, Járkov, Ucrania – 16 de julio de 1916, París, Francia)
Del maravillosos libro de Paul de Kruif, “Cazadores de microbios”, se extrae conocimiento suficiente para explicar acontecimientos biológicos de nuestros días.
Ni que decir tienen que toeo esto que escribo esta extraído de el.
Metchnikoff, fue más bien uno de esos personajes histéricos que aparecen en las novelas de Dostoievski.
Sí autodefinió cómo : Tengo cabeza, capacidad y talento natural. Mi ambición es llegar a ser un investigador notable».
Intervino en política y se libro por poco de ser deportado, sus ideas políticas lo expusieron a las minas de Siberia. Predicaba el ateísmo a sus camaradas quienes le pusieron el apodo de «Dios no existe». Un poco antes del final de curso, se aprendía precipitadamente las lecciones descuidadas durante los meses anteriores, y gracias a su prodigiosa memoria, que más que cerebro humano parecía una grabadora, obtenia el primer lugar y ganado una medalla de oro.
Metchnikoff siempre enviaba trabajos a las revistas científicas, que escribía después de atropellados exámenes obtenidos impetuosamente poco después de examinar, bajo el microscopio, cualquier sabandija o escarabajo. Al observar al día siguiente el mismo bicho, se encontraba con que aquello de que había estado tan seguro el día anterior había cambiado, y apresuradamente enviaba una carta al editor de la revista:
Metchnikoff se quejaba porque sus profesores no valolraban su talento. El Origen de las especies, de Darwin, fue para él un hallazgo y a partir del aquel momento la Evolución se convirtió en su religión, hasta que por su propia cuenta empezó a fundar nuevas religiones científicas. Atrás quedaron sus proyectos de suicidio. A diferencia de Koch y de Leeuwenhoek, que fueron grandes porque supieron cómo interrogar a la Naturaleza, Metchnikoff leía libros sobre la Evolución, se inspiraba, exclamando: «¡Sí, así es!»; algunas veces tuvo razón y muchas, sin razones.
Metchnikoff no sabía ni una sola palabra sobre los microbios, pero su manía por demostrar la supervivencia del más apto lo conducía hacia una teoría propia, fantástica y, hasta cierto punto, acertada, de cómo la humanidad resiste los embates de los gérmenes dañinos.
Los primeros treinta y cinco años de la vida de Metchnikoff fueron tumultuosos, y una casi desastrosa búsqueda por la fama, hacía experimentos sobre el desarrollo de las cantáridas, esponjas, gusanos y escorpiones, tratando de hacer algún descubrimiento sensacional que le proporcionara una cátedra bien remunerada…
«No sobreviven los mejores, sino los más hábiles», era su tesis o una de ellas. Su esposa Ludmilla tras sufrir una malvada tuberculosis de la que el no se preocupo demasiado, Metchnikoff, que se había adicionado a la droga, viajo por España y llegar a Ginebra, tomando cada vez dosis mayores del estupefaciente. ¿Para qué seguir viviendo? e ingirió una dosis mortal de morfina pero que, por excesiva, le produjo náuseas y vómito.
—¿Para qué seguir viviendo? — exclamó de nuevo; y después de tomar un baño caliente se lanzó al aire frío de la calle, con el propósito de que una pulmonía pusiese fin a su vida; pero, al parecer, los dioses sabios e ingeniosos que modelan a los investigadores, le tenían reservado otro destino. Aquella misma noche se detuvo, asombrado, ante el espectáculo de una nube de insectos revoloteando alrededor de un farol.
—Estos insectos sólo viven unas cuantas horas —se dijo—. ¿Cómo es posible aplicarles la teoría de la supervivencia del más apto? —y se enfrascó, de nuevo, en sus experimentos.
Dos años después de la muerte de Ludmilla, conoció a Olga, inteligente muchacha de quince años, poco después se casaron.
Eto hizo que Metchnikoff fuera algo mas feliz. La idea del suicidio ya no lo obsesionaba, siempre aplicó su religión, que era la ciencia, de su vida.
Fue en 1883 Metchnikoff se transformó en cazador de microbios. Y empezó a estudiar la digestión de los alimentos en las esponjas y en las estrellas de mar, mucho tiempo antes había descubierto en el interior de estos animales unas células errantes que formaban parte de sus cuerpos, pero que eran independientes, por así decirlo, puesto que se movían de un lado para otro y alargaban una parte de ellas mismas, tales eran aquellas células que se movían fluyendo, exactamente como los pequeños animales llamados amebas.
Ni mas ni menos que descubrió la inmunología. Esas células errantes del cuerpo de las larvas de las estrellas de mar comen los alimentos, engloban las partículas de carmín, pero también deben de comerse los microbios. Nuestras células errantes, los glóbulos blancos de nuestra sangre, deben ser las que nos protegen contra los microbios invasores, son seguramente la causa de nuestra inmunidad a las enfermedades, son las que impiden que la raza humana sucumba ante los bacilos maléficos.
-Aquí está la explicación de por qué los animales resisten los ataques de los microbios, el doctor Virchow, el mismo que había recibido fríamente a Koch, creyó en Metchnikoff.
Necesito un nombre científico para esas células que comen microbios, un nombre griego. iFagocitos! Fagocito significa en griego célula que come. Tal es el nombre que debe usted darles.
A partir de aquel momento predicó fagocitos, se llenó de enemigos a causa de ellos, y no cabe duda de que contribuyó con ellos a la declaración de guerra de 1914, por las relaciones tirantes que con tal motivo había creado entre Francia y Alemania.
Metchnikoff necesitaba una prueba evidente de su teoría, y la encontró muy clara, por cierto, en las pulgas de agua. Busca pulgas de agua en acuarios y charcos; este ingenioso utilizó estos bichos, porque las larvas de las estrellas de mar, son transparentes, y podía, por tanto, ver perfectamente lo que ocurría en su interior. Metchnikoff pudo observar cómo las células errantes de la pulga de agua, sus fagocitos, se precipitaron contra las peligrosas agujas, rodeándolas, comiéndoselas, haciéndolas desaparecer. Cuando los fagocitos no daban batalla a las esporas, los invasores se transformaban rápidamente en fermentos vivos que a su vez se comían a la pulga de agua, envenenándolas y acabando con ella. En esta ocasión Metchnikoff presenció un espectáculo emocionante; una lucha a muerte en pequeña escala.
Hbia descubierto la manera, hasta entonces completamente misteriosa, cómo ciertos organismos vivos se defienden de los que quieren ser sus asesinos.
«La inmunidad de la pulga de agua, debida a la ayuda que le prestan sus fagocitos, es un ejemplo de inmunidad natural porque, cuando las células errantes no engloban y digieren las esporas de los fermentos en el preciso momento en que penetran en su cuerpo, los fermentos se desarrollan y segregan un veneno que no sólo rechaza a los fagocitos, sino que los mata, disolviéndolos por completo».
Los rusos se entusiasmaron con la proeza de Pasteur de salvar la vida a dieciséis de sus compatriotas mordidos por un lobo rabioso; Odesa y los campesinos del Zernstvo montaron un laboratorio en Odesa, olvidando momentáneamente que era judío, lle ofrecieron a Metchnikoff y este aceptó el cargo de director de tal laboratorio .
Fue presentado a Pasteur, y sin más preámbulos, Metchnikoff se entregó a largas explicaciones acerca de su teoría de los fagocitos, representando una verdadera película con la batalla entre las células y los microbios. Pasteur dijo Desde un principio he estado al lado de usted, profesor Metchnikoff, porque me ha llamado la atención la lucha entre los diversos microorganismos que he tenido ocasión de observar. Creo que está usted en el buen camino.
Tiene usted aquí un puesto para mí —preguntó Metchnikoff a Pasteur—. No deseo otra cosa que trabajar en sus laboratorios sin remuneración alguna— suplicó.
—No sólo puede usted venir a trabajar con nosotros, sino que tendrá un laboratorio para usted solo.
Metchnikoff abandonó Odesa y se fue al Instituto Pasteur e inauguró un espectáculo que duró veinte años.
Somos inmunes a consecuencia de una batalla librada entre nuestros fagocitos y los microbios merodeadores, este cuento de la buena pipa, había causado enorme sensación entre todos los investigadores europeos. «La mayor parte de los bacteriólogos de Alemania y Austria no creían en esa historia, por su sencillez, la rechazaban con extraordinaria violencia, poniendo en evidencia a Metchnikoff en los Congresos científicos y por la vía experimental. Por un momento se tambaleó Metchnikoff—, casi se desmayaba, pasaba las noches en claro, pensó en volver al paliativo de la morfina y hasta llegó a pensar de nuevo en el suicidio.
Insistio con todo su tesón —He demostrado que el suero de las ratas mata al bacilo del carbunco. Es la sangre de los animales, y no sus fagocitos, lo que los hace inmunes a los microbios gritaba Emil Behring, y todos los enconados enemigos de Metchnikoff asentían a coro.
—Son los fagocitos los que se comen los microbios y nos defienden de esa manera— rugía Metchnikoff, y daba a conocer experimentos ingeniosos, demostrando que los bacilos del carbunco se desarrollaban con exuberancia en la sangre de ovejas inmunizadas con la vacuna de Pasteur.
—Multiplico mis experimentos para apoyar mí teoría de los fagocitos— solía decir.
Para el Congreso de Londres de 1891. Metchnikoff vacunó unos cuantos conejillos de Indias con bacilos parecidos a los del cólera, y una semana después, o cosa así, inyectó en el vientre de los animales vacunados una nueva dosis de los mismos bacilos, vivos y virulentos. En las horas, que siguieron, cada diez minutos introducía unos finos tubos de cristal en el vientre de los pobres animales, y extraía unas cuantas gotas de líquido, que colocaba bajo la lente más o menos empañada del microscopio, para ver si los fagocitos de los animales inmunes se comían a los bacilos, así fue, las células errantes estaban atiborradas de microbios. «Ahora voy a demostrar que estos microbios, que los fagocitos llevan dentro, siguen estando vivos»—exclamó Metchnikoff, y para ello mató los conejos de Indias, y con otros tubos de cristal extrajo parte del sedimento gris de las células errantes, que se había acumulado en el vientre de los animales, para darse un banquete de microbios. Los fagocitos murieron al momento, porque son muy delicados cuando se trata de conservarlos vivos fuera del cuerpo, y al abrirse dejaron escapar los bacilos «vivos» que habían engullido; con gran presteza inyectó Metchnikoff estos bacilos, estos microbios que habían sido comidos por los fagocitos, a otros conejos de Indias no inmunizados, que murieron prontamente.
Un millar de investigadores habían acechado a los fagocitos en el acto de engullir gérmenes maléficos, y aunque esto no explicaba en modo alguno por qué muere un hombre de pulmonía, mientras otro rompe a sudar y mejora, no cabe duda de que en algunas ocasiones los fagocitos se comen y hacen desaparecer a los microbios de la pulmonía. Metchnikoff, pensó que un genio de la experimentación, `resolvería el enigma de por qué los fagocitos unas veces engullen microbios y otras no, y hasta, quién sabe, pudiera enseñar a los fagocitos a tener siempre apetito.
Metchnikoff había sonsacado a algunos ricos rusos, en estudiar la plaga venérea, intentando contagiarla a monos, tratando de descubrir el hasta entonces virus misterioso, prevenirla y curarla, si era posible: pero, sobre todo, lo que Metchnikoff quería era estudiar como la sífilis endurece las arterias. Con aquel dinero compraron monos; los gobernadores franceses del Congo tuvieron que enviar negros a dar una batida por las selvas en busca de esos animales, y poco después unas grandes salas del Instituto Pasteur resonaban con el babel de chillidos de chimpancés y orangutanes. Roux y Metchnikoff hicieron casi en seguida un importante hallazgo; sus experimentos eran ingeniosos y tenían una cierta seriedad y precisión extrañamente antimetchnikoffiana.
El laboratorio empezó a ser frecuentado por hombres desgraciados, recientemente contaminados de sífilis, con uno de estos inocularon a un mono, primer experimento que fue un éxito, pues el chimpancé adquirió la enfermedad. De ahí en adelante, y durante más de cuatro años, siguieron trabajando, transmitiendo la enfermedad de un mono a otro, buscando el oculto microbio sin lograr encontrarle, viendo la manera de atenuar el virus, como había hecho Pasteur con el germen desconocido de la rabia, con el fin de descubrir una vacuna preventiva.
Con Roux al lado, siempre meticuloso e insistiendo en experimentos bien comprobados, después de tanto teorizar acerca de la inmunidad, realizó uno de los ensayos más profundamente prácticos de toda la microbiología: inventó el ungüento gris a base de calomelanos, que en la actualidad está extirpando la sífilis de los ejércitos del mundo entero. Eligió dos monos, los inoculó con virus sifilítico recién extraído de un hombre, y una hora más tarde frotó con ungüento gris las escarificaciones hechas a uno de los monos, pudiendo comprobar que en el mono no tratado aparecieron todos los horribles síntomas de la enfermedad, mientras que no llegaron a aparecer en el mono tratado con ungüento. Después de esto, Metchnikoff convenció a un joven estudiante de Medicina, Maisonneuve de nombre, para que se prestase voluntariamente a ser inoculado de sífilis procedente de un enfermo. Ante la Comisión de los médicos franceses más ¡lustres, se presentó el valiente Maisonneuve para recibir seis largas incisiones, en las que fue depositado el peligroso virus; inoculación más grave que la que cualquier persona pudiera recibir naturalmente, y cuyos resultados podían haberle convertido en un despojo humano o haberle enviado, loco, a la muerte. Una hora estuvo aguardando Maisonneuve, pasada la cual, Metchnikoff plenamente confiado, le frotó las heridas con un ungüento gris, sin hacer la misma operación con las incisiones que, al mismo tiempo que al estudiante, había hecho a un chimpancé y a otro mono. El resultado fue soberbio, porque Maisonneuve no presentó el menor signo de ulcera maligna, mientras que, treinta días más tarde, la enfermedad hizo su aparición en los simios: no cabía duda acerca de la excelencia del remedio.
Metchnikoff, entretanto, seguía soñando y discurriendo que otras cosas podían contribuir al endurecimiento de las arterias, y de pronto inventó otra causa, y digo inventar, pues nadie puede asegurar que la descubrió.
La causa del endurecimiento de las arterias, lo que nos hace envejecer prematuramente, es seguramente la autointoxicación. el envenenamiento producido en nuestro intestino grueso por los microbios de la putrefacción— exclamó. El ideó pruebas químicas, horribles muchas de ellas, para comprobar si el cuerpo era envenenado por la vía intestinal.
—Viviríamos más tiempo si no tuviéramos intestino grueso. Hay datos de dos personas a quienes ha sido extirpado el intestino grueso y que continúan viviendo perfectamente sin él.
no fue a verlo, pero lo creyó, y la leyenda añadía que el alimento principal de aquellas gentes era la leche agria o «yogurt ».
Encargó a sus discípulos más jóvenes que estudiasen el microbio que agriaba la leche, con lo que al poco tiempo el célebre bacilo búlgaro ocupó un puesto preeminente entre las filas de medicamentos específicos.
—Este bacilo —explicaba Metchnikoff—, al producir ácido láctico, elimina los bacilos venenosos del intestino.
Y él mismo empezó a beber grandes cantidades de Yogurt, y más tarde, durante años enteros, se atracó de cultivos de bacilo búlgaro. Escribió copiosos tratados acerca de esta nueva teoría suya, que un periódico inglés serio calificó de como uno de los tratados científicos más importantes aparecidos después de «El origen de las especies» de Darwin. El bacilo búlgaro hizo furor; se fundaron Compañías para prepararlo, cuyos consejeros se enriquecieron vendiendo el estúpido microbio.
Metchnikoff vivió austeramente durante casi veinte años, siguiendo al pie de la letra su teoría, sin probar bebidas alcohólicas, sin fumar y sin permitirse otras extralimitaciones, haciéndose reconocer frecuentemente por los especialistas más notables de aquel tiempo. Las tostadas para el desayuno eran servidas envueltas en sacos de papel esterilizado, para evitar la contaminación por los bacilos autointoxicadores; constantemente hacía analizar sus diversos jugos y secreciones, y durante aquellos años tragó un sin fin de litros de leche agria y engulló billones de benéficos bacilos búlgaros.
Y después de todo esto, murió a los setenta y un años.
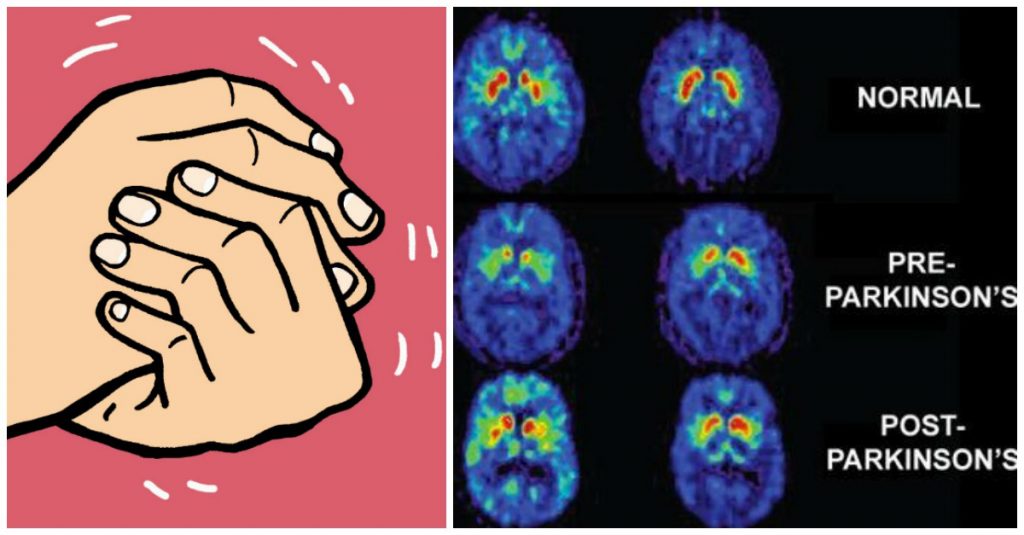
 La enfermedad de Parkinson y la inmunidad :
La enfermedad de Parkinson y la inmunidad : UN SISTEMA DE TRANSPORTE ESENCIAL EN NUESTRA CÉLULAS
UN SISTEMA DE TRANSPORTE ESENCIAL EN NUESTRA CÉLULAS MECANISMO DE REGULACIÓN INMUNE DE LOS VIRUS
MECANISMO DE REGULACIÓN INMUNE DE LOS VIRUS