 LA ANXIEDAD, ESTRÉS Y YOGA:
LA ANXIEDAD, ESTRÉS Y YOGA:
El Instituto Nacional de Salud Mental (NIMH) dice que más de 40 millones de personas en los EE. UU, mayores de 18 años sufren algún trastorno relacionado con la ansiedad, y esas son solo las personas que han sido diagnosticadas, o cuyos síntomas encajan en la condición descrita. La intensidad de sus componentes, y su duración, la hacen o no soportables
Por otro lado, la ansiedad en sí misma es una respuesta humana natural que cumple un propósito. Nuestro objetivo no debe ser descartarlo por completo, solo para que sea una parte saludable y manejable de nuestras vidas. Incluso si no padeces un trastorno relacionado con la ansiedad, es probable que hayas tenido que soportarla y afrontarlo de la mejor manera. La ansiedad es parte de nuestro mundo, del mismo modo que el estrés, la tristeza y la felicidad, pero la clave es entender cómo enfrentarlos y cómo evitar que se vuelva insalubre.
QUÉ ES LA ANSIEDAD
Una suma de sensaciónes de temor y aprensión que nos pone en alerta, por tanto la ansiedad no es una sensación es una percepción que es la suma de sensaciones.
En biología, todo tiene un termino medio con una base de sustentación que depende del individuo y sus condiciones. No es distinto del tono muscular, que es un grado sutil de contractura muscular que nos permite, no partir de cero, cuando iniciamos el movimiento.
Una ansiedad excesiva o mantenida , nos lleva a esta enfermedad, la patología mas frecuente en nuestros días. Nuestros cuerpos nunca desactivan la respuesta de lucha o huida , y vivimos con los efectos físicos y emocionales de la ansiedad en el día a día, incluso cuando no hay razón o causa para ellos.
Y QUE ES EL ESTRES .
El estrés (del latín stringere ‘apretar’1 a través de su derivado en inglés stress ‘fatiga de material’) es una reacción fisiológica del organismo en el que entran en juego diversos mecanismos de defensa para afrontar una situación que se percibe como amenazante o de demanda incrementada. Fisiológica o biológica es la respuesta de un organismo a un factor de estrés tales como una condición ambiental o un estímulo.2 El estrés es el modo de un cuerpo de reaccionar a un desafío. De acuerdo con el evento estresante, la manera del cuerpo a responder al estrés es mediante el sistema nervioso simpático de activación que da lugar a la respuesta de lucha o huida. Debido a que el cuerpo no puede mantener este estado durante largos períodos de tiempo, el sistema parasimpático tiene tendencia a hacer regresar al cuerpo a condiciones fisiológicas más normales (homeostasis). En los humanos, el estrés normalmente describe una condición negativa (distrés) o por el contrario una condición positiva (eustrés), que puede tener un efecto mental, físico e incluso de bienestar o malestar en un ser humano, o incluso en otra especie de animal.
Hans Selye nació en Viena en 1907. Ya en el segundo año de sus estudios de medicina (1926) empezó a desarrollar su famosa teoría acerca de la influencia del estrés en la capacidad de las personas para enfrenarse o adaptarse a las consecuencias de lesiones o enfermedades. Descubrió que pacientes con variedad de dolencias manifestaban muchos síntomas similares, los cuales podían ser atribuidos a los esfuerzos del organismo para responder al estrés de estar enfermo. Él llamó a esta colección de síntomas Síndrome del estrés, o Síndrome de Adaptación General (GAS).
Y QUE ES EL SÍNDROME DE ADAPTACIÓN GENERAL DE SELYE,
Es una respuesta del organismo ante una situación de estrés ambiental distribuida en tres fases o etapas:
1. Fase de alarma. Ante la percepción de una posible situación de estrés, el organismo empieza a desarrollar una serie de alteraciones de orden fisiológico y psicológico (ansiedad, inquietud, etc.) que lo predisponen para enfrentarse a la situación estresante. La aparición de estos síntomas está influida por factores como los parámetros físicos del estímulo ambiental (p.e. intensidad del ruido), factores de la persona, el grado de amenaza percibido y otros como el grado de control sobre el estímulo o la presencia de otros estímulos ambientales que influyen sobre la situación.
2. Fase de resistencia. Supone la fase de adaptación a la situación estresante. En ella se desarrollan un conjunto de procesos fisiológicos, cognitivos, emocionales y comportamentales destinados a «negociar» la situación de estrés de la manera menos lesiva para la persona. Si finalmente se produce una adaptación, esta no está exenta de costos, p.e. disminución de la resistencia general del organismo, disminución del rendimiento de la persona, menor tolerancia a la frustración o presencia de trastornos fisiológicos más o menos permanentes y también de carácter psicosomático.
3. Fase de agotamiento. Si la fase de resistencia fracasa, es decir, si los mecanismos de adaptación ambiental no resultan eficientes se entra en la fase de agotamiento donde los trastornos
Con un intento de saber a que atenernos, les vamos a llamar a este conjunto de molestias AEA.
Los trastornos que la condicionan son : . fisiológicos, psicológicos o psicosociales y tienden a ser crónicos o irreversibles..
Las manifestaciones con que mostramos, AEA, son una mezcla de síntomas somaticos y psíquicos.
Cuesta trabajo definir cada una de estas manifestaciones a nivel clínico y verlas como una sucesión de acontecimientos que la van agravando, parece mas fácil. La ansiedad puede surgir como resultado del estrés. Los factores de estrés pueden hacer que una persona se sienta triste, enojada, preocupada o ansiosa, mientras que la ansiedad es específicamente la sensación de temor y aprensión.
De forma que ponerle una forma abreviada que comprenda los tres procesos, ahorraría tiempo y esfuerzo.
No obstante sabemos lo difícil que es olvidar o cambiar conceptos, y por tanto yo no me hago ninguna idea de mantenerlo. Simplemente lo propongo
Lo que sí parece claro es que la comisión de ansiedad y estrés son consecuencias organicas de daños corporales externos o internos, y “ la reaccion e intensidad, depende del huésped y toda su dotación protectora, como la magnitud y persistencia de los estimulos inductores”. Y todo ello explicaría el síndrome de adaptación.
La descripción clínica de estas patologias, se repite y es personal en la anamnesis del enfermo. Afecta a lo físico y psíquico, desde grados soportables a insufribles. En un intento de unir estos tres procesos, utilizar la antigua DISTIMIA, y graduarlas según su intensidad, nos podría aliviar el problema siempre que estuviéramos de acuerdo que enumerar los componentes de estas, llene el patrón de AEAante mucho tiempo y algunos autores todavía la usan, se les llamo a este conjunto de molestias como “ DISTIMIA” y Sus manifestaciones en estracto son:.
No me gusta lo que antes me gustaba.
No duermo bien.
Estoy dolorido.
Estoy triste.
Las molestias digestivas varias, la gran sensación de conciencia que sucede a tu alrededor, el ligero miedo o la sensación de temor: eso es ansiedad y también estrés porque es una respuesta de adaptación como el síndrome de Seyle.
El síntoma dominante en esta patología es el psíquico antes que el físico, siempre que el paciente este despierto.. Es de nuevo responsabilizar al cerebro y a su contenido, la mente, de todo lo que pasa.
Sin embargo, antes de que tu cuerpo sienta los efectos, tu cerebro ya está trabajando. La guía del Instituto Nacional de Salud Mental para los trastornos de ansiedad también ofrece esta descripción de los procesos neurológicos en el trabajo.
Varias partes del cerebro son actores clave en la producción de esta patología, u, usando tecnología de imágenes del cerebro y técnicas neuroquímicas, los científicos para han descubierto que la amígdala y el hipocampo juegan un papel importante en la mayoría de los trastornos de ansiedad.
La amígdala es una estructura en forma de almendra en lo profundo del cerebro que se cree que es un centro de comunicaciones entre las partes del cerebro que procesan las señales sensoriales entrantes y las partes que interpretan estas señales. Puede alertar al resto del cerebro de que existe una amenaza y desencadenar una respuesta de miedo o ansiedad. Los recuerdos emocionales almacenados en la parte central de la amígdala pueden desempeñar un papel en los trastornos de ansiedad que involucran miedos muy distintos, como el miedo a los perros, las arañas o el vuelo.
El hipocampo es la parte del cerebro que codifica eventos amenazantes en recuerdos. Los estudios han demostrado que el hipocampo parece ser más pequeño en algunas personas que fueron víctimas de abuso infantil o que sirvieron en combate militar. La investigación determinará qué causa esta reducción en el tamaño y qué papel desempeña en los flashbacks, los déficits en la memoria explícita y los recuerdos fragmentados del evento traumático que son comunes en el PTSD.
Las hormonas “ norepinefrina y cortisol”, . están diseñados para darle un impulso a la percepción, los reflejos y la velocidad en situaciones peligrosas. Aumentan su ritmo cardíaco, le dan más sangre a sus músculos, llevan más aire a sus pulmones y, en general, lo preparan para enfrentar cualquier amenaza que esté presente. Tu cuerpo dirige toda su atención a la supervivencia. Idealmente, todo se apaga cuando pasa la amenaza y su cuerpo vuelve a la normalidad.
DeGroat explicó que hay una serie de teorías psicológicas sobre por qué existe la ansiedad. Está el neurológico (que mencionamos anteriormente), y el psicoanalítico, que describe la ansiedad como la batalla entre el yo el ego y el superyó. En esta batalla, explica, «la ansiedad sirve como una señal de peligro para el ego y / o superego de un individuo de que un individuo tiene un riesgo elevado de actuar sobre un impulso de identificación inaceptable. Ante esta ansiedad, el ego de un individuo y / o el superyó responde tratando de administrar los impulsos de identificación de un individuo a través de medios elevados «. Básicamente, la ansiedad es una señal de advertencia de que estás a punto de hacer algo que quizás no quieras. También está la teoría cognitiva, que sugiere que la ansiedad surge cuando las distorsiones cognitivas de una persona, o patrones de pensamiento irracionales, los hacen ver todo como una amenaza física, ya sea un peligro físico real, un compañero de trabajo molesto o un oficial de policía al costado del camino. En la teoría del comportamiento, la ansiedad es una respuesta aprendida debido a la exposición a situaciones atemorizantes o atemorizantes.
Al margen de la teoría que utilicemos para explicar el AEA , el daño que provoca esta patología viene dado por su activación y repetición. La respuesta al AEA, cuando es ordenada nos protege. Esta hecha para actuar cuando es necesario y desconectarlas cuando no lo es. Exactamente como toda la biología.
La AEA es el mayor problema de enfermedad en nuestros días.
Como toda patología, necesita de un yo, un genoma y un entorno que la agreda, la consecuencia es , Lucha o huida y cuando su acción no es modulable se llama INFLAMACION O REPARACION.
Qué duda cabe que el entorno es fundamental para el desarrollo de la salud física y psíquica , pero si el cerebro está sano y tiene que estar sano siempre, es capaz de repararse y aprender, pero no mucho, que entraría en las enfermedades por autoinmunidad, ni poco que entraría e n la inmunodeficiencias, sino lo justo.
Sea la causa del proceso genética o adquirida o ambas a la vez , crean un ambiente propicio para la AEA Cualquier emoción indeseable, y mantenida , ya sea miedo, frustración o duda, podría ser un desencadenante de AEA y desarrollar patrones de comportamiento , que desarrollen patrones de pensamiento que refuercen cada evento de t vida como una amenaza, y se convertirá en una interminable ciclo.
En General podemos decir que esta patología mortifica, si persiste o se incrementa. Intentar eliminar las causas, no es entendible dada la multitud de patógenos que estamos soportando. No es un problema de verticalidad, también de transversalidad. Cuando respondo al ataque aparecen nuevos patógenos o en cantidades lesivas.
Muchas personas han vivido en un estado de ansiedad durante tanto tiempo que no conocen ningún otro sentimiento, por lo que no están conscientes de que sufren de ansiedad persistente. Reconocer la ansiedad no es fácil en este tipo de situaciones, sin embargo, identificar sus banderas rojas es una buena manera de comenzar. ¿Eres pesimista sobre las situaciones más inocuas hasta el punto que te impide tomar riesgos? ¿Encuentra su mente corriendo hacia los posibles resultados negativos que podría haber? ¿Inmediatamente atribuyes alguna circunstancia externa a un resultado positivo que podría verse como el resultado de tus esfuerzos? Si su respuesta es ‘sí’ a estas preguntas, entonces puede sufrir de ansiedad persistente.
Para algunas personas, la ansiedad es situacional. Es normal sentirse nervioso ante la perspectiva de tener que hablar en público. No es normal sentir ansiedad por tener una conversación mundana con tu barista. La ansiedad situacional es una de esas cosas que solo podemos superar enfrentándola. La ansiedad generalizada es algo que solo se puede enfrentar tratando de reescribir el patrón de pensamiento que lo provoca.
Independientemente de si vive con ansiedad o padece una afección relacionada con la ansiedad, existen formas de tratar y disminuir el impacto de la ansiedad. Comienza con reconocer los efectos de la ansiedad y luego aprender las formas correctas de sobrellevarlo.
Lo que puedes hacer sobre la ansiedad
Una vez que haya reconocido los efectos de la ansiedad, es hora de hacer algo al respecto. No tienes que tratar de mantener la cabeza fuera del agua. Hay muchos trucos y técnicas que puede usar para salir de un estado de ansiedad o aliviar la ansiedad cuando la sienta subir. Aquí hay algunos.
Pase a Técnicas de relajación: música, meditación, ejercicio, sus rituales personales
Aprender algunas buenas técnicas de relajación le servirá bien. Por ejemplo, la respiración de ritmo simple puede sonar demasiado fácil, pero es una gran manera de convencer al cuerpo para que se relaje más. Es algo que puede hacer en su escritorio en el trabajo, en su automóvil y antes o después de un evento. Respire por cuatro segundos y luego salga por seis. Cuente en su cabeza y concéntrese en su conteo y la sensación de su respiración. Repita todo el tiempo que sea necesario para relajarse un poco.
.and it comes and goes.
El Dr. DeGroat sugirió la visualización como una técnica de relajación; que también menciono como un mecanismo . Imagine que se encuentra en el entorno más relajante en el que posiblemente pueda pensar, ya sea en su casa en la cama o en la playa en los trópicos. Donde sea que creas que estarías más relajado, detente y ponte realmente allí. Si estás en la playa, explicó, pregúntate qué tan cálido es, y si hay nubes en el cielo. ¿Estás solo? ¿Es tranquilo o puedes escuchar el océano? El objetivo aquí no es solo dibujar una imagen bonita y relajante en tu cabeza, sino también hacer que tu cerebro trabaje en esos detalles: cuanto más haces, más lejos estarás de lo que sea que haya desencadenado tu ansiedad.
Puede obtener un beneficio similar de la música, el ejercicio o la meditación. La música relajante puede ayudarte a despejar tu ansiedad o ayudarte a reenfocarte después de un ataque de ansiedad. El ejercicio es similar, pero en lugar de simplemente desviar tu mente, en realidad tiene un beneficio neurológico (además de uno fisiológico). Gil explicó que las endorfinas liberadas en nuestros cerebros durante el ejercicio nos hacen más felices, y la sensación de logro que obtenemos de la actividad regular puede ayudar a frenar la ansiedad. La meditación, especialmente la meditación guiada, también puede ayudar, ya que todo el asunto es calmar la mente y descartar los pensamientos errantes que provocan ansiedad y estrés . La meditación puede ayudar a tener presente el presente, en lugar de dejar que el fondo salga a relucir. Yoga: armoniza tu cuerpo y tu mente
Esta milenaria disciplina es uno de los mejores sistemas de cuidado integral que existen. En el yoga, cuerpo, mente y espíritu se fortalecen y serenan con la práctica de las asanas, la respiración y la meditación.
Qué es el yoga
Las asanas ayudan al yogui a purificar cuerpo y mente.
Más que una práctica, el yoga es un estilo de vida que sana, cuida y fortalece el cuerpo, la mente y el espíritu mediante la práctica de las asanas, la respiración y la meditación. Practicado en la India desde hace miles de años, se ha convertido en uno de los sistemas de acondicionamiento físico y espiritual con más adeptos en nuestros días.
El hinduismo es una de las culturas más complejas del mundo. El yoga forma parte de su tradición religiosa, espiritual, cultural y social. Hay textos de hace miles de años que ya hablan sobre prácticas de meditación, respiración, trascendencia del yo y una serie de posturas que ayudan al yogui a purificar su cuerpo: las asanas.
Existen más de cien tipos de yoga. En occidente se conocen y se practican diversos estilos que derivan del Hatha Yoga, uno de los más dinámicos. Los hay más espirituales, como el Yoga Kundalini, o más físicos y exigentes, como el Yoga Bikram, que se practica en una habitación caliente (a la temperatura normal en la India). Incluso existe un yoga facial para relajar y tonificar los músculos de la cara.
En qué consiste el yoga
Durante una sesión de yoga, que suelen durar entre una hora y una hora y media, se practican diferentes asanas o posturas armonizadas con la respiración, beneficiosas tanto para el cuerpo como para la mente. Las asanas tienen diferentes grados de dificultad, desde las más sencillas para principiantes, hasta las más extremas que practican los alumnos avanzados.
La mayoría de las clases suele comenzar con un calentamiento llamado “Saludos al Sol”, que comprende una sucesión dinámica de posiciones que se inician de pie y nos hacen bajar hasta el suelo para calentar y lubricar músculos y articulaciones. Todo ello combinado con la respiración, que nos ayuda a generar calor y energía corporal.
Después del calentamiento se comienza con las asanas o posiciones estáticas, siempre realizando una postura y su contrapostura para trabajar el cuerpo y la musculatura de forma equilibrada. Si la clase es dinámica, como en el caso del Yoga Flow, Power, Dinámico o Asthanga, las asanas se harán en movimiento, de forma fluida.
Todas las clases de yoga terminan con una relajación de unos 10 o 15 minutos en la que se devuelve al cuerpo y a la mente a la calma. Según el estilo de yoga o el profesor, también puede hacerse una meditación final.
El yoga puede practicarse en un centro especializado o club deportivo o, una vez que se ha aprendido la técnica correcta y las asanas, seguir una práctica personal (sadana), lo que nos permite hacer ejercicio y calmar nuestra mente estemos donde estemos.
 YO Y MIS CONCIENCIAS
YO Y MIS CONCIENCIAS 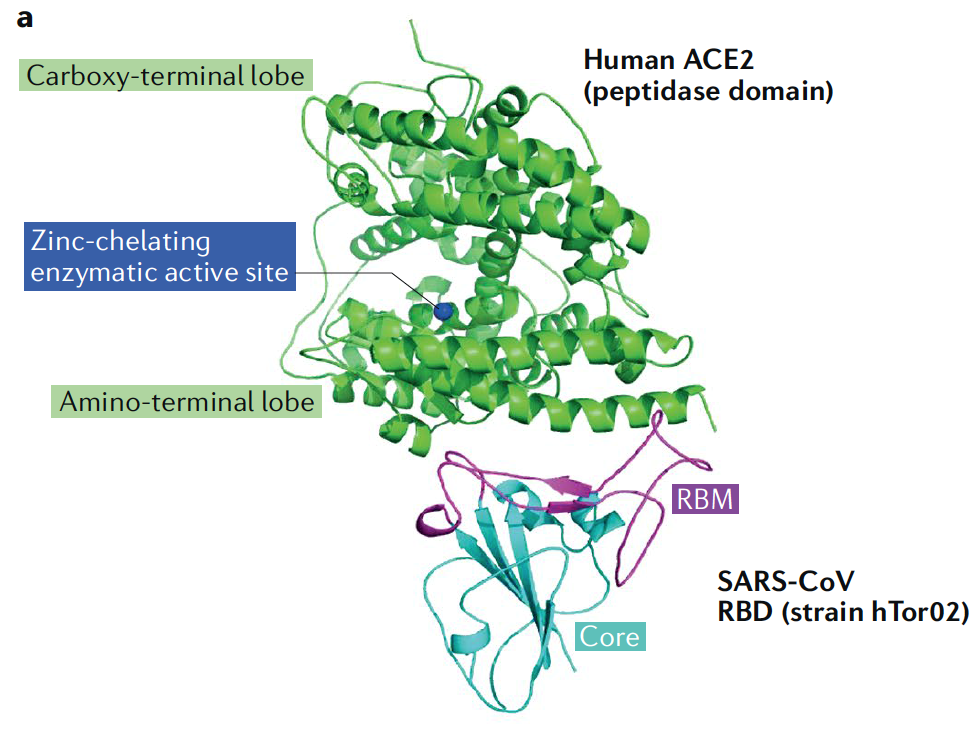 >CORONAVIRUS, INMUNOPATOGENIA VIRAL
>CORONAVIRUS, INMUNOPATOGENIA VIRAL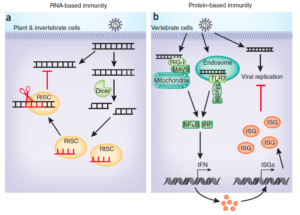
 Los inmunomoduladores evitan las complicaciones por coronavirus»
Los inmunomoduladores evitan las complicaciones por coronavirus» INMUNIDAD «DE REBAÑO» O «DE MANADA
INMUNIDAD «DE REBAÑO» O «DE MANADA 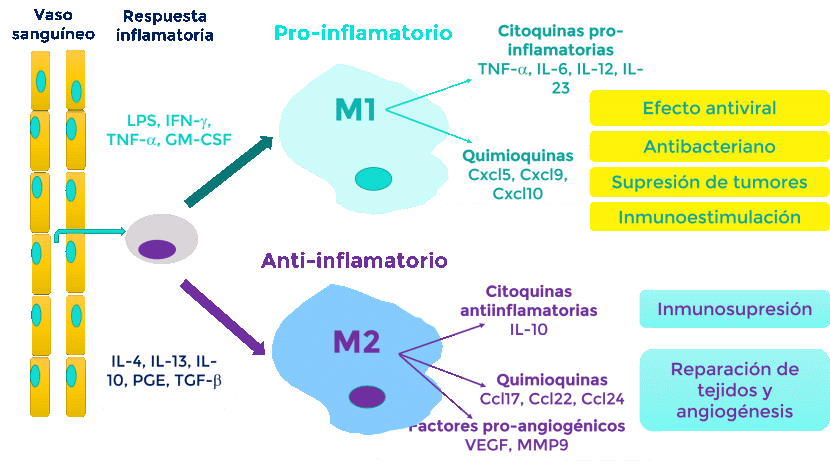 LA INFLAMACIÓN AMIGO O ENEMIGO
LA INFLAMACIÓN AMIGO O ENEMIGO  Creado un compuesto que inhibe la enzima principal del coronavirus
Creado un compuesto que inhibe la enzima principal del coronavirus ¿Los virus son inmortales?
¿Los virus son inmortales?